PD150606抑制凋亡诱导因子转位减轻心肌细胞缺氧/复氧损伤*
陈曾凤 罗涛
PD150606抑制凋亡诱导因子转位减轻心肌细胞缺氧/复氧损伤*
陈曾凤1罗涛2
(湖北医药学院附属太和医院, 1.老年科,2. 心内科, 湖北 十堰 442000)
目的 探讨PD150606减轻心肌胞缺氧/复氧损伤的作用及机制。方法 将原代培养的小鼠乳鼠心肌细胞分为3组:正常对照组、缺氧/复氧组(Hypoxia/reoxygenation,H/R)和PD150606+缺氧/复氧组(PD150606+H/R)。观察各组心肌细胞存活率、calpain活性、凋亡情况以及心肌细胞胞浆及细胞核中凋亡诱导因子(apoptosis-inducing factor,AIF)的表达。结果 细胞进行缺氧处理后存活率明显下降,复氧以后存活率会进一步下降;缺氧/复氧处理后心肌细胞中calpain活性明显升高。我们发现,与对照组相比,缺氧/复氧组中的细胞存活率明显下降,细胞凋亡率明显升高,同时我们注意到细胞浆中的凋亡诱导因子表达水平明显下降,而细胞核中的凋亡诱导因子的表达水平明显升高。然而PD150606能明显抑制缺氧/复氧引起的细胞存活率下降,凋亡率增加,以及凋亡诱导因子向细胞核的转位。 结论 PD150606可以减轻心肌细胞的缺氧/复氧损伤,其发挥保护作用的机制可能与其抑制凋亡诱导因子的转位有关。
PD150606; 缺氧/复氧-损伤; 凋亡诱导因子
再灌注治疗是目前急性心肌梗死最有效的治疗手段,但再灌注过程中突然的血流恢复会导致致死性的细胞损伤,即缺血-再灌注(ischemia-reperfusion,I-R)损伤。持续的心肌缺血引起显著的细胞坏死,再灌注时由于能量代谢恢复反而加强细胞凋亡[1]。细胞凋亡被认为是心肌梗死患者再灌注后心功能仍持续下降甚至发展为心衰的重要原因[2, 3]。阐明凋亡发生的分子机制对防治I-R损伤具有重要意义。Calpain是一类钙依赖的细胞内半胱氨酸蛋白酶,它参与调节机体多种生理过程,如细胞骨架重构、胞内信号转导、细胞凋亡等[4]。通过之前的一项研究,我们发现calpain抑制剂PD150606可减轻I-R心肌线粒体途径的细胞凋亡[5],然而确切的凋亡调节机制仍然不是很清楚,有待进一步深入研究。
1 材料与方法
1.1 实验动物 C57BL/6小鼠(出生1~3天内),雌雄不限,由第三军医大学实验动物中心提供。实验方案由第三军医学大学实验动物伦理委员会批准。
1.2 原代培养小鼠乳鼠心肌细胞 根据我们之前实验中的方法[6~8],将新生乳鼠消毒,取出心脏,清洗残留的血液后剪碎,用0.125%胰酶反复消化至组织块消失。过滤后离心5 min,弃上清,向沉淀加入含血清的培养基,差速贴壁纯化,计数后接种到细胞培养板中培养。实验采用原代培养48小时的心肌细胞。
1.3 缺氧/复氧模型建立 根据我们之前的方法[6~8],用无菌PBS洗涤细胞2次,尽可能地去除培养基;加入缺血培养基后将细胞置缺氧小室,持续通入95% N2和5% CO2混合气至氧含量低于1%,封闭缺氧小室置37 ℃培养箱,此过程模拟心肌缺血损伤;缺氧结束后,更换正常生长培养基,置CO2培养箱(5% CO2,95% 空气,37 ℃)培养,此过程模拟心肌再灌注损伤。
1.4 CCK-8法测定细胞存活率 根据我们之前实验方法[9],将心肌细胞接种于96孔板内,每孔加入CCK-8溶液10 μl,37℃避光孵育4小时,通过多功能酶标仪 Infinite M200(TECAN,瑞士)检测光吸收值。通过与正常对照组吸光值相比计算细胞存活率。
1.5 原位检测细胞凋亡 参照我们之前的实验方法[6],用末端脱氧核苷酰基转移酶介导性dUTP切口末端标记(TUNEL)和Hoechst33342共染色的方法检测坏死周边区域心肌细胞凋亡发生情况。简单来说,先将细胞用4%多聚甲醛固定,再用0.1% TritonX-100 柠檬酸钠通透。然后分别做TUNEL和Hoechst33342染色。最后计算各组TUNEL阳性心肌细胞占总细胞的比例。
1.6 Calpain活性检测 采用我们之前研究中应用的方法[10, 11],通过检测calpain的荧光底物AMC荧光变化反映calpain的活性。
1.7 Western blot检测AIF蛋白表达 按Beyotime公司的细胞核蛋白与细胞浆蛋白抽提试剂盒说明书操作分离细胞胞浆与细胞核蛋白。各组取等量蛋白通过SDS-PAGE凝胶电泳分离,电转移蛋白至NC膜上,室温下封闭1小时,然后与兔来源抗AIF多克隆抗体4℃孵育过夜, 用荧光标记鼠抗兔二抗孵育,用Odyssey红外激光扫描成像系统成像,通过条带的灰度值进行定量分析。
2 结果
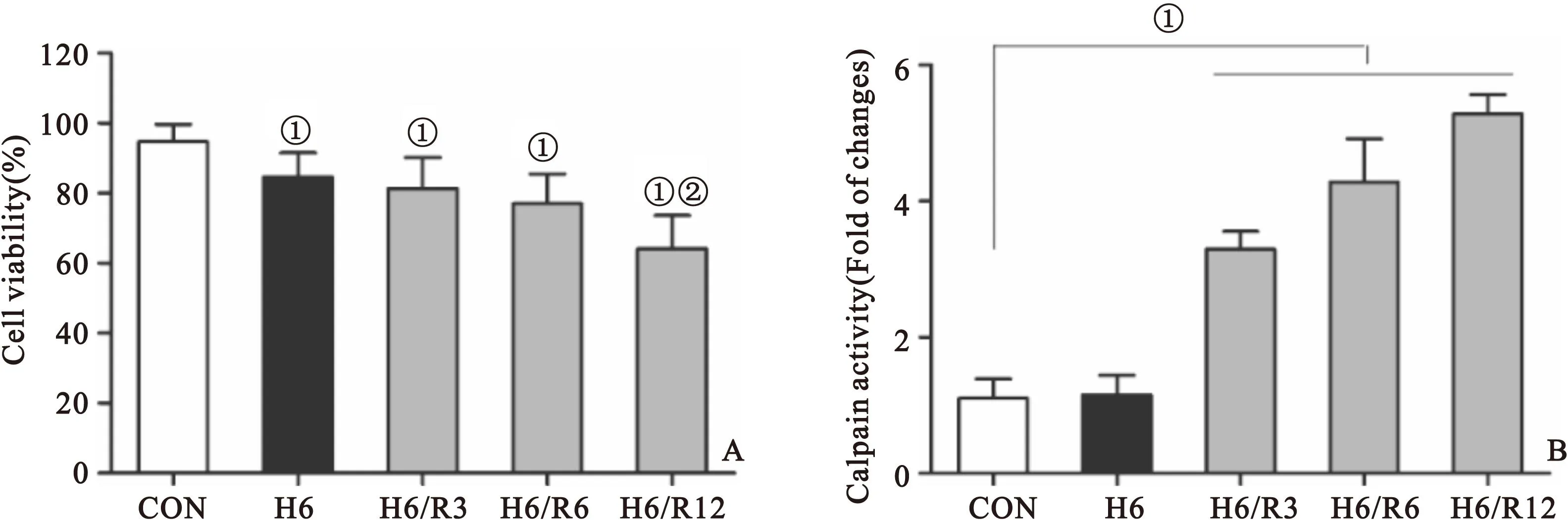
图1 缺氧/复氧对小鼠乳鼠心肌细胞存活率(A)及calpain活性(B)的影响
Figure 1 Cell viability and calpain activity of cardiomyocytes under hypoxia/reoxygenation
注:n=6,与CON比较,①P<0.05;与H6组比较,②P<0.05;CON:对照组;H6:缺氧6小时;H6/R3:缺氧6小时/复氧3小时
2.1 缺氧/复氧对心肌细胞存活率及calpain活性的影响 细胞在缺氧6小时以后存活率明显降低(与对照组相比,P<0.05);复氧12小时后细胞存活率进一步下降(与对照组及缺氧6小时组相比,P<0.05),见图1A。细胞在缺氧6小时calpain活性无明显变化,但缺氧6小时再复氧3、6及12 h,calpain活性逐渐增加(与对照组及缺氧6小时组对比,P<0.05),见图1B。
2.2 PD150606预处理对缺氧/复氧后心肌细胞存活率的影响 与对照组相比,缺氧/复氧处理组的心肌细胞活力明显下降(P<0.05),而PD150606预处理能显著改善缺氧/复氧引起的细胞活力下降(P<0.05),见图2。
2.3 PD150606预处理对缺氧/复氧后心肌细胞凋亡率的影响 与对照组相比,缺氧/复氧处理组细胞凋亡率明显增高(P<0.05);而PD150606预处理能明显抑制缺氧/复氧引起的细胞凋亡(P<0.05),见图3。
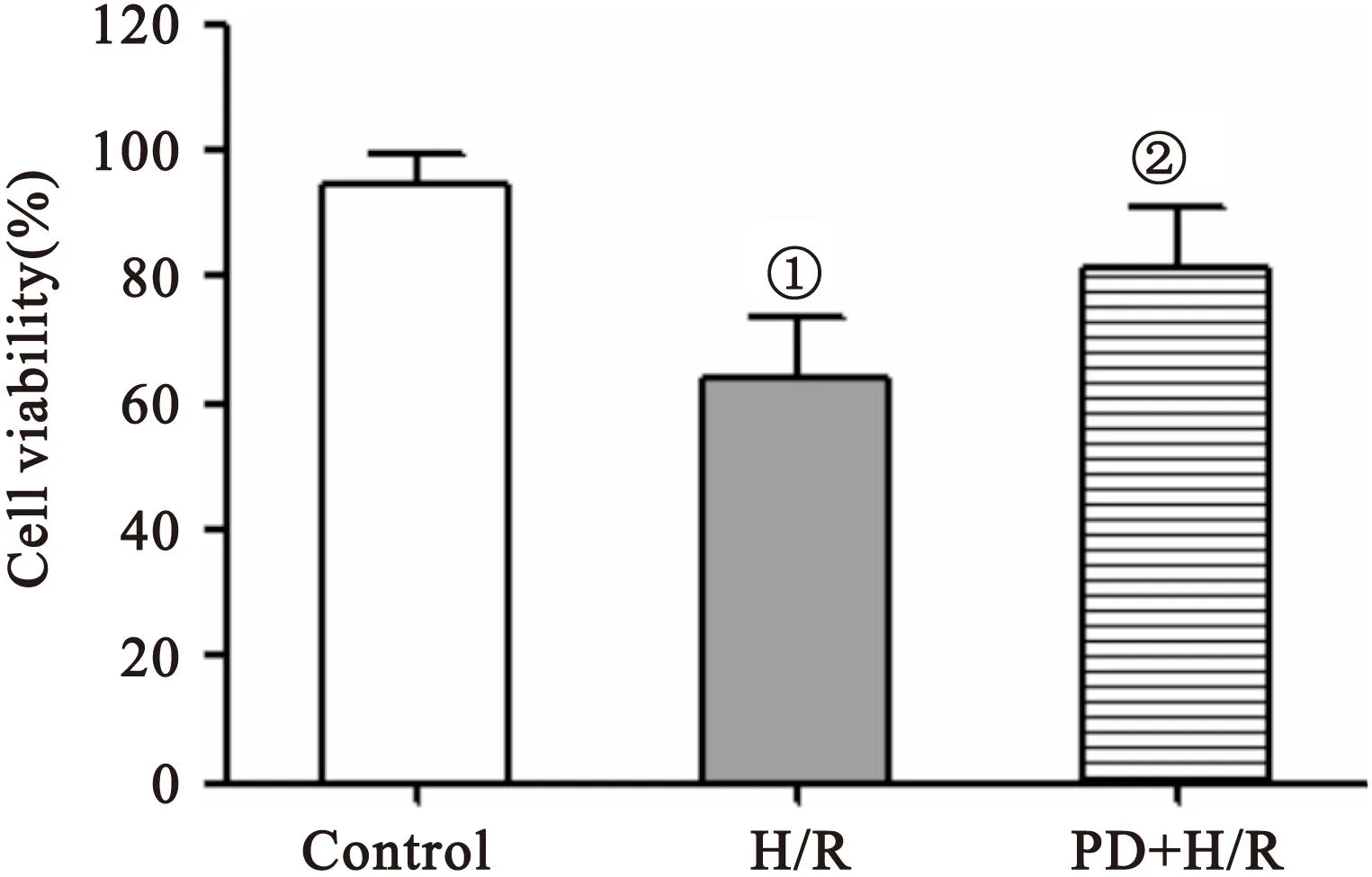
图2 PD150606对细胞存活率的影响
Figure 2 PD150606 improved the cell viability under hypoxia/reoxygenation
注:n=6,与对照组比较,①P<0.05;与H/R组比较,②P<0.05

图3 PD150606对细胞凋亡的影响
Fig 3 PD150606 reduced apoptosis caused by hypoxia/reoxygenation
注:n=6, 与对照组比较,①P<0.05;与H/R组比较,②P<0.05

图4 细胞浆及细胞核中AIF蛋白表达变化
Fig 4 Protein expression of AIF in cytoplasm and nucleus
注:n=6, 与对照组比较,①P<0.05;与H/R组比较,②P<0.05
2.4 PD150606预处理对缺氧/复氧后心肌细胞胞浆及细胞核AIF蛋白表达的影响 与对照组相比,缺氧/复氧组心肌细胞胞浆中凋亡诱导因子的蛋白表达水平明显降低(P<0.05);细胞核中凋亡诱导因子的蛋白表达水平明显升高(P<0.05),PD150606预处理则可抑制上述改变(P<0.05),见图4。
3 讨论
心肌缺血/再灌注损伤显著降低心肌梗死患者再灌注治疗的临床获益。然而心肌缺血/再灌注损伤发生的确切机制仍不是很清楚,临床上也缺乏疗效确切的治疗方法[12, 13]。因此,深入研究心肌缺血/再灌注损伤的发生机制,探索减轻心肌缺血/再灌注损伤的新方法仍然是目前研究的热点问题。
近年来,大量研究表明,calpain在心肌/缺血再灌注损伤中发挥重要的作用[5, 14, 15]。calpain属于钙依赖的巯基蛋白水解酶家族,生理情况下calpain活性受其内源性抑制剂calpastatin严格控制,在Ca2+超载、ROS过度生成等病理因素作用下calpain被过度或不恰当地激活引起组织损伤[4]。死亡受体信号途径(外源性凋亡途径)和线粒体凋亡途径(内源性凋亡途径)是主要的细胞凋亡信号转导通路,缺血/再灌注过程会引起线粒体途径的凋亡介导心肌损伤[16]。Joza N 等[17]发现线粒体凋亡途径除与Apaf1/caspase-9有关外,还可以由线粒体膜释放凋亡诱导因子介导完成。凋亡诱导因子是一种凋亡诱导蛋白,与细胞色素C一样位于线粒体膜,可在死亡信号的诱导下释放。有研究表明,缺血/再灌注损伤与AIF的转位密切相关[18,19]。因此我们推测calpain在缺血/再灌注损伤时介导细胞凋亡的作用可能与诱导AIF的转位有关,而calpain的抑制剂PD150606可能是通过抑制calpain激活来抑制AIF转位,从而减轻心肌细胞的凋亡。
在本研究中,我们通过缺氧/复氧处理造成原代培养的心肌细胞损伤,观察calpain的抑制剂PD150606的保护作用。我们通过TUNEL染色来检测不同处理组中凋亡细胞的比例,发现与对照组相比较,缺氧/复氧处理组中细胞凋亡率明显增高,而PD150606预处理能明显抑制缺氧/复氧引起的细胞凋亡,表明PD150606能够通过抑制心肌细胞凋亡减轻缺氧/复氧造成的心肌细胞损伤。同时为了进一步明确PD150606的保护作用是否与抑制AIF从细胞浆向细胞核的转位有关,我们通过Western blot分别对不同处理组中细胞的胞浆及细胞核中的凋亡诱导因子的表达进行了检测。发现与对照组相比,缺氧/复氧处理后心肌细胞胞浆中凋亡诱导因子的表达水平明显降低,而细胞核中凋亡诱导因子的表达水平明显升高。说明凋亡诱导因子核转位在缺氧/复氧引起的心肌细胞凋亡中发挥了重要作用。那么缺氧/复氧过程中calpain活化是否与凋亡诱导因子核转位存在联系呢?我们做了进一步的研究。与缺氧/复氧组相比,PD150606预处理组心肌细胞胞浆中凋亡诱导因子的表达水平明显升高,而细胞核中凋亡诱导因子的表达水平明显降低,表明PD150606预处理能抑制缺氧/复氧引起的AIF从细胞浆向细胞核的转位。
4 结论
PD150606减轻心肌细胞缺氧/复氧损伤的作用机制,与其抑制AIF从细胞浆向细胞核的转位,从而减少心肌细胞凋亡有关。
[1]Buja LM. Myocardial ischemia and reperfusion injury[J]. Cardiovascular pathology: the official journal of the Society for Cardiovascular Pathology, 2005, 14(4):170-175.
[2]Garg S, Narula J, Chandrashekhar Y. Apoptosis and heart failure: clinical relevance and therapeutic target[J]. J Mol Cell Cardiol, 2005, 38(1):73-79.
[3]Scarabelli TM, Gottlieb RA. Functional and clinical repercussions of myocyte apoptosis in the multifaceted damage by ischemia/reperfusion injury: old and new concepts after 10 years of contributions[J]. Cell Death Differ, 2004, 11(2):S144-152.
[4]Storr SJ, Carragher NO, Frame MC,etal. The calpain system and cancer[J]. Nat Rev Cancer, 2011, 11(5):364-374.
[5]Luo T, Yue R, Hu H,etal. PD150606 protects against ischemia/reperfusion injury by preventing mu-calpain-induced mitochondrial apoptosis[J]. Archives of biochemistry and biophysics, 2015,10(6):684-686..
[6]Yue R, Hu H, Yiu KH,etal. Lycopene protects against hypoxia/reoxygenation-induced apoptosis by preventing mitochondrial dysfunction in primary neonatal mouse cardiomyocytes[J]. PloS one, 2012, 7(11):e50778.
[7]岳荣川, 胡厚祥, 罗涛, 等. 番茄红素通过抑制细胞钙蛋白酶活化减轻心肌细胞缺氧复氧损伤[J]. 中华心血管病杂志, 2013, 41(8):654-658.
[8]Xu J, Hu H, Chen B,etal. Lycopene Protects against Hypoxia/Reoxygenation Injury by Alleviating ER Stress Induced Apoptosis in Neonatal Mouse Cardiomyocytes[J]. PloS one, 2015, 10(8):e0136443.
[9]Yue R, Xia X, Jiang J,etal. Mitochondrial DNA oxidative damage contributes to cardiomyocyte ischemia/reperfusion-injury in rats: cardioprotective role of lycopene[J]. Journal of cellular physiology, 2015, 230(9):21268-2141.
[10]Hu H, Li X, Li Y,etal. Calpain-1 induces apoptosis in pulmonary microvascular endothelial cells under septic conditions[J]. Microvascular research, 2009, 78(1):33-39.
[11]岳荣川, 胡厚祥, 罗涛,等. Calpain活化在H2O2诱导的成年小鼠心肌细胞损伤中的作用[J]. 西部医学, 2012, 24(3):426-429.
[12]Bernink FJ, Timmers L, Beek AM,etal. Progression in attenuating myocardial reperfusion injury: an overview[J]. International journal of cardiology, 2014, 170(3):261-269.
[13]Ibanez B, Heusch G, Ovize M,etal. Evolving therapies for myocardial ischemia/reperfusion injury[J]. Journal of the American College of Cardiology, 2015, 65(14):1454-1471.
[14]Hernando V, Inserte J, Sartorio CL,etal. Calpain translocation and activation as pharmacological targets during myocardial ischemia/reperfusion[J]. Journal of molecular and cellular cardiology, 2010, 49(2):271-279.
[15]Zhang CM, Gao L, Zheng YJ,etal. Berbamine protects the heart from ischemia/reperfusion injury by maintaining cytosolic Ca2+homeostasis and preventing calpain activation[J]. Circulation journal: official journal of the Japanese Circulation Society, 2012, 76(8):1993-2002.
[16]Scarabelli TM, Knight R, Stephanou A,etal. Clinical implications of apoptosis in ischemic myocardium[J]. Current problems in cardiology, 2006, 31(3):181-264.
[17]Joza N, Susin SA, Daugas E,etal. Essential role of the mitochondrial apoptosis-inducing factor in programmed cell death[J]. Nature, 2001, 410(6828):549-554.
[18]Zhang J, Li XX, Bian HJ,etal. Inhibition of the activity of Rho-kinase reduces cardiomyocyte apoptosis in heart ischemia/reperfusion via suppressing JNK-mediated AIF translocation[J]. Clinica chimica acta; international journal of clinical chemistry, 2009, 401(1-2):76-80.
[19]Choudhury S, Bae S, Ke Q,etal. Mitochondria to nucleus translocation of AIF in mice lacking Hsp70 during ischemia/reperfusion[J]. Basic research in cardiology, 2011, 106(3):397-407.
PD150606 protects against Hypoxia/reoxygenation-injury by preventing apoptosis-inducing factor’s translocation
CHEN Zengfeng1, LUO Tao2
(1.DepartmentofChronicDiseaseRehabilitation,TaiheHospital,HubeiUniversityofMedicine,Shiyan442000,Hubei,China;2.DepartmentofCardiology,TaiheHospital,HubeiUniversityofMedicine,Shiyan442000,Hubei,China)
Objective To investigate the protective role and mechanism of PD150606 on hypoxia/reoxygenation(H/R)-injury. Methods The primary cultured mouse cardiomyocytes were divided into control group, H/R group (the cardiomyocytes were underwent H/R-treatment) and PD150606+H/R group (the cardiomyocytes were pretreated with PD150606 before H/R-treatment). The survival of cardiomyocytes was counted. Apoptotic cells were detected by TUNEL assays. The translocation of apoptosis-inducing factor from cytoplasm into the nucleus were also determined in these groups respectively at the same time. Results Compared with control, the survival of cardiomyocytes was significantly decreased, and the apoptosis rate was significantly increased The protein level of apoptosis-inducing factor in cytoplasm was significantly decreased, while the apoptosis-inducing factor in nucleus was significantly increased(P<0.05). However, these effects of H/R on cardiomyocytes were abolished by PD150606(P<0.05). Conclusion PD150606 could alleviate hypoxia/reoxygenation(H/R)-injury by preventing apoptosis-inducing factor’s translocation.
PD150606; Hypoxia/reoxygenation-injury; Apoptosis-inducing factor
十堰市科学技术研究与开发项目(15Y17)
罗涛,Email: luotao1688@163.com
R-33
A
10.3969/j.issn.1672-3511.2016.03.012
2015-12-01; 编辑: 母存培)

