稻黑孢菌生物学特性及杀菌剂筛选
李戌清,傅鸿妃,李红斌(杭州市农业科学研究院,310024)
稻黑孢菌生物学特性及杀菌剂筛选
李戌清,傅鸿妃,李红斌
(杭州市农业科学研究院,310024)
摘要:研究了稻黑孢菌的生物学特性,并对防治药剂进行了室内筛选。试验结果表明,菌株HZ4111菌丝生长的最适条件为温度30℃、12 h光12 h暗的交替光周期、培养基pH值5.0曰在以可溶性淀粉和酵母膏培养基上菌丝生长较快渊日平均生长速率分别为9.63、14.25 mm/d冤,以山梨醇、乙醇和甘氨酸培养基上较慢渊分别为0、0、0.42 mm/d冤曰9种杀菌剂对菌株HZ4111菌丝生长均有较好的抑制作用,其中75%肟菌窑戊唑醇水分散粒剂、325 g/L苯甲窑嘧菌酯悬浮剂、250 g/L嘧菌酯悬浮剂效果最好,(50)分别为0.000 1、0.000 9、0.000 9 μg/mL曰70%丙森锌可湿性粉剂、75%百菌清可湿性粉剂、12.5%四氟醚唑水乳剂、325 g/L苯甲窑嘧菌酯悬浮剂、75%肟菌窑戊唑醇水分散粒剂对病菌孢子萌发有较好的抑制作用,MIC值均小于0.05 μg/mL。
关键词:稻黑孢菌曰生物学特性曰药剂筛选
李戌清(1982-),女,博士,高级农艺师,主要从事植物病害研究工作,E-mail:xq_li@126.com
本研究对采自浙江省杭州地区稻叶的稻黑孢菌进行了生物学特性测定和常用杀菌剂室内毒力测定,旨在寻找通过环境条件控制病害发生的途径,并筛选防治该病害的高效药剂,进而为稻黑孢菌的防治提供理论依据。
1 材料与方法
1
.1试验材料
①供试菌株稻黑孢菌HZ4111采自浙江省杭州地区的稻叶,常规分离、纯化后置于PDA培养斜面,4℃保存于实验室备用[21]。
②供试药剂供试药剂相关信息见表1。
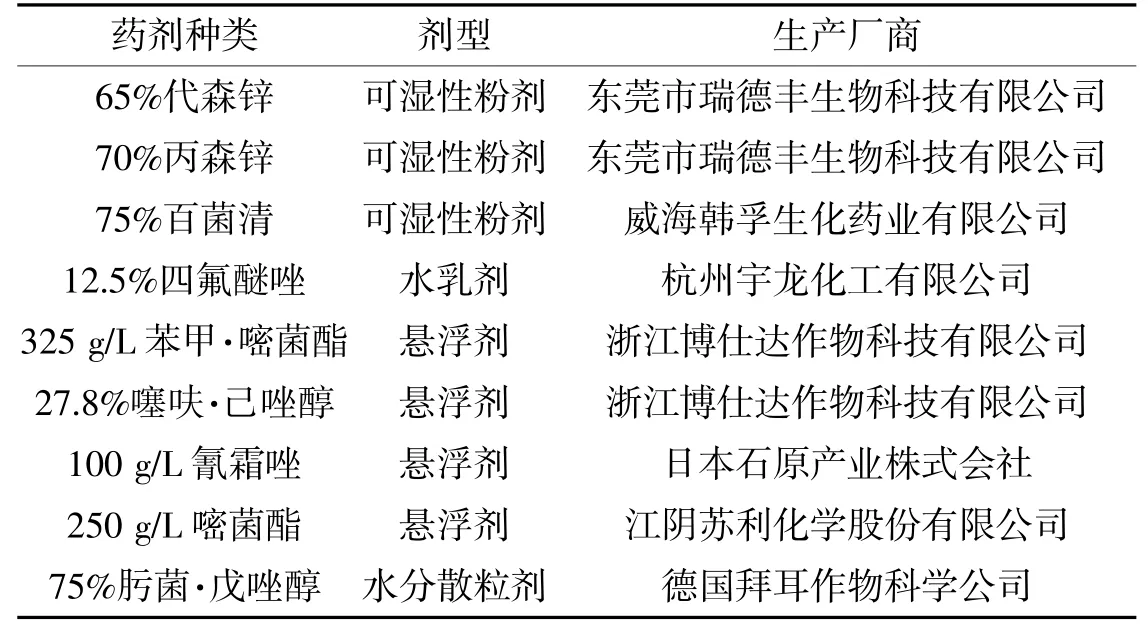
表1 供试药剂种类
1.2稻黑孢菌生物学特性观察
①温度、光照和pH值对菌株菌丝生长的影响从预培养1~2 d的病原菌菌落边缘取直径为14 mm的菌丝块接种到PDA平板中央,分别置于20、25、28、30、35℃5个不同温度梯度下培养,每处理4次重复,培养至3 d后使用直尺“十”字交叉法测量菌落生长直径,并计算菌丝日平均生长速率。接种菌丝块至PDA平板中央,30℃下分别置于24 h光、12 h光12 h暗、24 h暗下培养,每处理4次重复,菌落直径的测量和生长速率的计算方法同上。用0.1 mol/L HCl或NaOH将PDA培养基的pH值分别调至4.0、5.0、6.0、7.0、8.0、9.0[22],接种菌丝块,30℃培养,每处理4次重复,菌落直径的测量和生长速率的计算方法同上。
②不同碳、氮源对菌株菌丝生长的影响以查氏培养基(KNO32.00 g,K2HPO41.00 g,KCl 0.50 g,MgSO4·7H2O 0.50 g,FeSO40.01 g,蔗糖30.00 g,加水定容至1 000 mL)为基础培养基。以KNO3为氮源,以半乳糖、可溶性淀粉、甘露醇、果糖、麦芽糖、葡萄糖、山梨醇、乙醇、蔗糖等量替换基础培养基中的蔗糖,测定各碳源对菌株生长的影响,以无碳源查氏培养基为对照,每处理4次重复,30℃培养3 d后使用直尺“十”字交叉法测量菌落生长直径,并计算菌丝日平均生长速率。以蔗糖为碳源,以甘氨酸、谷氨酰胺、脯氨酸、酵母膏、硫酸铵、牛肉浸膏、胰蛋白胨、氯化铵、硝酸钾等量替换基础培养基中的KNO3,测定各氮源对菌株生长的影响,以无氮源查氏培养基为对照,每处理4次重复,30℃培养,菌落直径的测量和生长速率的计算方法同上。
③菌株菌丝生长对9种杀菌剂的敏感性测定采用菌丝生长速率法测定9种杀菌剂对菌株生长的抑制作用。用双蒸水将上述9种供试药剂配成0.1 g/mL母液,取适量母液与温度约60℃的PDA培养基混匀,制成药剂浓度分别为0(对照)、0.05、0.10、0.25、0.50、1.00、5.00 μg/mL的含药平板。从预培养1~2 d的病原菌菌落边缘取直径14 mm的菌丝块,接种到各含药平板上,每皿一块,置于30℃恒温箱内培养3 d,直尺“十”字交叉法测量菌落直径,每处理3次重复。计算各药剂浓度对菌丝生长的相对抑制率(%),其中相对抑菌率(%)=(1-处理菌落直径/对照菌落直径)×100%。
④菌株孢子萌发对9种杀菌剂的敏感性测定分别将1 mL含有0、0.05、0.10、0.25、0.50、1.00、5.00 μg/mL药剂的PDA培养基加入到48孔细胞培养板上,每列为同一浓度。待凝固后,取1 μL浓度为105个/mL的孢子悬浮液分别滴在含系列浓度药剂的细胞培养板排孔中,置于30℃恒温箱内培养3 d,肉眼观察孢子萌发生长情况,以明确各药剂的最小抑菌浓度(MIC)。每处理3次重复。
1.3数据统计与分析
所得数据经DPS统计软件进行处理分析,并求出毒力回归方程、及相关系数。
2 结果与分析
2.1温度、光照和pH值对菌株菌丝生长的影响
稻黑孢菌菌株HZ4111菌丝在20~35℃均能生长,但在30℃下菌丝生长速率显著高于其他供试温度,其平均生长速率为13.96 mm/d,35℃下生长最慢,为0.42 mm/d,表明高温对病原菌菌丝生长有较强的抑制作用(图1)。不同光照条件下菌落生长速率差异显著,在12 h光12 h暗的光暗交替条件下生长最快,其平均生长速率为21.04 mm/d,在24 h光条件下生长最慢,为11.25 mm/d(图2)。在pH值4.0~9.0范围内菌丝均能生长,其中pH值为5.0时菌落生长速率最快,其平均生长速率为15.54 mm/d,显著高于其他供试pH值;在供试pH值范围内,菌落生长速率随pH值的升高先升后降,且pH值为9.0时下降显著,表明该病菌对碱性环境条件敏感(图3)。
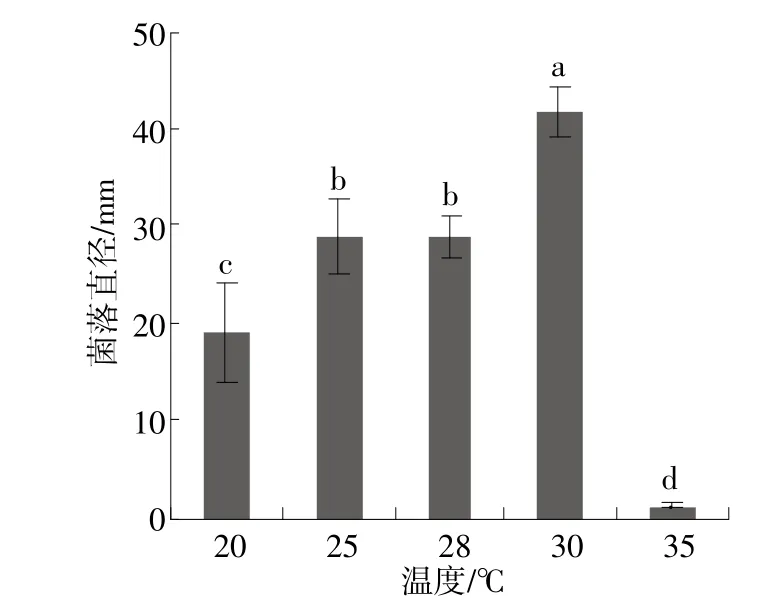
图1 温度对菌株HZ4111菌落生长的影响
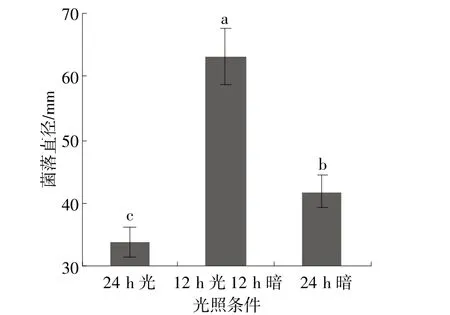
图2 光照条件对菌株HZ4111菌落生长的影响
2.2不同碳、氮源对菌株菌丝生长的影响
菌株HZ4111能利用多种碳、氮源营养,但不同氮源、碳源菌株菌丝生长存在一定差异。以可溶性淀粉为碳源的培养基上菌落生长最好,平均生长速率为9.63 mm/d,显著优于葡萄糖、麦芽糖、蔗糖、果糖、甘露醇、半乳糖、无碳源(CK)、山梨醇、乙醇,其中以山梨醇和乙醇为碳源的培养基上菌丝不能生长(图4)。不同氮源对菌丝生长的影响差异显著,以酵母膏培养基上菌落生长最好,线性生长率为14.25 mm/d,显著优于胰蛋白胨、氯化铵、牛肉浸膏、硫酸铵、无氮源(CK)、硝酸钾、谷氨酰胺、脯氨酸、甘氨酸,其中甘氨酸最差,生长速率0.42 mm/d(图5)。
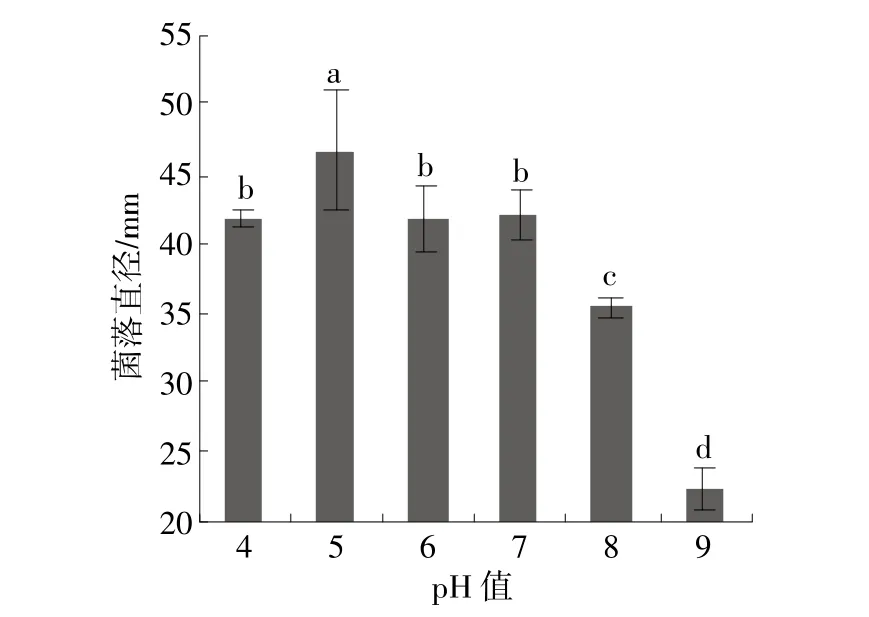
图3 pH值对菌株HZ4111菌落生长的影响
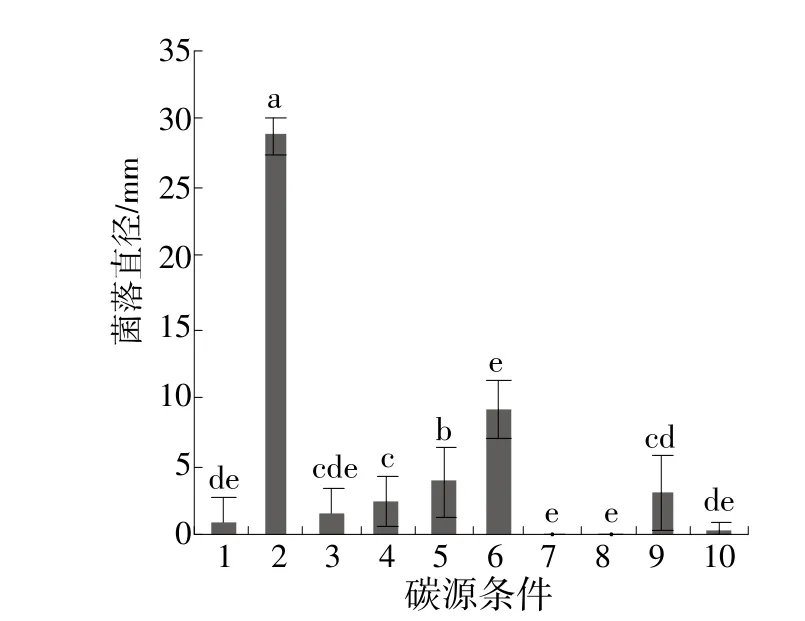
图4 不同碳源对菌株HZ4111菌落生长的影响
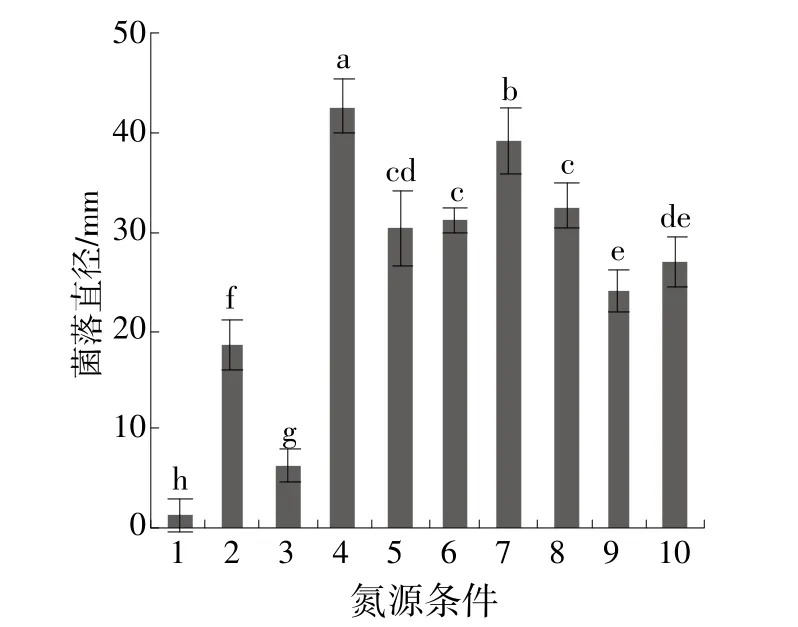
图5 不同氮源对菌株HZ4111菌落生长的影响
2.3菌株菌丝生长对9种杀菌剂的敏感性测定
由表2可知,9种杀菌剂对菌株HZ4111菌丝生长具有不同程度的抑制作用。其中肟菌·戊唑醇、苯甲·嘧菌酯、嘧菌酯效果最好,分别为0.000 1、0.000 9、0.000 9 μg/mL;其次是氰霜唑、四氟醚唑、噻呋·己唑醇、丙森锌,分别为0.0131、0.020 3、0.020 3、0.068 4 μg/mL;代森锌、百菌清效果最差,分别为0.109 3、0.421 3 μg/mL。
2.4菌株孢子萌发对9种杀菌剂的敏感性测定
经观察可知,氰霜唑的MIC值大于5 μg/mL;嘧菌酯的MIC值为1~5 μg/mL;代森锌、噻呋·已唑醇对菌株HZ4111的MIC值为0.5~ 1 μg/mL;丙森锌、百菌清、四氟醚唑、苯甲·嘧菌酯、肟菌·戊唑醇的MIC值小于0.05 μg/mL。即丙森锌、百菌清、四氟醚唑、苯甲·嘧菌酯、肟菌·戊唑醇对病菌孢子萌发有较好抑制作用,代森锌、噻呋·己唑醇抑制效果一般,嘧菌酯、氰霜唑较差。
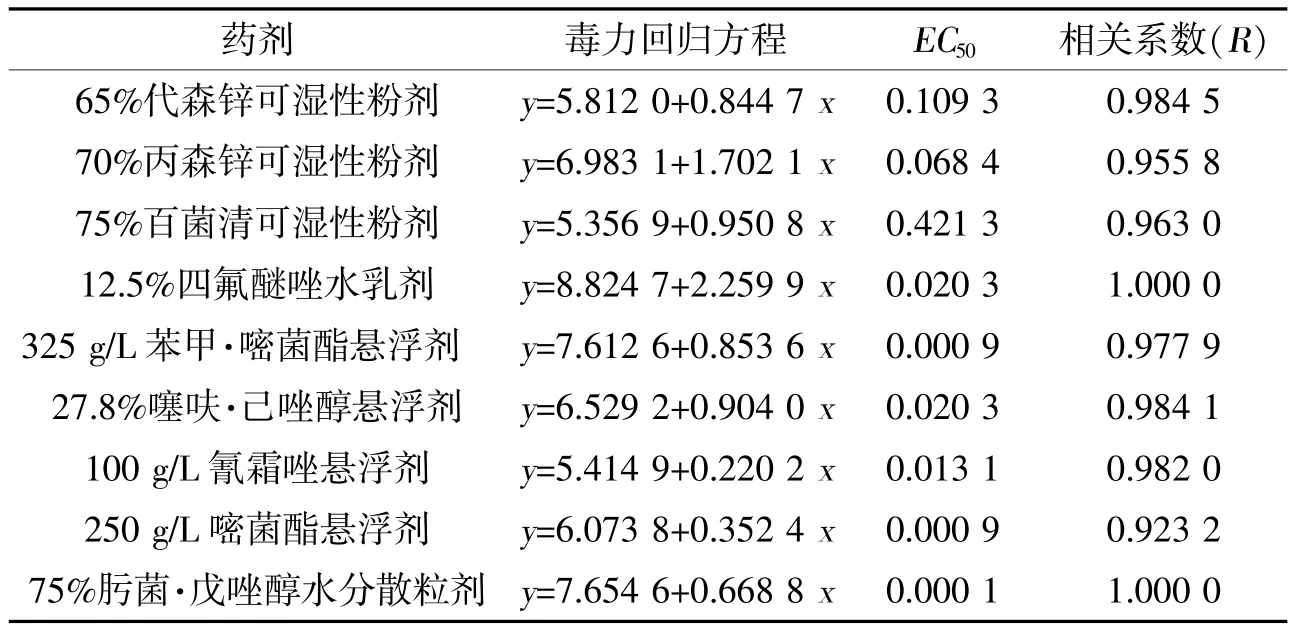
表2 9种杀菌剂对稻黑孢菌菌株HZ4111菌丝生长的毒力
3 结论与讨论
参考文献
[1] Blaszkowski J. The occurrence ofBerk. and associated mycoflora in seeds of wheat cultivated in the Szczecin voivodeship[J]. Acta Mycol, 1994, 29(1): 43-52. [2] Blaszkowski J. The influence of fungicides on the mycoflora of leaves ofL. [J]. Acta Mycol, 1994, 29 (1): 147-157.
[3] Blaszkowski J, Piech M. Comparison of seed-borne fungal communities of naked and husked oats and barley [J]. Phytopath Pol, 2002, 24: 71-74.
[4] Domsch K H, Gams W, Anderson T. Compendium of soil fungi [M]. London - New York - Toronto - Sydney - San Francisco: Acad Press, 1980.
[5] Kirk P M, Cannon P F, David J C, et al. Ainsworth & Bisby′s dictionary of the fungi. Ninth Edition [M]. CAB International, 2001.
[6] Neergaard P. Seed pathology [M]. London: The Macmillan Press Ltd, 1977.
[7] Piech M, Blaszkowski J. The influence of the degree of reproduction on the mycoflora of winter Xtriticosecale seeds [J]. Bull Pol Ac Sci Biol Sci, 1993, 41: 393-399.
[8] Khodke S W, Sandhya K. A new leaf spot of Ficus religiosa by[J]. Indian Phytopathology, 2012, 62 (2): 1 132-1 138.
[9] Zheng L, Shi F, Kelly D, et al. First report of leaf spot of
K
[10] Zhang L X, Li S S, Tan G J, et al. First report ofcausing leaf spot of cotton in China [J]. Plant Disease, 2012, 96(9): 1 379.
[11]梁力哲,Moller K.中国水稻种子上常见寄生性真菌的检验识别[J].植物保护,1989,15(2):42-44.
[12]徐敬友,王彰明,童蕴慧.水稻叶尖枯病病原种类研究[J].植物病理学报,1993,25(1):9-11.
[13]马炳田,王玲霞,李仕贵,等.四川省杂交水稻种子寄藏真菌研究[J].种子,2008,27(1):1-5.
[14]台莲梅,盖世武,辛惠普.黑龙江省垦区水稻种子病原真菌鉴定[J].黑龙江农业科学,2002(2):5-7.
[15],自清,程良.新疆水稻种子真菌区系的初步调查[J].八一农学院学报,1993,16(2):51-57.
[16]罗宽,王国平,黄声仪.水稻圆斑病初步研究[J].植物病理学报,1986,16(4):225-226.
[17]罗宽,王国平,黄声仪.水稻圆斑病研究[J].湖南农学院学报,1987(1):59-68.
[18]冯爱卿,汪文娟,曾列先,等.一种引致水稻稻叶褐条斑的病原鉴定初报[J].广东农业科学,2013(12):78-79,85.
[19]冯爱卿,陈深,朱小源,等.10种杀菌剂对水稻稻叶褐条斑病菌的室内毒力[J].植物保护,2014,40(4):193-197.
[20]费丹,檀根甲,罗道宏.安徽省水稻穗腐病病原鉴定及生物学特性研究[J].安徽农业大学学报,2014,41(5):777-782.
[21]方中达.植病研究方法.2版[M].北京:中国农业出版社,1979:189-190.
[22]马辉刚,李瑞明,胡水秀.番茄灰霉病菌生物学特性研究[J].江西农业大学学报,1998,20(2):207-209.
[23]白林,张应年,李生英.三唑类化合物的杀菌活性和植物生长调节作用[J].甘肃高师学报,2000,5(2):51-55.
[24]骆焱平,李元祥,赵培亮,等.甲氧丙烯酸酯类杀菌剂的研究进展[J].中国科技论文,2006,1(1):20-26.
Biological Characteristics and Fungicides Screening of
LI Xuqing, FU Hongfei, LI Hongbin
Abstract:We studied the biological characteristics ofand conducted the fungicides screening test in lab. The results showed that, the optimum condition for mycelia growth of HZ4111 was 30℃, 12 h light/12 h dark alternate illumination with pH value of 5.0. Mycelia grew faster on soluble starch medium and yeast extract medium, with average growth rates of 9.63 and 14.25 mm/d respectively, while mycelia grew slower on sorbitol medium, ethanol medium and glycine medium, with average growth rates of 0, 0 and 0.42 mm/d respectively. The nine fungicides had better effect on inhibiting mycelial growth of HZ4111, among them, 75% trifloxystrobin+tebuconazole water dispersible granule (WDG), 325 g/L difenoconazole+azoxystrobin suspension concentrate (SC) and 250 g/L azoxystrobin SC were the most effective inhibitors, with EC50 value of 0.000 1, 0.000 9 and 0.000 9 μg/mL respectively. 70% propineb wettable powder (WP), 75% chlorothalonil WP, 12.5% tetraconazole emulsion in water (EW), 325 g/L difenoconazole+azoxystrobin SC and 75% trifloxystrobin+tebuconazole WDG had better effects on inhibiting spore germination of HZ4111, with MIC value less than 0.05 μg/mL.
Key words:Biological characteristics; Fungicides screening
收稿日期:2015-12-11
基金项目:杭州市科委资助项目(20140432B10)
DOI:10.3865/j.issn.1001-3547.2016.06.030
中图分类号:S432.44
文献标识码:A
文章编号:1001-3547(2016)06-0080-05

