高住低练与低住低练训练下肥胖抵抗大鼠能量代谢比较研究
刘春阳,黄徐根
(安徽师范大学 体育学院,安徽 芜湖 241000)
高住低练与低住低练训练下肥胖抵抗大鼠能量代谢比较研究
刘春阳,黄徐根
(安徽师范大学 体育学院,安徽 芜湖241000)
摘要:目的:探究高住低练与低住低练两种训练模式下肥胖抵抗大鼠能量代谢的变化,明确两种训练模式对肥胖抵抗大鼠能量代谢影响的差异.方法:适应性训练后筛选出肥胖大鼠8只、肥胖抵抗大鼠24只,分别设肥胖低住安静组(ONS)、肥胖抵抗低住安静组(ORNS)、肥胖抵抗低住低练组(ORLL)、肥胖抵抗高住低练组(ORHL),实验第4周末,测定各组大鼠体重、体成分、血脂、食物摄入量、静息代谢率、血清瘦素水平.结果:实验末,ORLL组和ORHL组大鼠体重均显著低于ORNS组,虽运动组间体脂、肌肉相对重量无显著差异,但ORHL组股四头肌相对重量高于ORNS组;实验末,ORHL组TC、HDL-C水平低于其他各组,且其TG水平低于ORNS组;ORHL组食物摄入量低于ORLL组,且运动组食物摄入量均低于ORNS组;实验过程中,ORNS组静息代谢率呈下降趋势,而ORLL组和ORHL组静息代谢率则先升高再降低,实验末ORHL组静息代谢率降幅高于ORLL;实验末,虽ORHL和ORLL组间血清瘦素水平无显著差异,但ORLL组血清瘦素水平高于ORNS组.结论:长期高脂饮食,肥胖抵抗大鼠亦存在血脂紊乱现象.虽高住低练与低住低练都能有效控制大鼠体重、体脂的增长,但高住低练对肥胖抵抗大鼠血脂代谢有较好的调节作用,对机体瘦素敏感性有良好的影响.
关键词:低氧训练;能量代谢;肥胖抵抗
肥胖是由饮食、遗传等多种因素引起的慢性代谢疾病.上个世纪80年代国外学者发现用高脂饲料喂养的同一品系同批大鼠,一部分大鼠会发生肥胖,而另一部分大鼠虽然摄入高脂饲料,但并未产生肥胖,并将前者称为饮食诱导的肥胖(diet-induced obesity, DIO)大鼠,将后者称为饮食诱导的肥胖抵抗(diet-induced obesity resistance, DIO-R)大鼠[1].
现阶段,关于运动减体重的研究多从肥胖入手,探究肥胖抵抗机体能量代谢水平,明确运动干预下肥胖抵抗机体能量代谢变化,并比较其与肥胖机体能量代谢差异,有利于丰富运动减体重的理论研究.
本研究通过高脂饮食诱导,建立肥胖抵抗及肥胖大鼠模型,并采用低住低练、高住低练的训练模式对肥胖抵抗大鼠进行运动干预,探究两种训练模式对肥胖抵抗大鼠体重、体脂、肌肉、血脂、食物摄入量、静息代谢及瘦素水平的影响,以期为科学运动减体重提供理论依据.
1研究对象与方法
1.1研究对象
本研究采用10周龄雄性SPF级SD大鼠100只(购自安徽实验动物中心),体重251.89±23.57g.分笼饲养,自然光照,温度23±2℃,相对湿度40%-60%.大鼠适应性饲养一周后,随机取16只普通饲料饲喂,84只高脂饲料饲喂(供能比:蛋白质16.8%,脂肪44.1%,碳水化合物39.1%).
1.2建立大鼠实验模型及实验分组
建模第18周末,按体重增量大于普通饲料饲喂组体重增量均值加上1倍标准差作为肥胖标准,体重增量小于普通饲料饲喂组体重增量均值作为肥胖抵抗标准[2],筛选肥胖抵抗及肥胖大鼠若干只.随后进行两周强度逐渐上升的适应训练(14m/min-22m/min×40min/d).适应训练后,剔除运动能力太好、极差及有伤病的大鼠,保留肥胖大鼠8只,肥胖抵抗大鼠24只,具体实验分组安排见表1.

表1 实验大鼠分组及训练生活安排
1.3测试指标与方法
1.3.1体重指标实验前及实验第1、2、3、4周末,于大鼠训练后24h、禁食12h、禁水2h后用电子天平称量大鼠体重.
1.3.2体脂及肌肉重量实验第4周末,训练后24h、大鼠禁食12小时、禁水2小时,腹腔注射10%水合氯醛(大鼠体重5%)麻醉并处死大鼠.解剖并剥离肾周脂肪、附睾脂肪、腓肠肌、股四头肌及心肌,用电子天平称重.
1.3.3食物摄入量每天定时称量并添加每组大鼠饲料,每周末统计该周每组大鼠食物摄入量.
1.3.4静息代谢率的测定分别在实验前、实验第2周末和实验第4周末用德国TSE小动物代谢分析仪测定大鼠静息代谢率.
1.3.5血脂及瘦素水平实验第四周末采用腹主动脉取血,将血样放在37℃水浴静置1h,以3000r/min离心20分钟,提取血清.采用全自动生化分析仪测定TG、TC、HDL-C和LDL-C水平,使用南京建成ELISA瘦素试剂盒,采用酶联免疫吸附法(ELISA)测定大鼠血清瘦素水平(回归方程:Y=7.9152x2+9-6028x+0.4743,R2=0.9939).
1.3.6数据统计及处理采用SPSS19.0统计学软件处理数据,实验数据采用均值±标准差来表示,并用单因素方差分析或独立样本T检验分析,P<0.05为显著性差异,P<0.01为非常显著性差异.
2研究结果
2.1肥胖抵抗大鼠验证
饲养第20周末(建模18周及适应性训练2周),根据上述筛选标准选出肥胖抵抗大鼠、肥胖大鼠各8只,另从普通饲料喂养的大鼠中随机挑选8只符合标准的大鼠称重,处死并取血,测其血脂,剥离肾周及附睾脂肪并称量.
肥胖抵抗组肾周、附睾脂肪重量均低于对照组(P<0.05);肥胖组体重增量、肾周脂肪及附睾脂肪均显著高于对照组大鼠(P<0.05).
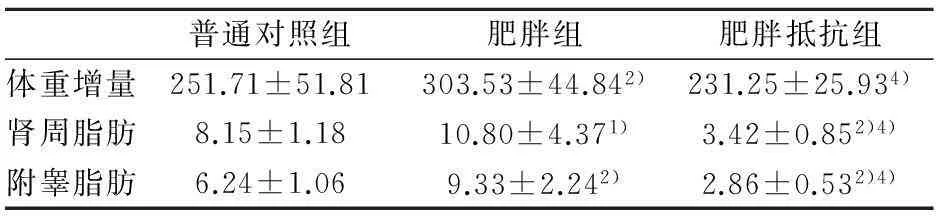
表2 建模第20周大鼠体重增量、体脂(g)
肥胖抵抗组、肥胖组与普通对照组对比,1)P<0.05,2)P<0.01;肥胖抵抗组与肥胖组对比3)P<0.05,4)P<0.01肥胖抵抗组与肥胖组TC、TG和LDL-C均显著高于普通对照组(P<0.05).

表3 饲养20周大鼠血脂(mmol/L)
肥胖抵抗组、肥胖组与普通对照组对比,1)P<0.05,2)P<0.01
2.2不同模式运动对各组大鼠体重的影响

表4 4周实验过程中各组大鼠体重变化(g)
同一时间不同组体重比较应用单因素方差分析中的Duncan检验,显著性水平为P<0.05,不同上标间差异显著,且a>b>c

表5 4周实验过程中各组大鼠体重降幅(g)
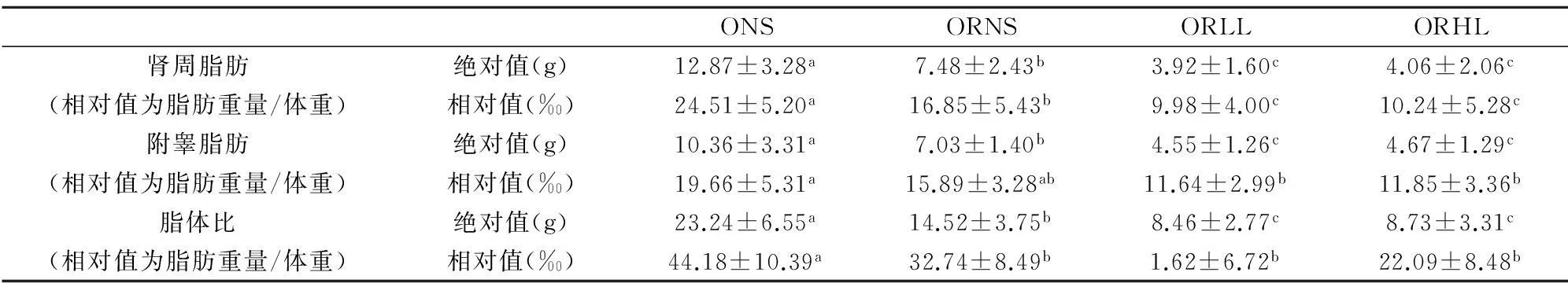
同一时间不同组体重降幅之间的比较应用单因素方差分析中的Duncan检验,显著性水平为P<0.05,不同上标间差异显著,且a 实验第4周末,ORLL组和ORHL组体重显著低于ORNS组(P<0.05),ORLL组和ORHL组;ORHL组前3周体重降幅较ORLL组大,但差异不显著(P>0.05). 2.3不同模式运动对各组大鼠体成分的影响 表6 实验后各组大鼠不同部位体脂含量 不同组同一体成分指标之间的比较应用单因素方差分析中的Duncan检验,显著性水平为P<0.05,不同上标间差异显著,且a>b>c 实验末,ORLL组和ORHL组间体脂无显著差异(P>0.05);ORLL组和ORHL组肾周脂肪绝对值显著低于ORNS组(P<0.05);ORLL组和ORHL组附睾脂肪绝对值与ORNS组差异不显著(P>0.05);ORLL组和ORHL组脂体比绝对值略低于ORNS组(P>0.05). 表7 实验后各组心肌、腓肠肌与股四头肌重量(g) 不同组同一体成分指标之间的比较应用单因素方差分析中的Duncan检验,显著性水平为P<0.05,不同上标间差异显著,且a>b 如表7,ORLL组和ORHL组间心肌和腓肠肌的绝对值无显著差异(P>0.05);ORHL组股四头肌绝对值显著高于ORNS(P<0.05);ORLL组股四头肌绝对值较ORNS组无显著差异(P>0.05). 2.4不同模式运动对各组大鼠血脂的影响 表8 4周实验后各组大鼠血脂值(mmol/L) 不同组同一指标的比较应用单因素方差分析中的Duncan检验,显著性水平为P<0.05,不同上标间差异显著,且a>b>c 实验第4周末,ORHL组TC水平显著低于其他各组(P<0.05);ORHL组TG水平显著低于ORNS组(P<0.05),ORLL组TG水平与ORNS组差异不显著(P>0.05);ORHL组HDL-C水平显著低于其他各组(P<0.05),ORLL组较ORNS组无显著差异(P>0.05);ORHL组LDL-C略低与其他各组,但差异不显著(P>0.05). 2.5不同模式运动对各组大鼠食物摄入量的影响 表9显示,ORLL组和ORHL组食物摄入量较低,其中ORHL组为ONS组的58.87%,ORLL组为ONS组的65.61%. 2.6不同模式运动对各组大鼠静息代谢的影响 实验过程中,ORNS组静息代谢率呈下降趋势,ORLL组和ORHL组实验中期静息代谢均上升,实验末期呈下降趋势,实验末ORHL组静息代谢率降幅低于ORLL组. 2.7不同模式运动对各组大鼠瘦素的影响 实验后,ORLL组的血清瘦素水平无显著差异(P>0.05),但ORLL组显著高于ORNS组(P<0.05);ONS组血清瘦素水平显著高于ORNS组(P<0.05). 表9 4周实验过程中各组大鼠食物摄入量(g) ()中数值为与同一时间肥胖低住安静组相比较各组大鼠食物摄入量的百分比 表10 试验过程中各组大鼠静息代谢率变化(ml 02/h/g2/3) 表11 试验过程中各组大鼠静息代谢率降幅(ml 02/h/g2/3) 表12 4周实验后大鼠瘦素水平(ng/ml) 不同组同一指标的比较应用单因素方差分析中的Duncan检验,显著性水平为P<0.05,不同上标间差异显著,且a>b>c>d 3讨论 目前,肥胖抵抗及肥胖大鼠建模,多仅从体重角度验证建模是否成功[3,4].本研究在建模末期用大鼠体重增量筛选出肥胖抵抗大鼠及肥胖大鼠,并用大鼠体重、体脂及血脂作为大鼠模型验证指标.本研究发现,肥胖抵抗大鼠较肥胖大鼠体重轻,且体脂显著低于肥胖大鼠,高脂饮食并没有引起肥胖抵抗大鼠过多体脂积累的现象,初步说明肥胖抵抗及肥胖大鼠建模成功.有研究表明,高脂饮食导致大鼠HDL-C水平升高[5,6];亦有报道表明,高脂饮食大鼠HDL-C水平低于普通饮食大鼠[7],而本实验结果显示,建模成功后高脂饮食下各组大鼠HDL-C较普通饮食大鼠并无差异,各实验大鼠高脂饲料配方不同可能是其因素之一.此外,各组血脂测试数据显示,虽然肥胖抵抗大鼠体重较轻,体脂较少,但由于长期高脂饮食,肥胖抵抗大鼠也存在血脂代谢紊乱现象. 有研究表明,高住低练能有效抑制运动员体重上升的趋势[8],本研究同时设高住低练与低住低练组,发现实验末二者体重无显著差异,且较肥胖抵抗安静组体重均下降.此外,实验初期高住低练组体重下降最为明显,随后体重降幅逐渐减缓,其主要原因可能是由于实验初期突然施加低氧与运动的双重刺激导致大鼠体重锐减,随后其体重降幅减缓,一方面因为大鼠逐渐适应低氧坏境,另一方面可能因为大鼠体重已降至一定水平. 一定强度运动能大量动员脂肪氧化供能,从而达到减体脂作用[9].有研究表明,长期高脂饲喂会致使大鼠体脂升高[10].本研究发现,各运动组体脂水平低于肥胖抵抗安静大鼠,但运动组间并无显著差异.亦有报道,低氧训练下大鼠骨骼肌相对重量高于常氧训练大鼠[11].而本研究显示,虽然各运动组间心肌、腓肠肌和股四头肌相对重量无显著差异,但高住低练组大鼠股四头肌相对重量显著高于肥胖抵抗安静大鼠,提示,高住低练组较低住低练更适合运动增肌. 高脂饮食会导致机体血脂代谢紊乱[12],运动有助于调节机体血脂代谢.从本实验结果看,肥胖抵抗高住低练大鼠血清TC、TG水平均显著低于肥胖抵抗安静组,LDL-C水平略低于肥胖抵抗安静大鼠,与实验前测比较,肥胖抵抗大鼠血脂代谢紊乱现象有所改善,显然,高住低练模式对大鼠血脂代谢的调节作用优于低住低练训练. 有研究表明,12周强度为75%最大摄氧量的有氧运动使机体HDL水平升高[13],亦有报道表明,运动对机体HDL水平没有影响,甚至会使女性HDL水平下降[14],还有文献显示,运动对大鼠HDL水平的影响呈现先降低后上高的趋势[15],本实验结果显示,高住低练模式使大鼠HDL水平下降,一方面大鼠在常氧高强度训练后在低氧环境并不能得到很好的恢复,另一方面,此现象可能不仅仅是长期运动造成的影响,还存在最后一次运动产生的延迟作用. Blundell JE等统计发现大部分学者认为运动会导致食欲下降[16].还有报道表明,低氧暴露下大鼠体重的下降的同时伴随着食物摄入量的下降[17].这与本研究结果一致,肥胖抵抗低住安静组、肥胖抵抗低住低练组、肥胖抵抗低住高练组食物摄入量分别是肥胖安静组的83.57%、65.61%、58.87%,肥胖抵抗高住低练组低于肥胖抵抗安静组,推断低氧运动过程中大鼠食物摄入量的下降是低氧运动下大鼠体重下降的原因之一. 机体每日维持心跳、呼吸、新陈代谢、消化储存食物等基本生理功能所需的能量消耗是机体能量消耗的重要组成部分,即维持机体清醒状态的最低能量是基础代谢率(basal metabolic rate).由于实验中不易达到基础代谢测定的严格条件,常采用大鼠安静状态下的能量消耗,即静息代谢率(resting metabolic rate)进行研究[18].基础代谢率与体重有一定关系,有研究表明哺乳动物的基础代谢率与其体重2/3次方呈正相关[19].本研究结果显示,随着时间推移,肥胖抵抗安静组静息代谢率逐渐下降.而各运动组实验第2周静息代谢率上升,实验末期呈下降的趋势,由于,运动初期大鼠机体应激性提高静息代谢率,到实验末期大鼠逐渐适应了运动及低氧刺激,致使静息代谢率呈现下降趋势.实验末期,肥胖抵抗高住低练组静息代谢率高于其他组,说明运动及低氧暴露能有效减缓大鼠静息代谢率下降的趋势. 研究发现,肥胖抵抗安静组食物摄入量为肥胖安静组的83.57%,肥胖抵抗安静大鼠静息代谢率明显高于肥胖安静大鼠,由此可见,肥胖抵抗大鼠能量代谢优于肥胖大鼠.由此推断,能量摄入高,静息代谢率低可能是导致肥胖的重要原因. 瘦素(Leptin,LP)是由美国的科学家道格拉斯·高尔曼和杰弗理·弗理德曼在20世纪60至80年代发现.瘦素是肥胖基因编码(ob)的一种分泌蛋白,参与体液调节,具有抑制食欲,控制能量摄入,增加能量消耗的作用;瘦素还作用于中枢神经系统,提高交感神经活性,激活细胞膜上β3-肾上腺能受体,增强脂肪燃烧,降低体脂.2000年后对瘦素的研究逐渐加深,发现乳腺上皮细胞、胎盘、胃黏膜上皮细胞等组织也能检测到瘦素,其受体不仅存在于丘脑、脂肪组织,还广泛存在于全身各个组织. 有大量研究发现,肥胖大鼠瘦素水平较高[20],本研究结果显示,肥胖抵抗大鼠瘦素水平显著低于肥胖大鼠,且肥胖大鼠体重、体脂水平高,静息代谢率较低,食物摄入量高于其他各组,出现能量代谢紊乱现象,说明肥胖大鼠高瘦素水平并不能发挥其抑制能量摄入,增加能量消耗的作用,肥胖大鼠机体可能存在瘦素抵抗现象,疲素敏感性低可能是造成机体肥胖的重要原因之一. 有研究表明,长期有氧运动下大鼠血清瘦素水平上升[21],还有报道表明,在不同低氧模式游泳运动下高住低练组瘦素水平低于低住低练组[22].本研究结果显示,长期运动能使大鼠血清瘦素水平升高,此外,虽运动组间血清瘦素水平无显著差异,但低住低练组大鼠血清瘦素水平较肥胖抵抗安静大鼠高.实验末,高住低练组大鼠静息代谢率高于低住低练大鼠,且高住低练组食物摄入量较低,推测,高住低练大鼠能量代谢优于低住低练大鼠,瘦素敏感性高于低住低练大鼠. 4小结 4.1虽然肥胖抵抗大鼠较肥胖大鼠体重低,体脂少,但由于长期高脂饮食,肥胖抵抗大鼠出现血脂代谢紊乱现象,对大鼠血脂代谢的调节作用,高住低练优于低住低练. 4.2高住低练初期大鼠体重下降明显,且高住低练具有良好的减体脂、增肌的作用. 4.3高住低练能导致肥胖抵抗大鼠食物摄入量的下降,且能有效抑制大鼠静息代谢逐渐下降的趋势.能量摄入低,静息代谢高是高住低练下大鼠体重下降的重要原因;此外,食物摄入量低、静息代谢高也是机体产生肥胖抵抗现象的一方面原因. 4.4高住代练血大鼠清瘦素水平较低住低练低,且前者食物摄入量低,静息代谢率高,推测高住低练模式下大鼠瘦素敏感性较低住低练高,高住低练有助于机体瘦素敏感性的提高. 参考文献: [1]LEVIN B E, HOGAN S, SULLIVAN A C. Initiation and perpetuation of obesity and obesity resistance in rats[J]. The American journal of physiology,1989,256(3Pt2):766-771. [2]马爽,刘莉,李岩溪,等.肥胖和肥胖抵抗大鼠脂肪组织PPARγ和aP2基因表达的研究[J].卫生研究,2009,38(2):163-165. [3]甘春龙,王庆福,赵大林,等.有氧运动对高脂膳食肥胖和肥胖抵抗大鼠胰腺神经肽Y受体mRNA表达的影响[J].沈阳体育学院学报,2012,31(5):68-72. [4]柏友萍,李萌,崔建飞,等.不同运动强度对青春期肥胖大鼠脂联素的影响[J].安徽师范大学学报:自然科学版,2014,4(37):394-400. [5]路瑛丽,张漓,冯连世,等.高脂饮食大鼠高住高练模型的建立[J].中国运动医学杂志,2012,5(31):438-442. [6]邓伟.中等强度耐力运动与葡萄籽原花青素对高脂馀食大鼠动脉粥样硬化形成干预作用及其机制探讨[J].安徽师范大学学报:自然科学版,2015,2(38):192.198. [7]周逢芳,蔡彬新,林跃鑫,等.太子参白茶水提物降血脂作用的研究[J].安徽农业大学学报,2015,42(1):18-21. [8]田中,李卫平,许豪文,等.模拟高住低练对优秀游泳运动员身体成分和物质代谢的影响[J].山东体育学院学报,2004,20(61):37-40. [9]张蕴琨,丁树哲.运动生物化学[M].北京:高等教育出版社,2006:86-88. [10]王双,胡丽贞,于海涛,等.饮食诱导肥胖与肥胖抵抗大鼠ATP生成量的比较[J].中华疾病控制杂志,2013,17(4):291-294. [11]黄徐根,冯连世,徐建方,等.低氧训练过程中大鼠体重及能量代谢的变化[J]体育科学,2007,10(27):61-68. [12]王辉.肥胖抵抗与肥胖大鼠代谢差异研究[D].北京:北京协和医学院基础学院,2010. [13]O'NEILL M, WATT M J, Heigenhauser George J F et al. Effects of reduced free fatty acid availability on hormone-sensitive lipase activity in human skeletal muscle during aerobic exercise[J]. Journal of Applied Physiology, 2004,97(5):1938-1945. [14]冯炜权,谢敏豪,冯连世,等.运动生物化学研究进展[M].北京:北京体育大学出版社,2006.71-85. [15]柏建清.有氧运动对大鼠血清脂蛋白水平的时相性影响[J].中国应用生理学杂志,2009,25(4):489-491. [16]BLUNDELL J E, KING N A. Physical activity and regulation of food intake: current evidence[J]. Medicine and science in sports and exercise, 1999,31(11):573-583. [17]SINGH S B, SHARMA A, SHARMA K N et al. Effect of high-altitude hypoxia on feeding responses and hedonic matrix in rats[J]. Journal of applied physiology, 1996,80(4):1133-1137. [18]ULRIKA A, JONAS T, TREEBAK et al. Exercise in rats does not alter hypothalamic AMP-activated protein kinase activity[J]. Biochemical and Biophysical Research Communications, 2005,329(2):719-725. [19]REEVES S R, GOZAL E, GUO S Z et al. Effect of long-termintermittent and sustained hypoxia on hypoxic ventilatory andmetabolic responses in the adult rat[J]. J Appl Physiol, 2003,95(2):1767-1774. [20]翟玲玲,赵剑,姚兴家,等.肥胖与肥胖抵抗大鼠瘦素、胰岛素水平分析[J].中国公共卫生,2007,23(7):785-786. [21]何玉秀,白文忠,姚玉霞,等.运动对腹部脂肪积累及肥胖基因表达的影响[J].体育科学,1998,18(4):69-72. [22]马延超,张缨,刘花层.不同低氧训练方式对血脂、体重及其变化机理的研究[J].中国体育科技,2007,43(5):136-140. ******* Research on Changes of Energy Metabolism in Obesity Resistance Rats Under the Two Training Pattern of Living High-Training Low and Living Low-Training Low LIU Chun-yang,HUANG Xu-gen (College of Physical Education, Anhui Normal University, Wuhu 241000, China) Abstract:Objective: To study the changes of energy metabolism in obesity resistance rats under the two training pattern of Living High-Training Low and Living Low-Training Low, so as to find out the difference between influence that the two training pattern have on energy metabolism in obesity resistance rats. Method: 8 obesity rats and 24 obesity resistance rats was screened out after adaptive training, obesity normoxic sedentary group(ONS), obesity resistance normoxic sedentary group(ORNS), obesity resistance Living Low-Training Low group(ORLL) and obesity resistance Living High-Training Low group(ORHL) were set up respectively. At the fourth weekend of the experiment, the weight, body composition, blood lipid, food intake, resting metabolic rate and leptin level in blood serum of rats in each group were measured. Result: At the end of the experiment, weight of rats in ORLL and ORHL are lower than that in ORNS significantly. Though there is no obvious difference between exercise groups in body fat and relative weight of muscles, the relative weight of Quadriceps in ORHL is higher than that in ORNS. At the end of the experiment, the TC level and HDL-C level in ORHL are lower than that in other groups, and the TG level in ORHL is lower than that in ORNS. Food intake in ORHL is lower than that in ORLL, and food intake in exercise groups is lower than that in ORNS. During the experiment, resting metabolic rate in ORNS is on the decline, while resting metabolic rate in ORLL and ORHL increase first and then decrease. At the end of the experiment, decreasing range of resting metabolic rate in ORHL is higher than that in ORLL. Though there is no obvious difference between ORHL and LRLL in leptin level in blood serum at the end of the experiment, the leptin level in blood serum in ORLL is higher than that in ORNS. Conclusion: Obesity resistance rats has blood lipid metabolic disorder when they have a long-term high fat diet. Although the weight and body fat of rats can be controlled effectively by Living High-Training Low and Living Low-Training Low, the blood lipid metabolic of obesity resistance rats can be regulated by Living High-Training Low. And Living High-Training Low has more effect in the Leptin sensitivity. Key words:hypoxic training; energy metabolism; obesity resistance 中图分类号:Q44 文献标志码:A 文章编号:1001-2443(2016)02-0198-07 作者简介:刘春阳(1988-),男,安徽合肥人,硕士研究生,研究方向:运动生物化学、低氧训练机理及应用;通讯作者:黄徐根(1974-),安徽安庆市怀宁人,副教授. 基金项目:安徽省自然科学基金(11040606M165);安徽高校省级自然科学研究重点项目(KJ2014A086). 收稿日期:2015-04-27 DOI:10.14182/J.cnki.1001-2443.2016.02.019 引用格式:刘春阳,黄徐根.肥胖抵抗大鼠高住低练与低住低练干预下能量代谢比较研究[J].安徽师范大学学报:自然科学版,2016,39(2):198-204.