水蕨中心体蛋白基因的克隆与原核表达
陈雪菲,王 尧,秦召远,王全喜,2,曹建国*
(1 上海师范大学 生命与环境科学学院,上海 200234;2 上海资源植物功能基因组学重点实验室 上海辰山植物园,上海 201602)
水蕨中心体蛋白基因的克隆与原核表达
陈雪菲1,王尧1,秦召远1,王全喜1,2,曹建国1*
(1 上海师范大学 生命与环境科学学院,上海 200234;2 上海资源植物功能基因组学重点实验室 上海辰山植物园,上海 201602)
摘要:蕨类植物的精子形成是一个运动细胞器重新发生的过程,但对其精子发生的分子机制仍不甚了解。中心体蛋白(centrin)是定位于细胞中心体上的一种高度保守的钙结合蛋白,被认为可能是最早参与运动细胞器发生的蛋白质。克隆鉴定centrin蛋白为进一步分析蕨类精子发生的分子机制奠定基础。该研究从蕨类模式植物水蕨(Ceratopteris thalictroides)中克隆到了水蕨centrin基因(CtCEN),其cDNA序列全长为1 077 bp,结构分析表明CtCEN基因属于EF-hand超家族的centrin基因。Centrin的系统树分析发现,藻类、蕨类以及动物等具鞭毛游动精子的生物聚为一支,而被子植物聚为另一分支,表明centrin的功能可能与运动细胞器鞭毛发生有关。原核表达和Western blot分析表明,CtCEN基因表达的蛋白能与人源centrin抗体发生结合,这一结果证实克隆到了centrin基因。
关键词:中心体蛋白;克隆;原核表达
中心体蛋白,即centrin最初是从绿藻(Tetraselmisstriata)中分离得到的一种钙结合蛋白,属于高度保守的EF-hand蛋白超家族[1],现已知centrin蛋白存在于从藻类、酵母到人类等所有生物的微管组织中心中[2]。衣藻中centrin主要参与鞭毛形成,是核-基体连接纤维的一个主要成分[3-4]。芽殖酵母centrin蛋白对细胞周期依赖性的纺锤体复制起重要作用[5]。Errabolu等从人中克隆及鉴定到了3个centrin同源蛋白[6-7],其中Hscen3在中心体复制中具有重要作用[8]。高等植物的centrin蛋白研究比较少,最早在拟南芥(Arabidopsisthaliana) 和烟草(Nicotianatabacum)中获得了centrin同源基因[9-11],但有关它们的功能未见报道。随后Klink等[12]在异形孢子蕨类苹(Marsileavestita)中克隆得到Mv-centrin,这个基因在苹小孢子发育阶段就已经发生转录并且以蛋白形式储存于未萌发的孢子中,此后在雄配子体发育和精子发生过程中,centrin蛋白参与了运动细胞器的形成过程[12]。综上所述,centrin蛋白在高等生物中主要参与中心体复制以及细胞分裂过程,而在低等生物中主要参与运动细胞器鞭毛的发生。蕨类植物是高等植物中的一个特殊类群,其精子发生是一个运动细胞器重新形成的过程,centrin蛋白极有可能参与了这一过程。本研究从蕨类模式植物水蕨[Ceratopteristhalictroides(L.) Brongn.]中克隆到centrin基因(CtCEN)并对其进行了验证,这对阐明centrin在蕨类精子发生中的功能以及进一步研究centrin蛋白参与运动细胞器形成的过程和分子机制奠定了基础。
1材料和方法
1.1材料
以无菌培养3周左右的水蕨成熟雄配子体为实验材料。载体pET-32a购买于北京全式金基因有限公司。菌株购买于北京博大泰克生物科技有限公司。人源centrin蛋白的鼠抗购买于上海熠晨生物科技有限公司。
1.2CtCEN基因的克隆
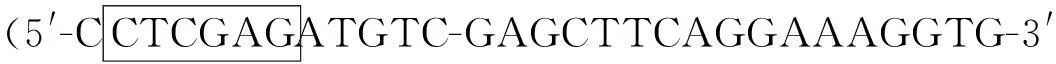
1.3CtCEN基因原核表达载体的构建
通过琼脂糖凝胶电泳检测CtCEN编码区PCR产物,采用DNA纯化试剂盒进行目的片段回收。使用限制性内切酶BamHⅠ和XhoⅠ对测序正确的目的基因和原核表达载体(pET-32a)分别双酶切,对酶切后的质粒和PCR产物分别进行回收,按1∶4的比例用T4DNA连接酶在16 ℃连接过夜。用连接产物转化DH5α感受态细胞,涂板挑取单克隆,测序检测重组目的基因。提取转化成功的重组质粒,命名为pET32a-CtCEN。
1.4CtCEN基因原核表达
将pET32a-CtCEN重组质粒转化E.coliBL21菌株,挑选单个菌落进行扩大培养。在菌液OD600达到0.6左右时,加入适量诱导剂IPTG,37 ℃继续振荡4 h,每小时取1次菌液(0.5 mL),离心收集菌体,使用超声仪进行超声破碎,离心后分别取上清和沉淀制样并通过SDS-PAGE凝胶电泳鉴定表达结果。为了进一步证实该蛋白属于centrin蛋白,对上述诱导重组蛋白样品进行Western blot实验验证。一抗采用的是人源centrin蛋白的鼠抗,稀释倍数是1∶1000;二抗选择的是辣根过氧化物酶标记的羊抗鼠IgG,稀释倍数是1∶2500。最后,按辣根过氧化物DAB显色试剂盒说明书进行显色及终止反应。
1.5CtCEN基因的生物信息学分析
对测序获得的CtCEN基因所编码的氨基酸序列同GenBank中已知的centrin氨基酸序列进行相似性比对。利用Clustal X和MEGA 5.0软件构建NJ系统树。
2结果与分析
2.1CtCEN基因的克隆与序列分析
根据苹Mv-centrin基因保守区设计引物扩增获得的水蕨CtCEN基因保守区序列,经克隆测序获得长度为342 bp的序列。利用RACE技术分别对CtCEN基因5′末端和3′末端进行扩增,经克隆测序去除引物接头后分别获得5′末端504 bp、3′末端734 bp的序列。对获得的序列进行拼接,设计全长引物获得CtCEN基因的全长cDNA。由图1可知,扩增序列长度大约1 000 bp,与目的基因的序列长度相似。
将目的基因片段切胶回收后连接至克隆载体,转化挑选阳性菌落测序,测序结果比对后发现其与其他物种的centrin基因同源,序列全长为1 077 bp(图2)。通过在NCBI中进行Blastn分析,结果表明CtCEN序列与苹、小立碗藓、衣藻、江南卷柏具有较高相似性,均在80%左右。该基因包含一个510 bp开放阅读框,编码具有170个氨基酸残基的蛋白质,使用蛋白质功能结构域分析软件SMART对氨基酸序列进行分析,结果显示CtCEN具有4个钙结合位点(EF-hand),这4个EF-hand分别位于第30~58、66~94、103~131和139~167氨基酸,由此可以推断CtCEN基因属于EF-hand超家族。
2.2CtCEN系统树构建
GenBank已公布centrin基因序列的物种主要包括蕨类植物苹(M.vestita)和江南卷柏(Selaginellamoellendorffii);藻类植物衣藻(Chlamydomonasreinhardtii)和团藻(Volvoxcarterif.nagariensis);高等植物拟南芥(A.thaliana)、烟草(N.tabacum)和可可(Theobromacacao);人(Homosapiens);鼠(Musmusculus)等。从构建的系统关系(图3)可知,这10个物种的centrin基因分成两大支,第一大支包括藻类植物的团藻和衣藻,蕨类植物苹、卷柏和水蕨,哺乳动物人和鼠,其中水蕨、苹和卷柏聚在一起,其自展支持率达到96%,体现了它们之间较近的亲缘关系。这几种蕨类又与2种藻类聚在一起,它们都属于鞭毛类植物;这些鞭毛类植物的centrin基因又与哺乳动物人和鼠的聚为一支,且自展支持率达到100%,从产生的精子特征上来看,该支物种的共同特征是都能够产生具鞭毛的游动精子,因此,centrin的功能可能与鞭毛发生有关。第二大支包括拟南芥、烟草和可可,这些物种属于被子植物,在整个生活史过程中都不产生游动细胞,因此,被子植物中centrin的功能可能发生了改变。

1.DL2000;2.阴性对照(无模板);3.CtCEN基因全长cDNA

粗体加下划线ATG表示起始密码子,粗体加下划线

图中分支点的数字表示基于1 000次重复该节点的自展支持率;标尺代表遗传距离
2.3CtCEN基因原核表达载体的鉴定
利用引入酶切位点BamHⅠ和XhoⅠ的引物将CtCEN连入pET-32a表达载体,重组质粒经BamHⅠ和XhoⅠ酶切后获得大小约6 kb的载体片段和500 bp左右的插入片段(图4),对阳性克隆进行测序。测序结果表明获得克隆片段长度为510 bp,与CtCEN基因序列完全一致,即已成功克隆了CtCEN基因并构建了表达载体。
2.4目的蛋白的原核表达与纯化
将pET32a-CtCEN重组质粒转入BL21空菌中,用1 mmol/L IPTG诱导表达后进行SDS-PAGE鉴定,得到有明显诱导趋势的条带(图5,A),大小在38 kD左右,在线软件ProtParam(http://web.expasy.org/protparam/)预测的目的蛋白CtCEN大小约为19 kD,此结果与预测的结果相符。
2.5蛋白质印迹实验鉴定
经IPTG诱导表达的重组蛋白按常规方法纯化后经SDS-PAGE分析,用半干法移至PVDF膜上,用5%脱脂奶粉封闭后,依次加入稀释的人源centrin蛋白的鼠抗和羊抗鼠IgG二抗进行孵育,最后使用显色试剂盒显色。结果如图5,B所示,表明克隆并表达的CtCEN蛋白能够与人源centrin蛋白抗体杂交,克隆出来基因是水蕨的centrin基因。
3讨论
Centrin蛋白是中心体中的钙调蛋白,在动物、植物、微生物中均有广泛的分布。我们从水蕨配子体中克隆到centrin 的cDNA片段,其大小占完整编码框的50%,编码的氨基酸序列基本覆盖了4个钙离子结合结构域。Western blot分析显示该Ct-CEN蛋白可与人源centrin蛋白的抗体结合,表明克隆到的基因确为centrin基因。同源性分析表明CtCEN基因与其他物种的centrin基因同源性较高,相对较为保守。从系统演化关系来看,CtCEN基因与苹和卷柏聚在一起,其自展支持率达到96%,体现了它们之间较近的亲缘关系,这几种蕨类又与2种藻类聚为一支,它们都属于鞭毛类植物,然而这些鞭毛类植物的centrin基因又与人和鼠的centrin-1,centrin-2聚为一支,而人和鼠都能产生具鞭毛的游动精子,表明centrin在生物精细胞发生上具有重要的作用,特别是在细胞运动细胞器和运动器官的发生上具有重要作用。

M1.DL2000;M2.λHind Ⅲ;1.CtCEN基因PCR产物;
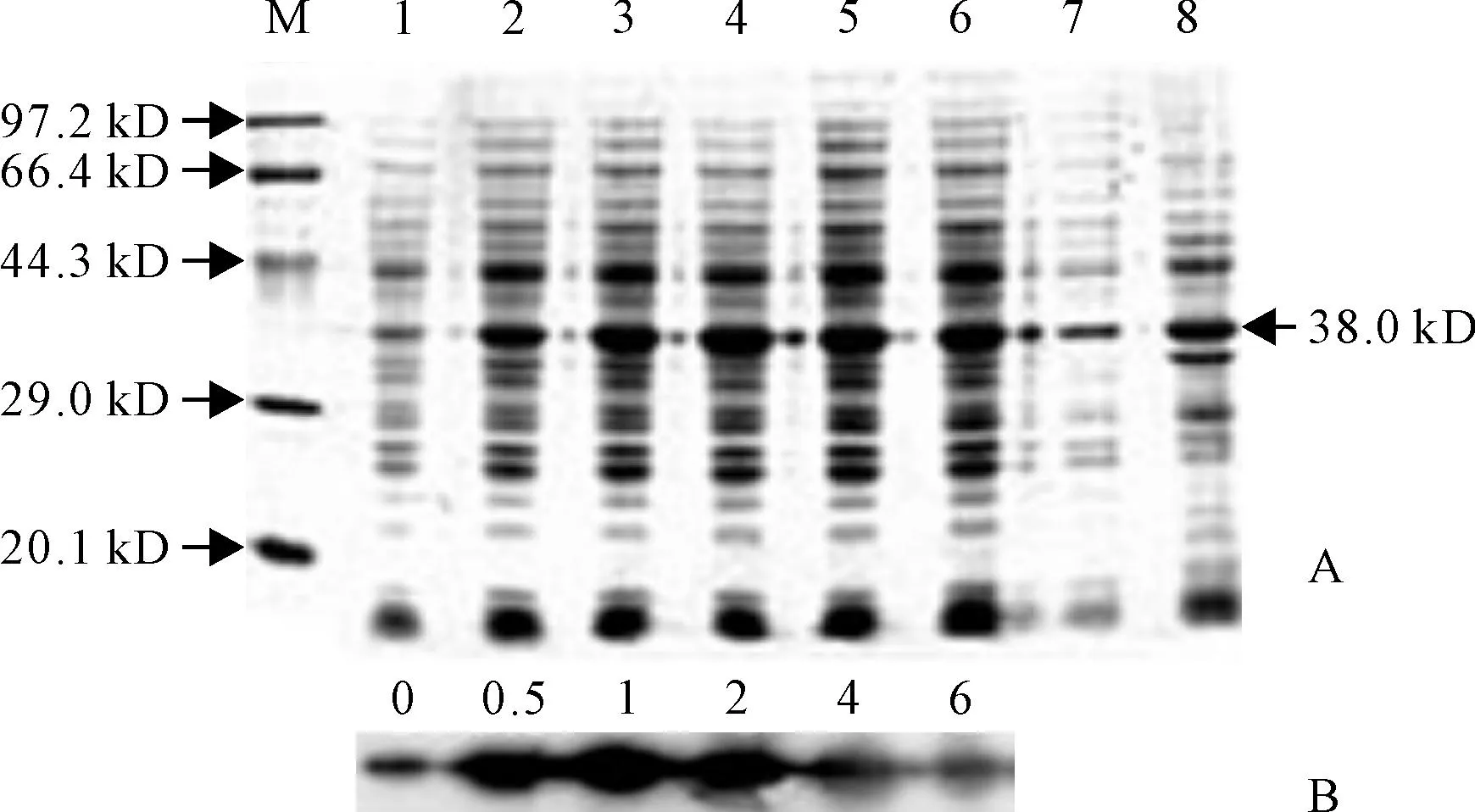
A.重组质粒pET32a-CtCEN的诱导表达分析:M.蛋白marker
本课题组在水蕨蛋白组学研究中发现centrin在水蕨雄配子体精子器发生阶段特异表达,是雄配子体内新产生的一种蛋白[13],由此可推断centrin蛋白参与了精子的发生过程,其功能与水蕨精细胞运动细胞器的发生有关。尽管高等被子植物如拟南芥、烟草和可可也具有centrin基因,但系统分析表明被子植物的centrin基因聚为单独一支,与鞭毛类生物centrin基因关系较远,可能表明被子植物centrin基因在演化过程中发生了功能的改变,不再参与精细胞的发生,因为被子植物在整个生活史过程中都不产生游动细胞,centrin基因在进化过程中的分化及功能的改变也值得深入研究。
参考文献:
[1]SALISBURY J L,BARON A,SUREK B,etal.Striated flagellar roots:isolation and partial characterization of a calcium-modulated contractile organelle[J].JournalofCellBiology,1984,99(3):962-970.
[2]HU H,SHEE HAN J H,CHAZIN W J.The mode of action of centrin:binding of Ca2+and a piptide fragment of Kar1p to the C-terminal domain[J].JournalofBiochemistry,2004,279(49):50 895-50 903.
[3]SALISBURY J L,SANDERS M A,HARPST L.Flagellar root contraction and nuclear movement during flagellar regeneration inChlamydomonasreinhardtii[J].JournalofCellBiology,1987,105(4):1 799-1 805.
[4]HAYASHI M,YAGI T,YOSHIMURA K,etal.Real-time observation of Ca2+-induced basal body reorientation inChlamydomonas[J].CellMotilityandtheCytoskeleton,1998,41(1):49-56.
[5]FISCHER T,RODRIGUEZ-NAVARRO S,PEREIRA G,etal.Yeast centrin Cdc31 is linked to the nuclear mRNA export machinery[J].NatureCellBiology,2004,6(9):840-848.
[6]LEE V,HUANG B.Molecular cloning and centrosomal localization of human caltractin[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1993,90(23):11 039-11 043.
[7]MIDDENDORP S,PAOLETTI A,SCHIEBEL E,etal.Identification of a new mammalian centrin gene,more closely related toSaccharomycescerevisiaeCDC31 gene[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1997,94(17):9 141-9 146.
[8]WIECH H,GEIER B M,PASCHKE T,etal.Characterization of green alga,yeast,and human centrins[J].JournalofBiologicalChemistry,1996,271(37):22 453-22 461.
[9]CORDEIRO M C,PIQUERAS R,OLIVEIRA D E D,etal.Characterization of early induced genes inArabidopsisthalianaresponding to bacterial inoculation:identification of centrin and of a novel protein with two regions related to kinase domains[J].FebsLetters,1998,434(3):387-393.
[10]STOPPIN-MELLET V,AM C J L.Characterization of microsome-associated tobacco BY-2 centrins[J].EuropeanJournalofCellBiology,1999,78(11):842-848.
[11]HART P E,WOLNIAK S M.Molecular cloning of a centrin homolog fromMarsileavestitaand evidence for its translational control during spermiogenesis[J].BiochemistryandCellBiology,1999,77(2):101-108.
[12]KLINK V P,WOLNIAK S M.Centrin is necessary for the formation of the motile apparatus in spermatids ofMarsilea[J].MolecularBiologyoftheCell,2001,12(3):761-776.
[13]黄武杰.水蕨雌、雄配子体差异表达蛋白质组学的分析[D].上海:上海师范大学,2011.
(编辑:宋亚珍)
Clone and Prokaryotic Expression of Centrin Gene from the FernCeratopteristhalictroides
CHEN Xufei1,WANG Yao1,QIN Zhaoyuan1,WANG Quanxi1,2,CAO Jianguo1*
(1 College of Life and Environment Sciences,Shanghai Normal University,Shanghai 200234,China;2 Shanghai Key Laboratory of Plant Functional Genomics and Resource,Shanghai Chenshan Botanical Garden,Shanghai 201602,China)
Abstract:In ferns,the spermatogenesis is a process of de novo formation of the motile apparatuses and the molecular mechanisms of the spermatogenesis were unclear.Centrin,a highly conservative calcium binding protein usually locating in the centrosome,was considered to be the protein that participates the formation of motile apparatuses.Cloning of the centrin gene has some significance for elucidating the molecular mechanism of spermatogenesis of ferns.The present investigation cloned the centrin gene (CtCEN) from the fern model plant,Ceratopteris thalictroides.The full length the cDNA sequence of the CtCEN gene is 1 077 bp,and the structural analysis showed that the gene belongs to be centrin gene of EF-hand protein superfamily.Phylogenetic analysis indicated that the CtCEN of the algae,ferns,animal and human,all of which produce sperms with flagella,is clustered in one branch.The CtCEN of angiosperm is clustered in another branch.It is suggested that the centrin may participate the genesis of flagellum.The prokaryotic expression and Western blot analysis showed that the expressed protein of CtCEN can hybridize with the centrin protein antibody of Human,which indicated that the CtCEN belongs to the centrin family.The present studies lay a foundation for the molecular mechanism of the centrin participating formation of motile apparatuses in fern spermatogenesis.
Key words:centrin;cloning;prokaryotic expression
中图分类号:Q785;Q786
文献标志码:A
作者简介:陈雪菲(1986-),女,在读博士研究生,主要从事蕨类植物生物学研究。E-mail:cxf_227@163.com*通信作者:曹建国,教授,主要从事蕨类植物生殖发育和蕨类植物资源开发与利用的研究。E-mail:cao101@shnu.edu.cn
基金项目:上海市自然科学基金(13ZR1429700);上海市科学技术委员会课题(14DZ2260400)
收稿日期:2015-12-18;修改稿收到日期:2016-01-29
文章编号:1000-4025(2016)03-0444-05
doi:10.7606/j.issn.1000-4025.2016.03.0444

