国槐槐角种胚细胞悬浮培养的动力学研究
陈红贤,于笑笑,王晨阳,张 敏,刘忠华(北京林业大学生物科学与技术学院,北京100083)
国槐槐角种胚细胞悬浮培养的动力学研究
陈红贤,于笑笑,王晨阳,张敏,刘忠华
(北京林业大学生物科学与技术学院,北京100083)
摘要:对国槐Sophora japonica槐角种胚细胞悬浮培养的动力学进行研究,在优化细胞接种量的基础上,分析测定培养周期内不同培养阶段的槐角细胞生长和培养基中碳源、氮源、磷源的消耗,以及细胞的鲜质量、干质量和黄酮产量的变化,从而了解细胞生长、营养消耗与次生代谢产物积累的基本规律,为建立结构化动力学模型奠定基础。结果表明:①初始接种量为40.000 g·L(-1)时,最利于细胞的培养;②细胞的培养周期约为27 d,经过27 d的培养,生物量和黄酮的产量达到最高,分别为9.733 g·L(-1)和53.566 mg·L(-1),对细胞比生长速率和黄酮比合成速率进行分析,得出黄酮的积累和细胞的生长为部分生长偶联型,在6~12 d呈负相关,12~33 d呈正相关;③基质中的碳源、氮源、磷源都是在0~6 d被迅速消耗,到12 d时消耗量达到总量的80.00%以上。在氮源的吸收上,铵态氮(NH4+)先于硝态氮(NO3-)的吸收。碳源、氮源、磷源的消耗与细胞生长和产物的积累密切相关。图10参25
关键词:植物学;国槐槐角种胚;悬浮细胞;黄酮;动力学;基质营养物质
国槐Sophora japonica属于豆科Leguminosae槐属Sophora植物,主要分布在中国北部。其果实即槐角,槐角中含有大量黄酮类物质,黄酮类化合物是一类在自然界广泛分布的多酚类物质,又称为黄酮体、黄碱素和类黄酮[1]。研究表明[2-3],黄酮类化合物具有清除自由基、抗氧化、抗突变、抗癌抗肿瘤、抗衰老、抗疲劳、抗菌抑菌和调节免疫、防治血管硬化、降血糖降血脂血清胆固醇等功能。另外,随着食品工业的发展与消费观念的改变,天然活性成分的保健食品成为现代人追逐的目标,其中黄酮类化合物以纯天然、高活性、见效快、作用广泛等特点日益受到人们的关注[4]。目前,关于大豆异黄酮的研究报道较多,其相关食品和保健品也逐步投入市场,但其提取受大豆油脂和蛋白质的影响,工艺复杂,成本偏高;另一方面,槐角中富含黄酮类化合物,其质量分数大于200 g·kg-1[5],远远高于大豆中黄酮化合物的质量分数(约为525~986 mg·kg-1[6]),因此,用槐角代替大豆来生产黄酮化合物更有价值。槐角黄酮类化合物主要包括槐角苷、染料木素、染料木苷、槐属双苷等[7-8],而槐角苷是槐角黄酮的主要成分,占总提取物的27.9%和总生药的2.2%[9]。目前,获取这些具有极高药用价值的黄酮产物,通常是从槐角中直接提取,而槐角资源的缺乏限制了黄酮作为新型药剂的推广。植物细胞悬浮培养技术因为能在人工条件下合成这些天然产物,解决了资源缺乏这一难题,对大规模商业化生产黄酮化合物具有重大的现实意义。利用该技术从国槐中获得黄酮化合物的研究国内外文献报道较少,因此,笔者对国槐的细胞培养技术进行了研究。经过前期的研究,本课题组已经成功诱导出槐角种胚愈伤组织,筛选出最佳固体和液体培养基,获得了稳定的悬浮细胞系,并检测出黄酮类化合物可以在愈伤组织中积累[10]。愈伤组织中黄酮的积累与初始接种量、细胞生长、基质中营养物质的含量等因素存在密切关系,解析此关系将为细胞由摇瓶培养放大到生物反应器培养提供重要的技术参数和理论依据。生物反应器培养技术是细胞培养生产次级代谢产物,实现大规模工业化生产的关键技术之一[11],因此,本研究在槐角种胚细胞悬浮培养过程中研究了细胞的生长、黄酮的合成以及主要营养物质的消耗,以便了解细胞在悬浮培养过程中的生长规律及动态变化,为提高黄酮的产量及细胞大规模培养提供理论依据。
1 材料与方法
1.1材料
国槐槐角愈伤组织来自国槐种胚的诱导[12],筛选生长快、分散性好的槐角愈伤组织,将其在B5固体培养基上继代5次以上,获得稳定的愈伤组织后将其转接到B5液体培养基中,在液体培养基中进行悬浮培养。通过不断选择获得分散性较好的细胞悬浮物,继代6次后转接到新的培养基中,建立稳定的悬浮细胞系。
1.2培养条件
固体培养基为:B5 + 1.00 mg·L-12,4-D + 0.20 mg·L-16-BA,蔗糖质量分数为30%,琼脂质量分数为6%,灭菌前pH 6.60;液体培养基为B5 + 2.00 mg·L-12,4-D + 0.50 mg·L-16-BA + 0.05 mg·L-1萘乙酸(NAA),蔗糖质量分数为30%,灭菌前pH 6.17[12-13]。培养基均以121℃高压灭菌30 min。该悬浮体系在温度为25℃,转速为110 r·min-1的摇床上全程暗培养,25 d继代1次。
1.3不同接种量对悬浮细胞的处理
将获得的分散性好且同步生长的细胞以20.00,30.00,40.00,50.00,60.00 g·L-1作为初始接种量,接种到装液量为50.0 mL B5液体培养基的100.0 mL三角瓶中培养,26 d后收获,以收获时细胞的鲜质量,干质量和黄酮含量为依据,选择最佳接种量。
1.4分析测定方法
1.4.1细胞生物量和生长曲线的测定以最佳接种量接种悬浮细胞到含50.0 mL B5液体培养基的100.0 mL三角瓶中,自接种之日起隔3 d测定1次细胞的生物量:取出摇瓶,用纱布过滤2次后收集细胞,滤液保存到干净的无菌瓶中备用。细胞用去离子水冲洗3次后用滤纸吸干至接种时的状态,测其鲜质量(g),然后将材料放入烘箱中70℃恒温烘干10 h至恒量,测其干质量(g),重复3次·测定-1,绘制细胞的生长曲线。
1.4.2黄酮质量分数的测定①标准品的处理。黄酮类化合物质量分数的测定采用紫外分光光度法[12],槐角苷为标准品,261.5 nm处测定吸光度D(λ),以吸光度为横坐标,槐角苷浓度为纵坐标绘制标准曲线,标准曲线方程为:y = 8.090 5x + 0.090 5(R2=0.998 9)。②样品吸光度的测定。将烘干后的愈伤组织研磨,过80目筛,备用。称取0.10 g粉末,加4.0 mL体积分数为70%乙醇,室温下超声提取40 min。提取后离心,取上清液稀释30倍后测定其在261.5 nm处的吸光度,重复3次·测定-1。总黄酮的质量分数mg·g-1(x)以槐角苷计,计算公式如下:x = 30cv/1 000w。黄酮的产量(mg·L-1)= 20x×干质量。其中:c为稀释后的提取液中槐角苷的质量浓度(mg·L-1),v为所提取槐角苷溶液的体积(mL),w为精确称取的供试材料的质量(g),x为计算出的黄酮的质量分数(mg·g-1)。
1.4.3生长速率和比生长速率的计算生长速率是用来确定培养物或生物生长速度的量度。细胞培养过程中大多数细胞都有指数生长期,在连续培养过程中指数生长期可能变成很长的时期。对于此类细胞培养,可以用生长速率γx=dX/dt≈ΔX/Δt表示单位时间细胞数量的增加;用比生长速率μx=1/X·dX/dt≈1/X·ΔX/Δt表示单位质量的细胞在单位时间内所增加的细胞质量,其中X是细胞量,t是时间。细胞的生长速率可看做是绝对生长速度,比生长速率可看成是相对生长速度。同理,黄酮的合成速率为γp=dp/dt≈Δp/Δt和比合成速率为μp=1/X·dp/dt≈1/X·Δp/Δt,其中X是细胞量,p是黄酮产量,t是时间。细胞悬浮培养过程中产物积累和细胞生长之间的关系可表述为产物比合成速率和细胞比生长速率之间的关系:μp=αμx+β,α为与生长相关的产物生成系数,β为与生长非相关的产物生成系数。
1.4.4基质中营养物质的测定收集摇瓶中的培养液,碳源含量的测定采用蒽酮试剂法测定[14];硝酸盐采用水杨酸比色法测定[15];铵根离子采用水杨酸-次氯酸盐光度法测定;磷酸根采用钼蓝比色法测定[16]。
2 结果与分析
2.1接种量对槐角细胞培养的影响
2.1.1接种量对细胞生长鲜质量的影响由图1可知:在一定范围内,随着细胞接种量的增加,收获时细胞的鲜质量逐渐增加,在接种量为40.00,50.00,60.00 g·L-1时,收获时细胞鲜质量较大,50.00 g·L-1时最大为4.68 g,接种量为60.00 g·L-1时,鲜质量开始下降。对其进行显著性分析发现接种量为40.00,50.00,60.00 g·L-1时细胞鲜质量显著大于接种量为20.00,30.00 g·L-1,而40.00,50.00,60.00 g·L-1之间差异并不显著。但是,细胞鲜质量的增长倍数并没有随着接种量的增大而增加,当接种量为40.00 g·L-1时,细胞鲜质量增长倍数达到最大的2.13倍,接种量为50.00 g·L-1时,细胞鲜质量增长倍数也达到1.87倍。而当接种量为60.00 g·L-1时,细胞鲜质量增长倍数反而下降,为1.49倍。为了以较小的接种量获得较大的生物量,使接种细胞达到最大的利用率,40.00,50.00 g·L-1的接种量为最佳接种量。
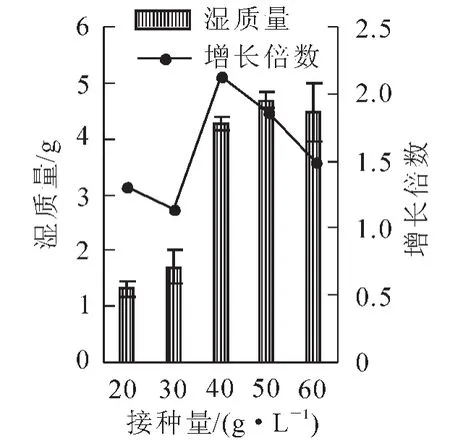
图1 不同接种量对细胞鲜质量的影响Figure 1 Effect of different inoculum size on cell wet weight
2.1.2接种量对细胞生长干质量的影响分析图2可知:在一定范围内,随着细胞接种量的增加,收获时细胞的干质量逐渐增加,在接种量为60.00 g·L-1时,收获时细胞干质量达到最大值,为0.28 g。然后,对其干质量进行显著性分析,发现当接种量为50.00,60.00 g·L-1时,其干质量显著高于接种量为20.00,30.00 g·L-1;接种量为40.00 g·L-1时,干质量显著高于接种量为20.00 g·L-1;但是接种量为40.00,50.00,60.00 g·L-1时,其干质量无显著性差异。综合考虑,为了使接种细胞达到最大的利用率,40.00,50.00 g·L-1的接种量较好。
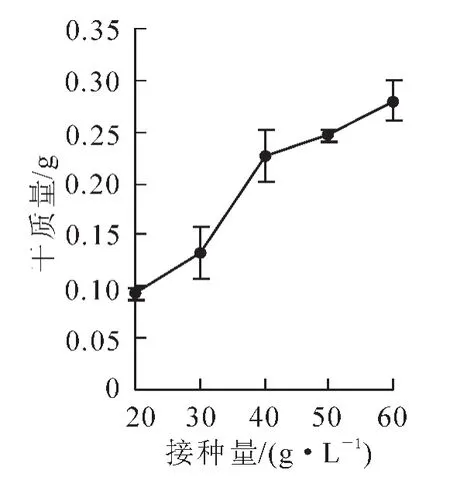
图2 不同接种量对细胞干质量的影响Figure 2 Effect of different inoculum size on cell dry weight
2.1.3接种量对细胞黄酮质量分数的影响由图3可以知道:接种量不同,最后的黄酮化合物质量分数不同,接种量为30.00 g·L-1时,黄酮化合物质量分数最高,为9.35 mg·g-1。对它进行方差分析得出,接种量为20.00,30.00,40.00 g·L-1时,黄酮化合物质量分数较高,无显著性差异;而接种量为50.00,60.00 g·L-1时,黄酮质量分数降低,且显著低于接种量为20.00,30.00,40.00 g·L-1。所以,从黄酮质量分数来说,接种量为20.00,30.00,40.00 g·L-1较好。综合以上3个方面,选择接种量为40.00 g·L-1,收获生物量和黄酮化合物质量分数都较高。
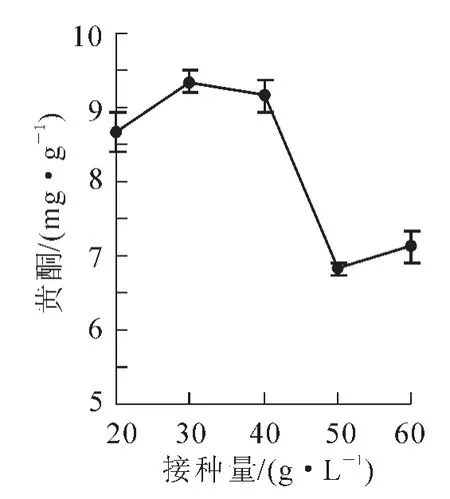
图3 不同接种量对黄酮质量分数的影响Figure 3 Effect of different inoculum size on flavonoids content
2.2槐角细胞悬浮培养过程中细胞生长和黄酮积累的动力学分析
2.2.1细胞生长曲线和黄酮化合物合成曲线测定细胞的干质量和黄酮的产量,绘制生长和合成曲线,如图4。槐角细胞悬浮培养的周期约为27 d,在1个培养周期内细胞分为延滞期、对数生长期、稳定期和衰亡期。0~6 d这一阶段,细胞处于延滞期,生长缓慢,原因可能是细胞在继代过程中转入新的培养液中时,新培养基中的渗透压较高,盐浓度也较高,而悬浮细胞不能迅速适应,所以此时次生代谢产物含量会比较高;6~27 d为细胞快速生长期,细胞生长迅速,27 d细胞干质量达到最大9.733 g·L-1;27 d以后,细胞进入稳定期。稳定期较短,很快进入衰亡期,生物量逐渐下降,细胞开始死亡。在6~27 d这个时期黄酮化合物的产量随着细胞干质量的增加也不断升高,27 d达到最大53.566 mg·L-1。
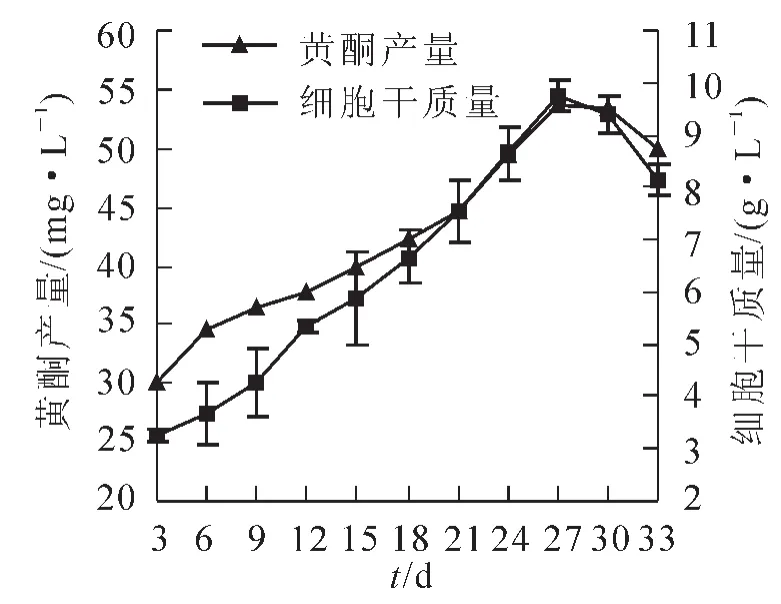
图4 细胞生长和黄酮化合物合成曲线Figure 4 Growth curves of Sophora japonica embryo callus and flavonoids production
2.2.2细胞比生长速率和黄酮比合成速率国槐槐角细胞悬浮培养过程中生长速率和比生长速率如图5所示。由图5可知:在1个培养周期内国槐槐角细胞的生长速率和比生长速率变化趋势相同,0~6 d细胞的生长速率和比生长速率较低;到对数生长期,生长速率和比生长速率有2个峰值,从第6天开始,生长速率和比生长速率迅速增加,12 d时达到第1个峰值,生长速率和比生长速率分别为0.356 g·L-1· d-1和0.067 d-1,然后在15 d生长速率和比生长速率有所下降,之后又开始逐渐上升,在24 d时上升到第2个高峰,生长速率和比生长速率分别为0.378 g·L-1·d-1和0.044 d-1,之后生长速率和比生长速率则迅速下降。
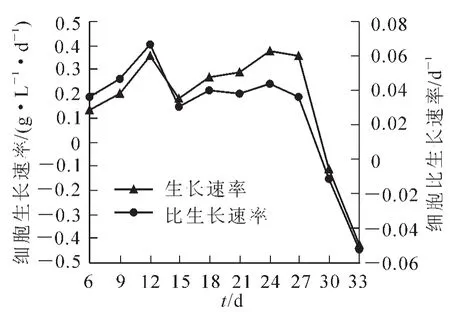
图5 细胞生长速率和比生长速率Figure 5 Dynamic changes of cell growth rate and specific growth rate
国槐槐角细胞悬浮培养过程中黄酮的合成速率和比合成速率如图6所示。分析图6可知:黄酮化合物的合成速率与比合成速率的变化趋势与细胞生长规律不完全一致。在细胞生长较快的第6~12天,黄酮合成速率和比合成速率反而呈下降趋势,可能是因为细胞经过延缓期适应了培养基的环境,次生代谢产物生成减少甚至不合成。在细胞生长最快的第12天黄酮合成速率和比合成速率达到最低点,合成速率和比合成速率为0.358 mg·L-1·d-1和0.067×10-3d-1。而在15 d之后黄酮合成速率和比合成速率和细胞生长规律比较相似,逐渐上升,可能是因为细胞迅速生长,基数增大,次生代谢产物合成逐渐增加,黄酮合成速率和比合成速率也逐渐增大,在24 d达到最高值,分别为1.662 mg·L-1·d-1和0.192×10-3d-1,之后迅速下降。

图6 黄酮合成速率和比合成速率Figure 6 Dynamic changes of flavonoids synthesis rate and specific synthesis rate
2.2.3细胞生长和黄酮化合物积累的关系由图5和图6可知:细胞的比生长速率和黄酮化合物的比合成速率变化规律不完全相同,可以分为2个时期:第1个时期为6~12 d(图7a),第2个时期为12~33 d
(图7b)。图7a表明:在6~12 d黄酮的比合成速率(μp)随着槐角细胞比生长速率(μx)的增加而减少,在此期间它们之间关系可以用以下公式表示:μp=-10.633 0μx+0.743 5(R2=0.796 9)。从式可知:黄酮的积累和槐角细胞的生长呈负相关。图7b表明:在12~33 d黄酮的比合成速率(μp)随着槐角细胞比生长速率(μx)的增加而增加,在此期间它们之间关系可以用以下公式表示:μp=3.032 3μx+0.022 1(R2=0.950 8)。从式可知:黄酮的积累和槐角细胞的生长呈正相关。

图7 产物比合成速率和细胞比生长速率的关系Figure 7 Relationship between flavonoids specific synthesis rate and cell specific growth rate of Sophora japonica embryo in suspension culture
2.3槐角细胞悬浮培养过程中对营养物质消耗的动态变化
2.3.1碳源的消耗碳源在国槐槐角细胞悬浮培养过程中的动态变化如图8所示。在0~6 d消耗迅速,6 d时已经消耗了总糖的68.38%,为细胞快速增长做好了准备,12 d时消耗达80.00%,12 d以后糖的消耗量减少,但质量浓度继续下降,细胞迅速生长。33 d糖的质量浓度为1.803 g·L-1,整个过程共消耗了总糖的93.00%。
2.3.2氮源的消耗槐角细胞悬浮培养液中的硝态氮和铵态氮质量浓度的动态变化如图9所示。铵态氮和硝态氮的消耗并不同步,在0~6 d铵态氮被迅速利用,6 d已消耗82.37%,而硝态氮消耗量较低,为11.58%。6 d之后铵态氮质量浓度较低时,硝态氮质量浓度迅速下降,12 d时消耗达95.77%,基质中的大部分氮源被消耗,而此时细胞生长速率达到第1个高峰,与氮源的消耗相符合,但是铵态氮的吸收先于硝态氮。12 d之后铵态氮和硝态氮继续小幅下降,细胞不断生长。基质中硝态氮和铵态氮分别在18 d和27 d基本消耗殆尽,细胞生长达到最大值。因此,可以推断,氮素是影响国槐种胚细胞增殖的一个重要原因。
2.3.3磷源的消耗当把细胞接种到新的培养基后(图10),细胞开始大量吸收磷酸根离子。在迟滞期0~6 d内消耗了80.78%的磷,进入快速生长期以后,6~12 d磷的消耗量还是较大,第12 d磷的消耗量达92.96%,细胞生长速率也达到最大。之后磷消耗量逐渐减少,到24 d时磷已经被消耗殆尽,细胞生长速率开始下降,可见磷源的含量与细胞悬浮培养密切相关。
2.3.4基质中营养物质的消耗与细胞生长、黄酮积累的关系由图8~10可知:细胞对基质中的碳源、氮源、磷源的消耗过程大体相似。分析细胞培养过程中营养物质的动态变化与细胞生长和黄酮积累的关系发现:0~6 d,细胞迅速吸收营养物质,营养物质消耗量最大,质量浓度迅速下降,但是吸收的营养物质储存在细胞中为细胞快速生长做准备,所以细胞生长缓慢,同时处于此时期的细胞产生次生代谢产物,所以细胞的比生长速率较低而黄酮的比合成速率较高;6~12 d这些营养物质浓度仍然下降较快,但幅度较前6 d小,到12 d基本消耗量都达到80.00%以上,延滞期营养物质的大量储存和细胞对基质中营养物质的继续吸收为细胞生长提供了充足的营养物质,所以6~12 d细胞迅速生长,比生长速率升高,在12 d达到一个高峰,同时由于营养物质充分,足够满足细胞快速生长,很少甚至不会产生次生代谢产物,所以6~12 d黄酮的比合成速率下降,在12 d时达到最低点;12~15 d营养物质基本被消耗掉80%,所以细胞对基质营养的吸收量迅速下降,这一变化可能会暂时破坏细胞生长的平衡,进而产生一些次生代谢产物,所以同12 d相比细胞比生长速率有所下降,黄酮比合成速率开始上升;15~24 d在基质营养物质质量浓度较低的情况下细胞主要依靠自身存储的营养物质来供细胞生长,且自身存储的物质可以满足细胞的生长进而逐渐恢复稳定,所以细胞的比生长速率又开始继续上升,细胞数量迅速增加,但是在满足细胞生长的基础上细胞开始对营养物质有所竞争,加上上一阶段次生代谢产物的产生会诱导更多的产物合成,所以黄酮的比合成速率也继续上升,24 d比生长速率和比合成速率同时达到最大,但是其细胞生长速率小于12 d的第1个高峰,可能是因为营养物质不如12 d充分;24 d之后,基质中的营养物质基本被耗尽,细胞中储存的也被消耗殆尽,营养物质的严重缺乏导致了细胞的比生长速率和黄酮的比合成速率迅速下降。
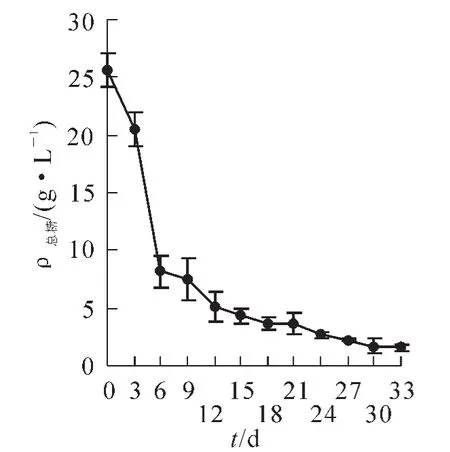
图8 培养过程中碳源的动态消耗变化Figure 8 Change of sugar contents in the medium during the cell suspension culture cycle
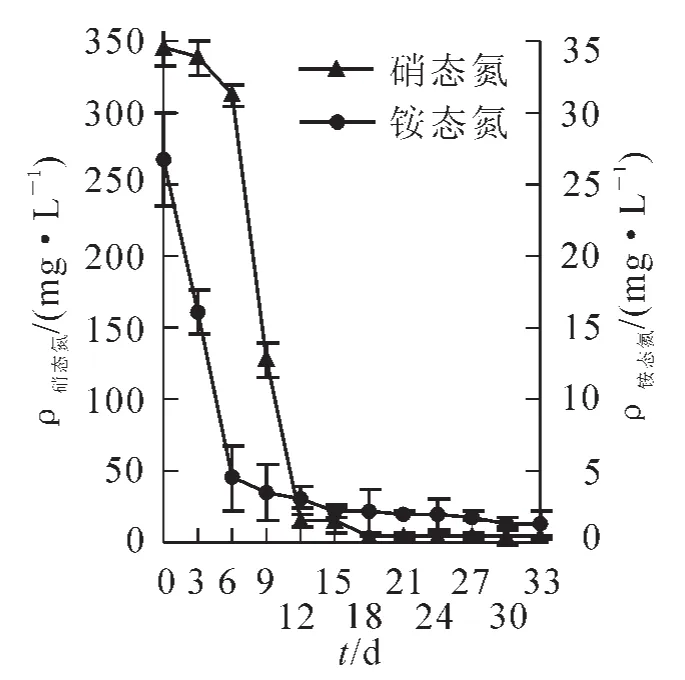
图9 培养过程中氮源的动态消耗变化Figure 9 Change of nitrogen contents in the medium during the cell suspension culture cycle
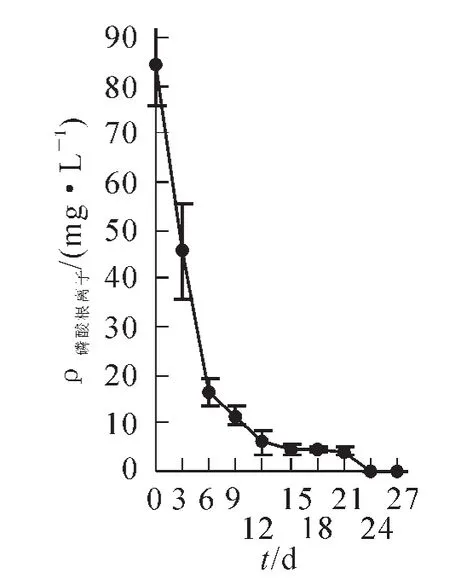
图10 培养过程中磷源的动态消耗变化Figure 10 Change of phosphate contents in the medium during the cell suspension culture cycle
3 结论与讨论
悬浮细胞分裂增殖前需要一个最低的临界密度,可能是因为:细胞分裂启动前,需要细胞内一种称为条件因子的物质达到一定的内源水平[17]。可通过添加条件培养基或者增加细胞接种量来达到这个内源水平。细胞要维持分裂和生长,其内源代谢物质必须达到一定的阀值,在高密度细胞群和培养基营养充足的情况下,易于达到这个阀值[18]。如果接种量太低,则细胞悬浮液质量浓度过低,使得细胞间的物质交换不充分,不利于细胞的生长;细胞悬浮液的质量浓度过高,使得细胞密度过高,单个细胞会因营养吸收不足而死亡,因此,对于细胞的悬浮培养,选择合适的接种量至关重要[19]。将继代培养后同步化生长的悬浮细胞以不同接种量接种于新鲜液体培养基中,测定细胞生长和黄酮合成的情况可为大规模细胞培养的研究奠定基础。本研究得出槐角种胚细胞悬浮培养的最佳接种量为40.00 g·L-1,过低或过高都不利于细胞的生长和次生代谢产物的积累。Sakano[20]等曾报道过低接种量会严重抑制细胞的增殖,与本研究结果一致。
槐角细胞悬浮培养的周期约为27 d,在一个培养周期内细胞分为延滞期、快速生长期、稳定期和衰亡期。0~6 d为延滞期,6~27 d为快速生长期,27 d以后,细胞进入稳定期,稳定期较短,此后很快进入衰亡期。经过27 d的培养,生物量和黄酮的产量均达到最高。分析槐角细胞生长与黄酮积累的动力学关系,在6~12 d黄酮的比生成速率(μp)随着槐角细胞比生长速率(μx)的增加而减少,黄酮的积累和槐角细胞的生长呈负相关;而在12~33 d黄酮的比生成速率(μp)随着槐角细胞比生长速率(μx)的增加而增加,黄酮的积累和槐角细胞的生长呈正相关。因此,国槐槐角细胞生长和黄酮积累为部分生长偶联型。
悬浮培养过程中,细胞主要靠基质中的营养物质来满足自身的生长和产物的合成。其中碳源主要由蔗糖提供,在细胞培养中糖类具有重要作用,既为细胞生长提供能量,也为初级、次级代谢物合成提供碳支架,同时对渗透压的调节有重要作用[11];硝态氮和铵态氮是细胞生长代谢的主要氮来源,调节培养基中总氮浓度或改变铵态氮和硝态氮的比例都可显著影响细胞培养过程中细胞的生长和次生代谢物的合成[21-22];磷源是植物细胞内重要的营养成分之一,参与核苷酸、脱氧核糖核酸(DNA)、核糖核酸(RNA)和蛋白质等的形成,它的消耗量可以从一个侧面反映出细胞的生长情况。因此,研究这几种营养物质在培养过程中的动态消耗有重要意义。在一个培养周期内,分析槐角细胞和黄酮的比生长速率与基质中主要营养成分的变化,对槐角细胞悬浮培养的生长状况进行较为全面的分析,发现营养成分的消耗与细胞增殖和产物积累的各个阶段是吻合的:0~6 d,细胞处在接种初期,而接种的细胞处于继代培养后期,细胞因营养不足而处于一种“饥饿”状态,因此,当细胞转入新的培养基以后,必将通过主动吸收和扩散等途径快速吸收营养物质[23],所以这个时期,基质中的营养物质迅速下降;6~24 d,随着细胞的快速生长和黄酮的积累,基质中的营养物质基本被消耗;24 d之后,基质中营养物质不足,细胞的增殖和黄酮的合成速率也都开始下降。由此可以推断,培养液中营养成分的不足限制了细胞的细胞增长和产物积累,基质中碳源氮源磷源的含量与细胞增长和产物积累密切相关,而且铵态氮的吸收先于硝态氮。这与前人的研究[24-25]:在植物细胞生产次生代谢物的过程中,细胞对培养液营养成分的消耗动态直接影响细胞的生长和次生代谢物的合成相一致。该结果为进一步提高槐角细胞中黄酮的产量提供了营养成分依据:可以在国槐种胚细胞培养过程中采用分批添加营养成分的方法来提高黄酮的产量,如在细胞培养的12 d添加蔗糖、硝酸盐,6 d时添加铵盐和磷酸盐,以补充培养基中的营养成分,保持黄酮化合物以较高的速率积累。
本研究结果为提高槐角种胚悬浮细胞中黄酮的积累和后续建立结构化动力模型提供了理论依据,同时为细胞由摇瓶培养放大到生物反应器培养提供了技术参数。
4 参考文献
[1]PRATT D E, BIRAC P M.Source of antioxidant activity of soybeans and soy products[J].J Food Sci, 1979, 44(6): 1720 - 1722.
[2]唐浩国.黄酮类化合物研究[M].北京:科学出版社,2009:1 - 15.
[3]龙春,高志强,陈凤鸣,等.黄酮类化合物的结构-抗氧化活性关系研究进展[J].重庆文理学院学报:自然科学版,2006,5(2):13 - 17.LONG Chun, GAO Zhiqiang, CHEN Fengming, et al.Advance in studies of the relationships between structure and antioxidant activity of flavonoids compounds[J].J Chongqing Univ Arts Sci Nat Sci Ed, 2006, 5(2): 13 - 17.
[4]溥丽华,刘忠华,魏振园,等.国槐槐角细胞培养生产类黄酮的研究进展[J].广东农业科学,2012,39(2):101 - 103.PU Lihua, LIU Zhonghua, WEI Zhenyuan, et al.Research advances on production of flavonoids by fruits of Sophora japonica L.cell culture[J].Guangdong Agric Sci, 2012, 39(2): 101 - 103.
[5]丛艳波,张永忠,刘潇.亚临界水提取槐角中总异黄酮的研究[J].中草药,2010,41(5):717 - 720.CONG Yanbo, ZHANG Yongzhong, LIU Xiao.Study on total isoflavones from Fructus sophorae by subcritical water extraction[J].Chin Tradit Herb Drugs, 2010, 41(5): 717 - 720.
[6]DEVI M K A, GONDI M, SAKTHIVELU G, et al.Functional attributes of soybean seeds and products, with reference to isoflavone content and antioxidant activity[J].Food Chem, 2009, 114(3): 771 - 776.
[7]唐于平,楼凤昌,马雯,等.槐果皮中的异黄酮甙类成分[J].中国药科大学学报,2001,32(3):187 - 189.TANG Yuping, LOU Fengchang, MA Wen, et al.Isoflavonoid glycosides from the pericarps of Sophora japonica[J].J China Pharm Univ, 2001, 32(3): 187 - 189.
[8]RAO C V, WANG C X, SIMI B, et al.Enhancement of experimental colon cancer by genistein[J].Cancer Res, 1997, 57(17): 3717 - 3722.
[9]肖怀,陈泽乃,陆阳,等.HPLC测定槐角中槐苷含量[J].大理学院学报,2003,2(3):11 - 13.XIAO Huai, CHEN Zenai, LU Yang, et al.Determination of sophoricoside in Fructus sophorae by HPLC[J].J Dali Coll, 2003, 2(3): 11 - 13.
[10]溥丽华,刘忠华,魏振园,等.国槐种胚愈伤组织培养与异黄酮量的分析[J].中草药,2013,43(14):1984 - 1989.PU Lihua, LIU Zhonghua, WEI Zhenyuan, et al.Callus culture of embryos in Sophora japonica and analysis on isoflavones content[J].Chin Tradit Herb Drugs, 2013, 43(14): 1984 - 1989.
[11]范桂枝,翟俏丽,于海娣,等.白桦细胞悬浮培养产三萜及其营养成分消耗的动态[J].林业科学,2011,47(1):62 - 67.FAN Guizhi, ZHAI Qiaoli, YU Haidi, et al.Kinetics of triterpenoid production and nutrient consumption in birch (Betula platyphylla)suspension cell[J].Sci Silv Sin, 2011, 47(1): 62 - 67.
[12]溥丽华.国槐种胚细胞培养生产异黄酮物质研究[D].北京:北京林业大学,2012.PU Lihua.A Study on Production of Isoflavones by Embryos of Sophora japonica L.Cell[D].Beijing: Beijing Forestry University, 2012.
[13]魏振园,汤若风,王晋飞,等.pH对槐角愈伤组织黄酮类化合物产量的影响[J].广西植物,2013,33(2):203 - 207.WEI Zhenyuan, TANG Ruofeng, WANG Jinfei, et al.Effects of pH value on yield of flavonoids in callus tissues of Sophora japonica fruits[J].Guihaia, 2013, 33(2): 203 - 207.
[14]赵昶灵,李云,陈中坚,等.花色苷的酶降解[J].热带亚热带植物学报,2011,19(6):576 - 584.ZHAO Changling, LI Yun, CHEN Zhongjian, et al.The enzymatic degradation of anthocyanins[J].J Trop & Subtrop Bot, 2011, 19(6): 576 - 584.
[15]谢红伟.水杨酸比色法测定水中硝酸盐氮的含量[J].贵州农业科学,1999,27(3):40 - 41.XIE Hongwei.Determination of nitrogen content in nitrate by salicylic acid colorimetry in water[J].Guizhou Agric Sci, 1999, 27(3): 40 - 41.
[16]KOMES D, ULRICH D, GANIC K K, et al.Study of phenolic and volatile composition of white wine during fermentation and a short time of storage[J].VITIS J Grap Res, 2007, 46(2): 77 - 84.
[17]陈继光,上官新晨,尹忠平,等.青钱柳悬浮细胞的培养及其基质消耗的规律[J].现代食品科技,2014,30 (1):44 - 49.CHEN Jiguang, SHANGGUAN Xinchen, YIN Zhongping, et al.Establishment of the cell suspension culture system of Cyclocarya paliurus and matrix consumption laws[J].Mod Food Sci Technol, 2014, 30(1): 44 - 49.
[18]李勇,邢辉,张金芳,等.桑树悬浮细胞生长规律及其生理特性的研究[J].蚕业科学,2007,33(1):91 - 94.LI Yong, XING Hui, ZHANG Jinfang, et al.Research on the growth regularity and physiological characteristics of mulberry suspension cells[J].Acta Ser Sin, 2007, 33(1): 91 - 94.
[19]张珏,尹欢,阮利霞,等.高生物产量川芎细胞悬浮培养条件优化[J].成都大学学报:自然科学版,2014,33(1):10 - 13.ZHANG Jue, YIN Huan, RUAN Lixia, et al.Optimization of cell suspension culture conditions of lisgusticum Chuanxiong at high biomass yield[J].J Chengdu Univ Nat Sci Ed, 2014, 33(1): 10 - 13.
[20]SAKANO K, MATSUMOTO M, YAZAKI Y, et al.Inorganic phosphate as a negative conditioning factor in plant cell culture[J].Plant Sci, 1995, 107(1): 117 - 124.
[21]PANDA A K, MISHRA S, BISARIA V S.Alkaloid production by plant cell suspension cultures of Holarrhena antidysenterica: I.effect of major nutrients[J].Biotechnol Bioeng, 1992, 39(10): 1043 - 1051.
[22]MORENO P R H, van der HEIJDEN R, VERPOORTE R.Cell and tissue cultures of Catharanthus roseus: a literature survey[J].Plant Cell Tiss Org Cult, 1995, 42(1): 1 - 25.
[23]郭志刚,都军,刘瑞芝.紫杉细胞生长过程与营养物质消耗的动态研究[J].清华大学学报:自然科学版,2002,42(5):599 - 602.GUO Zhigang, DU Jun, LIU Ruizhi.Kinetic investigation of Taxus cell growth and nutrient consumption[J].J Tsinghua Univ Sci Technol, 2002, 42(5): 599 - 602.
[24]AZEVEDO H, DIAS A, TAVARES R M.Establishment and characterization of Pinus pinaster suspension cell cultures[J].Plant Cell Tiss Org Cult, 2008, 93(1): 115 - 121.
[25]董诚明,苏秀红,王伟丽.氮碳源对冬凌草再生植株生长及次生代谢产物的影响[J].西北植物学报,2009,29(3):494 - 498.DONG Chengming, SU Xiuhong, WANG Weili.Effects of sucrose concentration, nitrogen on the growth and main secondary metabolites accumulated of regeneration plant of Rabdosia rubescens(Hemsl.)Hara[J].Acta Bot Boreal-Occident Sin, 2009, 29(3): 494 - 498.
Kinetics of Sophora japonica embryo cells in a suspension culture system
CHEN Hongxian, YU Xiaoxiao, WANG Chenyang, ZHANG Min, LIU Zhonghua
(College of Biological Sciences and Technology, Beijing Forestry University, Beijing 100083, China)
Abstract:Based on the established cell suspension culture system of Sophora japonica embryos, its kinetics was investigated.The suspension cell system of S.japonica embryos influenced by inoculum size was studied with analysis during cell culture of kinetic parameters, such as cell growth; consumption of C, N, and P; as well as changes in cell fresh weight, dry weight, and flavonoid production at various stages in the culture procedure.Results revealed that.(1)the preferable inoculum size for suspension cell proliferation was 40.000 g·L(-1).(2)The cell suspension culture cycle lasted about 27 d with maximum biomass in dry weight reaching 9.733 g·L(-1)and flavonoid production attaining 53.566 mg·L(-1).Flavonoid production was semi-associated with cell growth of the S.japonica embryo being negatively related from 6-12 d and positively related from 12-33 d.(3)From 0-6 d sugar, N, and phosphate were absorbed quickly; after 12 d they were more than 80% absorbed.Also, NH4+was utilized faster than NO3-.Thus, proliferation and flavonoid production of S.japonica embryo cells was closely related to the consumption of sugar, N, and phosphate.This research could provide references for the scale-up culture of S.japonica embryos cell by bioreactor.[Ch, 10 fig.25 ref.]
Key words:botany; Sophora japonica embryo; suspension cell; flavonoids; kinetics; matrix nutrient
作者简介:陈红贤,从事药用植物及其次生代谢研究。E-mail: 965600690@qq.com。通信作者:刘忠华,副教授,博士,从事植物生长发育及系统进化研究。E-mail: liuzh6@bjfu.edu.cn
基金项目:国家自然科学基金资助项目(J1103516);北京林业大学理科生物学基地国家自然科学基金子项目(ZD008)
收稿日期:2015-05-11;修回日期:2015-06-15
doi:10.11833/j.issn.2095-0756.2016.02.012
中图分类号:S718.3;Q942
文献标志码:A
文章编号:2095-0756(2016)02-0272-08

