马尾松水通道蛋白PmPIP1基因克隆及在干旱胁迫下的表达分析
蔡 琼,丁贵杰,文晓鹏(1.贵州省森林资源与环境研究中心,贵州贵阳550025; 2.贵州大学林学院,贵州贵阳550025; .贵州大学贵州省农业生物工程重点实验室,贵州贵阳550025)
马尾松水通道蛋白PmPIP1基因克隆及在干旱胁迫下的表达分析
蔡琼1,2,丁贵杰1,2,文晓鹏3
(1.贵州省森林资源与环境研究中心,贵州贵阳550025; 2.贵州大学林学院,贵州贵阳550025; 3.贵州大学贵州省农业生物工程重点实验室,贵州贵阳550025)
摘要:克隆马尾松Pinus massoniana水通道蛋白(AQP),并对其生物信息学与干旱胁迫表达模式进行分析。采用逆转录聚合酶链式反应(RT-PCR)以及互补脱氧核糖核酸(cDNA)末端快速扩增(RACE)方法克隆马尾松水通道蛋白基因。采用实时荧光定量聚合酶链式反应(qRT-PCR)分析其在干旱胁迫下的响应模式。结果克隆到一个马尾松水通道蛋白基因,命名为PmPIP1(GenBank登录号为KF582038)。此基因cDNA全长序列为1 301 bp,包括867 bp的完整开放阅读框,99 bp的5′末端非翻译区和335 bp的3′末端非翻译区。编码288个氨基酸残基,分子量为30.86 kD,等电点(pI)8.48。PmPIP1与菠菜Spinacia oleracea(2b5fA)水通道蛋白结构相似。PmPIP1含有6个跨膜区,具有膜内在蛋白(MIP)家族信号序列、高等植物高度保守序列HINPAVTFG和2个天门冬酰胺-脯氨酸-丙氨酸(NPA)保守肽段。PmPIP1基因属质膜内在蛋白(PIPs)亚族,与挪威云杉Picea abies水通道蛋白基因亲缘关系最近,同源性达95%。qRT-PCR表明PmPIP1受干旱胁迫诱导表达。马尾松PmPIP1的克隆丰富了植物AQP基因的资料库,同时推测PmPIP1基因可能参与了马尾松干旱胁迫过程。图8表1参39
关键词:植物学;马尾松;水通道蛋白;克隆;表达
水通道蛋白(AQP)是指细胞膜上能选择性地高效转运水分子的膜转运蛋白[1]。自1993年Maurel等[2]从拟南芥Arabidopsis thaliana中分离到第1个植物水孔蛋白γ-TIP以来,已在细菌、古生菌、真菌、动物和植物等几乎所有生物中发现AQP[3-5]。在植物中,拟南芥[6]和水稻Oryza sativa[7-8]等AQP基因的研究较为清楚。根据水通道蛋白的亚细胞定位,结合序列同源性分为4种类型:质膜内在蛋白(PIP),液泡膜内在蛋白(TIP),类结瘤蛋白(NIP)及小碱性膜内蛋白(SIP)[9-10]。AQP属跨膜通道的膜内在蛋白(MIP)家族,具有转运水、甘油、小分子溶质的功能,在植物应对水分不足的响应机制中起着重要作用[11]。马尾松Pinus massoniana因适生能力强、速生、丰产、综合利用程度高等优良特性,成为中国南方最主要用材树种之一[12]。以往关于马尾松林的研究主要集中在林木栽培技术[13]、栽培机制[14-15]、连栽生态系统变化[16]、合理采伐年龄[17]、人工林生长规律[18]等方面,而对其分子生物学相关研究甚少[19]。干旱是影响林木正常生长发育的一个最重要的逆境因子。克隆马尾松抗旱相关基因以及研究其表达调控,对揭示马尾松抗旱分子机制具有十分重要的意义。其中,水通道蛋白PIPs亚型基因在植物干旱分子调控机制中是一个重要的调控基因,其不仅受胁迫表达变化,而且转运活性受磷酸化调控[20],参与非生物胁迫的响应。CUI等[21]发现过表达VfPIP1的拟南芥增强了植株的抗旱能力。ZHOU等[22]研究表明小麦Triticum aestivum TaAQP7(PIP2)在聚乙二醇(PEG)处理后表达量上调,在番茄Solanum lycopersicum中过量表达同样增强了其抗旱性。目前,马尾松水通道蛋白PIPs基因克隆和功能分析至今未见研究报道。因此,对马尾松水通道蛋白PIPs基因进行克隆并分析其在干旱胁迫下的响应模式,为马尾松抗旱基因工程和遗传改良提供可资利用的基因资源。
1 材料与方法
1.1试验材料
选用高抗旱马尾松优良家系1年生幼苗为供试材料。植株平均高度为17.2 cm。培养容器为塑料盆(27 cm×18 cm×25 cm),按V(黄壤)∶V(河砂)=9∶2混合构成。设对照(土壤相对含水量为70%±5%)和中度胁迫(土壤相对含水量为40%±5%)2个处理。每天通过称量法维持土壤相对含水量在试验设计的范围内。干旱胁迫实施0,3,5,10,15,20,25 d分根、茎、叶取试材,迅速彻底去除细土和其他杂物,液氮冷冻,保存于-80℃,作为实时荧光定量聚合酶链式反应(qRT-PCR)的试验材料。
1.2方法
1.2.1总核糖核酸(RNA)的提取参照Plant RNA Reagent与RNAprep pure Plant Kit说明书进行。
1.2.2目的基因克隆根据美国生物技术信息中心(NCBI)数据库中已报道的AQP基因序列,设计简并引物M1与M2(表1),获得PmPIP1基因中间片段。聚合酶链式反应(PCR)反应体系(25.0 μL):模板1.0 μL,引物各1.0 μL,MasterMix 12.5 μL,重蒸水9.5 μL。PCR反应条件:预变性94℃3 min,变性94℃30 s,退火48.7℃30 s,延伸72℃1 min,35个循环,后延伸72℃10 min。在此片段基础上,设计5′-RACE特异性引物GSP1,GSP2和GSP3(表1),参照5′-RACE system for rapid amplification of cDNA ends说明,扩增目的基因5′端序列。设计3′-RACE特异性引物M3与M4(表1),参照3′-FullRACE core set with prime ScriptTMRTase说明,扩增目的基因3′端序列。设计特异性引物M5与M6(表1),验证PmPIP1基因互补脱氧核糖核酸(cDNA)全长序列。PCR产物经琼脂糖凝胶电泳,紫外灯下切下相应条带,按照DNA Purification Kit试剂盒说明进行胶回收,与pMD18-T Vector连接,转化大肠埃希菌Escherichia coli DH5α感受态细胞,筛选阳性克隆子,送至北京诺赛基因组研究中心有限公司进行测序。

表1 PmPIP1基因克隆及表达使用的引物Table 1 PCR primers used to the cloning and expression of PmPIP1
1.2.3序列分析测序结果采用DNAStar进行拼接,并与美国国家生物技术信息中心(NCBI)数据库进行局部序列比对基本检索工具(BLAST)比对,利用ProtScale Sever软件分析蛋白亲水/疏水性;利用Ex-PASy ProtParam tool计算蛋白的等电点和分子量;利用TMHMM预测跨膜区;利用Signal P预测信号肽;利用SWISS-MODEL预测三级结构;利用DNAMAN软件进行蛋白质序列的多重比对并构建基因的系统进化树。
1.2.4基因表达分析设计特异引物M7和M8(表1)作为RT-qPCR引物,马尾松18S和泛素(UBC)(表1)基因为内标基因,进行RT-qPCR反应,重复3次·反应-1。PCR反应体系为2×荧光定量预混试剂增强版(super real premix plus)10.0 μL,正、反向引物各为0.6 μL,cDNA模板0.5 μL,重蒸水8.3 μL,终体积20.0 μL。扩增程序95℃1 min,95℃10 s,60℃32 s,共35个循环。基因相对表达量的计算采用2-ΔΔCT法[23]。采用SPSS16.0软件进行数据统计分析,用方差分析(ANOVA)模块分析差异显著性。
2 结果与分析
2.1马尾松PmPIP1基因cDNA全长的克隆
以cDNA为模板,用简并引物进行PCR扩增,获得1个458 bp的中间片段(图1A)。在此基础上,进行5′端与3′端PCR扩增。结果显示:5′-RACE在520 bp左右获得1条亮带(图1B), 3′-RACE在460 bp左右获得1条亮带(图1C)。PCR产物经回收、连接、转化、测序及拼接,获得PmPIP1基因序列。为验证PmPIP1序列准确性,进行基因全长PCR扩增,在867 bp左右获得1条亮带,大小与拼接得到的PmPIP1基因的完整开放阅读框大小一致(图1D)。阳性克隆经测序证实扩增序列与拼接结果一致。此基因已登录GenBank,登录号为KF582038。对PmPIP1基因全长序列分析表明:全长cDNA为1 301 bp,含1个完整开放阅读框867 bp,5′末端非翻译区99 bp,3′末端非翻译区335 bp,在100 bp处发现起始密码子ATG,964 bp处发现终止密码子TAG,编码288个氨基酸(图2)。利用NCBI的BLAST对PmPIP1进行蛋白保守区预测(图3),结果显示:PmPIP1有1个MIP保守区。PmPIP1的氨基酸残基在MIP匹配区内与MIP蛋白保守区序列完全一致,可以推测PmPIP1基因是水通道蛋白基因家族一员。
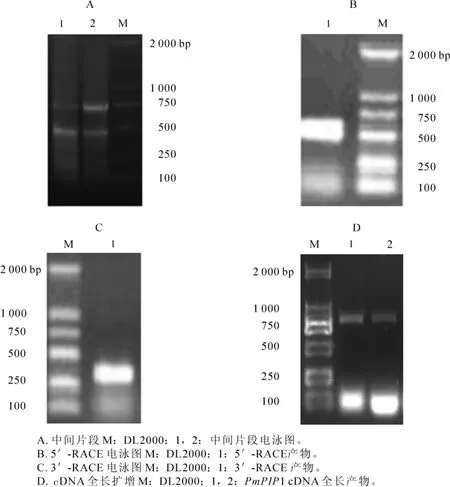
图1 琼脂糖凝胶电泳结果Figure 1 Agarose gel electrophoresis results

图2 PmPIP1基因核苷酸序列及推测的氨基酸序列Figure 2 Nucleotide sequence and amino acid sequence of the PmPIP1 gene
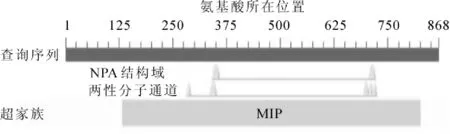
图3 PmPIP1核酸序列的保守结构域Figure 3 Conserved domains of nucleic acid sequences of PmPIP1
2.2生物信息学分析
ProtParam分析表明PmPIP1蛋白分子量为30.86 kD,理论等电点为8.48。此蛋白中相对含量比较多的氨基酸是甘氨酸Gly(G)和丙氨酸Ala(A),分别为36和34个;蛋白质不稳定指数为30.91,属于稳定蛋白。经Signal P分析,没有信号肽切割位点,说明此蛋白为非分泌蛋白。ProtScale表明此转运蛋白符合膜蛋白的特征,具有较强的疏水性。Predictprotein显示PmPIP1蛋白含有1个依赖于cAMP and cGMP蛋白激酶磷酸化位点、2个蛋白激酶C磷酸化位点、3个酪蛋白激酶Ⅱ磷酸化位点和10个肉豆蔻酰化位点。蛋白激酶C在许多信号通路中的功能与膜结合密切相关,N-豆蔻酰化一般被认为是一个组成性的过程和一个永久性的修饰,起开关作用[24]。这些位点可能与PmPIP1调控关系密切。
运用TMHMM Server软件对PmPIP1进行跨膜区分析,膜螺旋中氨基酸期望值高达127.431 43,且具有水通道蛋白典型的6个跨膜区(TM1~TM6),由膜两侧的5个亲水环(Loop A,B,C,D,E)连接,A,C和E环在细胞膜外,B,D环及N,C末端都位于细胞膜内(图4)。TM2和TM3之间,TM5与TM6之间,各包含有1个天门冬酰胺-脯氨酸-丙氨酸Asn-Pro-Ala(NPA)保守结构域,NPA高度保守,几乎所有的MIP均具有此结构域。PmPIP1具有质膜水通道蛋白C环和E环的特征序列(GGGANXXXXGY 和TGI/TNPARSL/FGAAI/VI/VF/YN)以及水通道形成有关的高度保守的EXXXTXXF/L单元,这与已经证明具有水通道蛋白功能的AtPIP1功能区的氨基酸序列高度一致。N末端53个氨基酸, C末端9个氨基酸,符合植物水通道蛋白PIPl亚家族成员的N-端长、C-端短的特点,因此,推测PmPIP1基因属于PIP1亚家族成员。

图4 PmPIP1蛋白跨膜区的预测Figure 4 Prediction model for transmenbrane domain of PmPIP1 protein
将PmPIP1与己知的其他植物水通道蛋白进行氨基酸序列多重比对分析,结果表明:PmPIP1与挪威云杉Picea abies具有极高的同源性,可达95%,与拟南芥,葡萄Vitis vinifera,陆地棉Gossypium hirsutum,无梗花栎Quercus petraea,野茶树Camellia sinensis,小果野芭蕉Musa acuminata,烟草Nicotiana tabacum,白花柽柳Tamarix albiflonum等植物的同源性达83%~87%(图5)。由此可以看出:水通道蛋白基因家族编码蛋白氨基酸序列的保守性非常强,不同植物的水通道蛋白序列具有高度的同源性。

图5 PmPIP1氨基酸序列与其他植物AQP基因的氨基酸序列多重比对Figure 5 Multi-comparison in amino acid sequence of AQP gene between Pinus massoniana and other plant species
将PmPIP1氨基酸序列与其他植物AQP基因进行系统进化树分析(图6)。结果表明:PmPIP1与挪威云杉亲缘关系最近,而且明显可以看出PmPIP1与PIPs蛋白聚为一类,与NIPs,TIPs,SIPs蛋白等进化距离较远(图6)。因而推测PmPIP1在PIPs蛋白进化上是保守的。

图6 PmPIP1蛋白的系统进化分析Figure 6 Phylogenetic analysis of PmPIP1 and other plant species
经SWISS-MODEL模型,采用自动搜索模式对PmPIP1氨基酸三级结构进行预测。结果显示:模型残基从44~278 bp,三级结构预测的模板是菠菜Spinacia oleracea(2b5fA),序列同源性77.872%。经Rasmol查看,发现两者的结构十分相似(图7)。
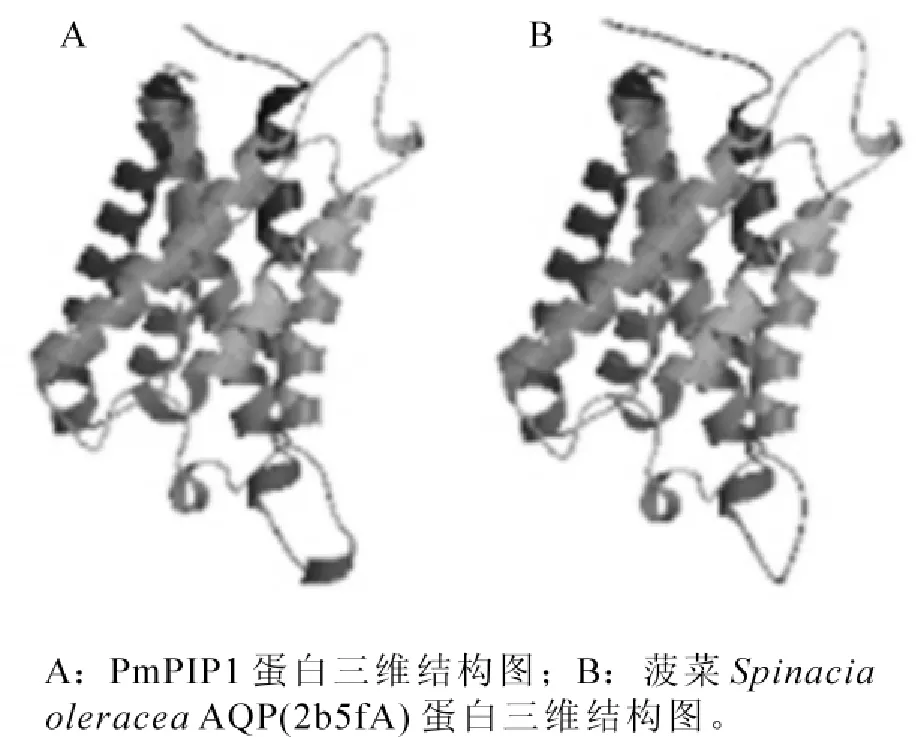
图7 PmPIP1蛋白三维结构预测与菠菜AQP (2b5fA)蛋白三维结构预测Figure 7 The 3-dimensional prediction of the PmPIP1 and the spinach aquaporin(2b5fA)
2.3PmPIP1基因在马尾松各组织中的表达及干旱胁迫下的表达分析
分别以马尾松根、茎和叶cDNA为模板,进行PmPIP1基因的RT-PCR反应,18S作为内参基因,结果如图8A所示。PmPIP1在根、茎、叶中均有表达,根中表达量最高,其次是茎和叶。为明确干旱胁迫对PmPIP1基因表达的影响,使用qRT-PCR技术研究马尾松根、茎和叶表达模式。在干旱胁迫下,以18S为内参分析(图8B),PmPIP1基因在根、茎中表达水平基本逐步升高,且在第10天表达程度最为强烈,而后开始降低;叶中表达量差异不大。以UBC为内参分析(图8C),在根、茎、叶中表达水平趋势基本与以18S为内参的结果基本一致。上述结果暗示,PmPIP1基因的表达与干旱胁迫相关。

图8 PmPIP1基因的相对表达量分析Figure 8 Analysis of relative expression level of PmPIP1
3 讨论
马尾松是荒山造林的先锋树种,同时也是一种非常重要的耐旱树种,可能蕴含着丰富的抗逆基因资源。为了在分子水平上深入研究马尾松抗旱分子机制,本研究对马尾松重要的耐旱相关基因-水通道蛋白基因开展了研究。
通过RT-PCR及表达序列标签(EST)序列拼接,获得PmPIP1基因,该基因具有MIP家族典型的保守氨基酸序列HINPAVTFG,2个NPA保守肽段,6个跨膜结构域,较长的N端和较短的C端,说明该蛋白属于水通道蛋白基因家族一员。聚类分析表明:PmPIP1与挪威云杉同源关系达95%,与其他8种植物AQP基因同源性达83%~87%。将PmPIP1与其他植物AQP基因构建系统进化树分析,进一步推测PmPIP1属于质膜水通道蛋白PIPs亚家族,与挪威云杉亲缘遗传距离最近。三级结构预测表明:PmPIP1与已登陆的菠菜(2b5fA)AQP三级结构极为相似。大量研究已表明,AQP是调节水分在细胞间以及植物整个体内水分平衡分子基础[25],其中大约70%~90%的水分受到水通道蛋白基因的表达调控[26]。PmPIP1基因与AQP基因的相同保守性以及基本结构的相吻合意味着PmPIP1在功能上可能具有与其他物种非常相近的作用模式[27-28]。
植物AQP的转运活性受磷酸化调控,是细胞信号转导与水分运输调节的媒介,磷酸化时水通道蛋白水运转活性增加,直接就近参与原位的快速、直接、可逆的门控[20,25],促进上调水通道的活性[29]。PmPIP1蛋白包括5个色氨酸(Ser),2个苏氨酸(Thr)和2个酪氨酸(Tyr)。这些位点可能成为蛋白激酶磷酸化位点,直接或间接参与PmPIP1对水分或其他物质运输的调节。
在研究植物抗旱分子机制的过程中,从干旱诱导的基因中已分离出很多水通道蛋白基因[30-31]。AQP蛋白受环境条件和植物激素的调节,有些组成型表达,有些特异性表达,参与根叶生长、有性繁殖及非生物胁迫等过程[32-34],表达方式也存在显著差异[35]。Marc等[36]研究表明, PIP1和PIP2基因在生殖器官中的表达水平不同,PIP1 RNA在柱头累积, PIP1和PIP2 RNA在花粉囊的几乎所有组织中多有表达。JcPIP在植株的整个生长发育期都有表达,在干旱胁迫下表达量增加[32]。PIP2在木榄树Bruguiera gymnorhiza根中表达量明显强于嫩茎和叶[37]。本研究发现PmPIP1基因在马尾松的根、茎、叶中均有表达,根中表达量最高,茎次之,叶最低。水通道蛋白在不同组织中的含量不同,并随细胞生理状态和环境与刺激产生波动[38]。PmPIP1基因在干旱胁迫不同时期的表达特性分析显示,PmPIP1在根、茎中表达水平首先呈上升趋势,表明干旱初期随着时间延长,PmPIP1受到水分亏缺的诱导,表达量增加,到第10天表达量达到最高值,随后由于PmPIP1无法再适应干旱的加剧,于是呈现下降趋势;叶中表达量差异不大。推测PmPIP1基因的这种表达模式可能与植物在干旱胁迫下首先由根系从土壤中吸收水分,再经木质部导管向上运输最后由叶片蒸腾散失的生理现象相关。
XU等[39]分离到MaPIP1;1基因,并且在拟南芥中过表达MaPIP1;1增强了转基因植株的耐盐和渗透胁迫能力。因此将PmPIP1转入模式植物(拟南芥、烟草等)并验证是否能提高转基因植株抗旱能力需要进一步验证。本实验室目前正在进行转基因研究,以期为该基因在植物中的进一步利用奠定基础。
4 参考文献
[1]MAUREL C, VERDOUCQ L, LUU D T, et al.Plant aquaporins: membrane channels with multiple integrated functions [J].Annu Rev Plant Biol, 2008, 59: 595 - 624.
[2]MAUREL C, REIZER J, SCHROEDER J I, et al.The vacuolar membrane protein gamma-TIP creates water specific channels in Xenopus oocytes[J].EMBO J, 1993, 12(6): 2241 - 2247.
[3]LUDEWIG U, DYNOWSKI M.Plant aquaporin selectivity: where transport assays, computer simulations and physiology meet[J].Cell Mol Life Sci, 2009, 66(19): 3161 - 3175.
[4]PIEN'KOWSKA, J R, KOSICKA E, WOJTKOWSKA M, et al.Molecular identification of first putative aquaporins in snails[J].J Membrane Biol, 2014, 247(3): 239 - 252.
[5]邹智,王丹华,莫业勇,等.橡胶死皮相关液泡型水通道蛋白基因TIP1的克隆与序列分析[J].安徽农业科学,2013, 41(36):13851 - 13854.ZOU Zhi, WANG Danhua, MO Yeyong, et al.Molecular cloning and sequence analysis of a tonoplast aquaporin gene TIP1 associated with tapping panel dryness in Hevea brasiliensis[J].J Anhui Agric Sci, 2013, 41(36): 13851 -13854.
[6]ALEXANDERSSON E, FRAYSSE L, SJÖVALL-LARSEN S, et al.Whole gene family expression and drought stress regulation of aquaporins[J].Plant Mol Biol, 2005, 59(3): 469 - 484.
[7]LIAN Hongli, YU Xin, YE Qin, et al.The role of aquaporin RWC3 in drought avoidance in rice[J].Plant Cell Physiol, 2004, 45(4): 481 - 489.
[8]LI Guowei, PENG Yanhui, YU Xin, et al.Transport functions and expression analysis of vacuolar membrane aquaporins in response to various stresses in rice[J].J Plant Physiol, 2008, 165(18): 1879 - 1888.
[9]JOHANSON U, KARLSSON M, JOHANSSON I, et al.The complete set of genes encoding major intrinsic proteins in Arabidopsis provides a framework for a new nomenclature for major intrinsic protein in plants[J].Plant Physiol, 2001, 126(4): 1358 - 1369.
[10]CHAUMONT F, BARRIEU F, WOJCIK E, et al.Aquaporins constitute a large and highly divergent protein family in maize[J].Plant Physiol, 2001, 125(3): 1206 - 1215.
[11]SUGA S, IMAGAWA S, MAESHIMA M.Specificity of the accumulation of mRNAs and proteins of the plasma membrane and tonoplast aquaporins in radish organs[J].Planta, 2001, 212(2): 294 - 304.
[12]丁贵杰,周志春,王章荣,等.马尾松纸浆用材林培育与利用[M].北京:中国林业出版社,2006:111.
[13]谌红辉,丁贵杰.马尾松造林密度效应研究[J].林业科学,2004,40(1):92 - 98.CHEN Honghui, DING Guijie.Study on planting density effects for Masson pine plantation[J].Sci Silv Sin, 2004, 40(1): 92 - 98.
[14]施积炎,丁贵杰,袁小凤.不同家系马尾松苗木水分参数的研究[J].林业科学,2004,40(3):51 - 55.SHI Jiyan, DING Guijie, YUAN Xiaofeng.Studies on water parameters in Pinus massoniana seedlings of different families[J].Sci Silv Sin, 2004, 40(3): 51 - 55.
[15]徐向华,丁贵杰.马尾松适应低磷胁迫的生理生化响应[J].林业科学,2006,42(9):24 - 28.XU Xianghua, DING Guijie.Physiological and biochemical responses of Pinus massoniana to low phosphorus stress [J].Sci Silv Sin, 2006, 42(9): 24 - 28.
[16]何佩云,丁贵杰,谌红辉.连栽马尾松人工林土壤肥力比较研究[J].林业科学研究,2011,24(3):357 - 362.HE Peiyun, DING Guijie, CHEN Honghui.Comparison on soil fertilities of Masson pine plantations of different generations[J].For Res, 2011, 24(3): 357 - 362.
[17]丁贵杰.马尾松人工纸浆材林采伐年龄初步研究[J].林业科学, 2000, 36(1): 15 - 20.DING Guijie.The preliminary study on optimum cutting age of pulpwood stand for Masson pine plantation[J].Sci Silv Sin, 2000, 36(1): 15 - 20.
[18]谌红辉,丁贵杰,温恒辉,等.造林密度对马尾松林分生长与效益的影响研究[J].林业科学研究,2011,24 (4):470 - 475.CHEN Honghui, DING Guijie, WEN Henghui, et al.Effects of planting density on growth and economic benefit of Masson pine plantation[J].For Res, 2011, 24(4): 470 - 475.
[19]王冰梅,郭晋隆,叶冰莹,等.马尾松银松素合酶基因启动子区的克隆及特征分析[J].亚热带农业研究,2008,4(4):292 - 296.WANG Bingmei, GUO Jinlong, YE Bingying, et al.Molecular cloning and analysis of pinosylvin synthase gene promoter from Pinus massoniana[J].Subtrop Agric Res, 2008, 4(4): 292 - 296.
[20]李擎天,赵宇,周绮云,等.珠眉海棠水通道蛋白MzPIP1;1基因的克隆与表达分析[J].中国农业大学学报,2012,17(3):63 - 68.LI Qingtian, ZHAO Yu, ZHOU Qiyun, et al.Cloning and expression analysis of MzPIP1;1 gene from Malus zumi Mats [J].J China Agric Univ, 2012, 17(3): 63 - 68.
[21]CUI Xianghuan, HAO Fushun, CHEN Hui, et al.Expression of the Vicia faba VfPIP1 gene in Arabidopsis thaliana plants improves their drought resistance[J].J Plant Res, 2008, 121(2): 207 - 214.
[22]ZHOU Shiyi, HU Wei, DENG Xiaomin, et al.Overexpression of the wheat aquaporin gene, TaAQP7, enhances drought tolerance in transgenic tobacco[J].PLoS One, 2012, 7(12): e52439.doi: 10.1371/journal.pone.0052439.
[23]PFAFFL M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Res, 2001, 29(9): 2002 - 2007.
[24]王垠,刘关君,阎秀峰,等.西伯利亚蓼PsPIP1基因的克隆及其在NaHCO3胁迫下的表达[J].遗传,2008,30(12):1621 - 1628.WANG Yin, LIU Guanjun, YAN Xiufeng, et al.Cloning of PsPIP1 gene from Polygonum sibiricum Laxm.and analysis of its expression in response to NaHCO3[J].Hereditas, 2008, 30(12): 1621 - 1628.
[25]JOHANSSON I, KARLSSON M, JOHANSON U, et al.The role of aquaporins in cellular and whole plant water balance[J].Biochim Biophys Acta Biomembr, 2000, 1465(1/2):324 - 342.
[26]HENZLER T, STEUDLE E.Reversible closing of water channels in charainternodes provides evidence for acomposite transport mode of the plasma membrance[J].J Exp Bot, 1995, 46(2): 199 - 209.
[27]艾雪,褚怀亮,李雪芹,等.山核桃水通道蛋白CcPIP同源基因克隆与表达分析[J].福建林学院学报,2009,29(3):252 - 257.AI Xue, CHU Huailiang, LI Xueqin, et al.The analysis of Carya carthayensis plasma membrane intrinsic protein gene CcPIP clone and expression[J].J Fujian Coll For, 2009, 29(3): 252 - 257.
[28]林江波,王伟英,邹晖,等.中国水仙水通道蛋白基因cDNA克隆、序列分析与表达[J].福建农业学报,2011,26(3):371 - 376.LIN Jiangbo, WANG Weiying, ZOU Hui, et al.Cloning, sequence analysis and expression of cDNA encoding aquaporin NtPIP1 of Narcissus tazetta var.chinensis[J].Fujian J Agric Sci, 2011, 26(3): 371 - 376.
[29]CHAUMONT F, MOSHELION M, DANIELS M J.Regulation of plant aquaporin activity[J].Biol Cell, 2005, 97(10): 749 - 764.
[30]LI Liang, WANG Weiqi, HUANG Shan, et al.Cloning and function analysis of a plasma membrane intrinsic protein gene, GmPIP in soybean(Glycine max L.Merr)[J].Australian J Crop Sci, 2014, 8(5): 738 - 746.
[31]MA Pengda, LIU Jingying.Isolation and characterization of a novel plasma membrane intrinsic protein gene, LcPIP1, in Leymus chinensis that enhances salt stress tolerance in Saccharomyces cerevisiae[J].Appl Biochem Biotechnol, 2012, 166(2): 479 - 485.
[32]王云霄,张颖,江璐玎,等.麻疯树水通道蛋白新基因JcPIP干旱胁迫下的功能分析[J].热带亚热带植物学报,2008,16(4):289 - 295.WANG Yunxiao, ZHANG Ying, JIANG Luding, et al.Cloning of a new aquaporin gene(JcPIP)from Jatropha curcas and analysis of its function under drought stress[J].J Trop & Subtrop Bot, 2008, 16(4): 289 - 295.
[33]张军锋,邓西平,慕小倩.植物的水通道蛋白[J].植物生理学通讯,2002,38(1):88 - 91 ZHANG Junfeng, DENG Xiping, MU Xiaoqian.Plant aquaporin[J].Plant Physiol Commun, 2002, 38(1): 88 - 91.
[34]刘迪秋,王继磊,葛锋,等.植物水通道蛋白生理功能的研究进展[J].生物学杂志,2009,26(5):63 - 66.LIU Diqiu, WANG Jilei, GE Feng, et al.Advances in the physiological functions of plant aquaporins[J].J Biol, 2009, 26(5): 63 - 66.
[35]王为,王长彪,陈浩东,等.棉花水通道蛋白序列生物信息学初步分析[J].浙江农业学报,2013,25(1):14 - 20.WANG Wei, WANG Changbiao, CHEN Haodong, et al.Preliminary bioinformatics analysis of aquaporin sequences available in cotton[J].Acta Agric Zhejiang, 2013, 25(1): 14 - 20.
[36]BOTS M, FERON R, UEHLEIN N, et al.PIP1 and PIP2 aquaporins are differentially expressed during tobacco anther and stigm a development[J].J Exp Bot, 2005, 56(409): 113 - 121.
[37]祝艺懿,韩渊怀,李正国,等.红树林植物木榄水通道基因的克隆和表达[J].植物生理学通讯,2007,43 (3):438 - 442.ZHU Yiyi, HAN Yuanhuai, LI Zhengguo, et al.Cloning and expression of a new aquaporin gene from Bruguiera gymnorhiza(L.)Lam[J].Plant Physiol Comm, 2007, 43(3): 438 - 442.
[38]刘悦霞,梁卫红,张利娟.水稻叶片中水通道蛋白基因OsAQP的表达分析[J].中国水稻科学,2008,22 (5):545 - 547.LIU Yuexia, LIANG Weihong, ZHANG Lijuan.Expression analysis on OsAQP gene in rice leaves[J].Chin J Rice Sci, 2008, 22(5): 545 - 547.
[39]XU Yi, HU Wei, LIU Juhua, et al.A banana aquaporin gene, MaPIP1;1, is involved in tolerance to drought and salt stresses[J].BMC Plant Biol, 2014, 14(1): 59.doi:10.1186/1471-2229-14-59.
Cloning of the PmPIP1 gene from Pinus massoniana and its expression with drought stress
CAI Qiong1,2, DING Guijie1,2, WEN Xiaopeng3
(1.Institute of Forest Resources and Environment, Guiyang 550025, Guizhou, China; 2.College of Forestry, Guizhou University, Guiyang 550025, Guizhou, China; 3.Guizhou Key Laboratory of Agricultural Bioengineering, Guizhou University, Guiyang 550025, Guizhou, China)
Abstract:The aquaporin(AQP)gene plays an important role in plants adapting to abiotic stresses.To predict the AQP gene function and provide basal data for mechanism of Pinus massoniana’s drought resistance, the sequence characteristics of the AQP gene from P.massoniana were analyzed and its expression profiling was studied after drought-stress treatment.The AQP gene was cloned using reverse transcription-polymerase chain reaction(RT-PCR)and rapid-amplification of complementary deoxyribonucleic acid(cDNA)ends(RACE).The expression of the AQP gene was then performed using quantitative reverse transcriptase-polymerase chain reaction(qRT-PCR).The full-length cDNA of the AQP gene from P.massoniana, designated PmPIP1 with a registered number in GenBank KF582038, was obtained.Results of the sequence analysis showed that the sizebook=192,ebook=13of PmPIP1 was 1 301 bp, containing an 867 bp open reading frame that encoded 288 amino acid residues with 30.86 kDa molecular weight and an 8.48 isoelectric point, a 99 bp 5′terminal untranslated regions(UTR), and a 335 bp 3′terminal UTR.The PmPIP1 3D structure had a strong similarity to Spinacia oleracea(2b5fA).PmPIP1 exhibited a typical structure with six transmembrane domains, and had the consensus sequence HINPAVTFG of membrane intrinsic protein(MIP)family and two highly conserved peptides Asn-Pro-Ala(NPA).The evolutionary analysis revealed that PmPIP1 shared a 95% identity with Picea abies and belonged to PIPs.The PmPIP1 expression patterns with drought conditions showed that drought did induce PmPIP1.In conclusion, cloning of the PmPIP1 gene from P.massoniana enriched the plant aquaporin gene database, and the qRT-PCR analysis indicated that the PmPIP1 gene may be involved in the response related to drought stress.[Ch, 8 fig.1 tab.39 ref.]
Key words:botany; Pinus massoniana; aquaporin; cloning; expression
作者简介:蔡琼,从事林木栽培生理生态与分子生物学研究。E-mail:dukecq@sina.com。通信作者:丁贵杰,教授,博士生导师,从事森林培育和人工林稳定性等研究。E-mail:gjdinggzu@126.com
基金项目:国家自然科学基金资助项目(31260183);“十二五”国家科技支撑计划项目(2015BAD09B0102);国家高技术研究发展计划(“863”计划)项目(2011AA10020301);贵州省重大专项(黔科合重大专项字[2012]6001号);贵州省人才基地建设项目(黔人领发[2009]9号)
收稿日期:2015-04-10;修回日期:2015-05-18
doi:10.11833/j.issn.2095-0756.2016.02.002
中图分类号:S791.248
文献标志码:A
文章编号:2095-0756(2016)02-0191-10

