雷竹和拟南芥SOC1多聚体差异性分析
施 泉,陈晓沛,林新春,徐永汉,徐英武(浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江临安311300)
雷竹和拟南芥SOC1多聚体差异性分析
施泉,陈晓沛,林新春,徐永汉,徐英武
(浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江临安311300)
摘要:MADS-box是一个超家族基因,可通过形成多聚体复合物实现对花发育的调控。其中SUPPRESSOR OF OVEREXPRESSION OF CO1(SOC1)作为MADS-box家族的重要成员,对花形成时间起决定作用。作为转录因子蛋白,SOC1包含MADS,I,K和C 4个独特功能的结构域,发挥功能的过程中,其中K结构域能够调控同源或是异源蛋白多聚体的形成,I结构域能够稳定转录因子结合DNA的作用。在单子叶植物雷竹Phyllostachys violascens和拟南芥Arabidopsis thaliana中,开花时间模式上存在明显差异,前者开花时间不确定,后者是确定的。尽管不能直接推断这种现象与SOC1形成植物不同复合物相关联,但雷竹和拟南芥SOC1是否具有形成相同模式的复合物对于竹类植物开花时间的研究具有重要意义。以雷竹和拟南芥SOC1作为研究对象,通过酵母双杂交实验,重点分析SOC1在形成多聚体模式方面的差异性。结果表明:拟南芥SOC1能形成同源二聚体,并且可通过结构域是I和K区形成同源多聚体;而雷竹SOC1不能形成多聚体,但可以通过K结构域形成同源二聚体。因此,I结构域可能是引起拟南芥和雷竹SOC1多聚体状态不同的一个原因,这个结构域是否对开花定时起决定作用还有待进一步转基因功能验证。图5表2参29
关键词:植物学;MADS-box;SOC1;雷竹;拟南芥;酵母双杂交;多聚体状态;I和K结构域
植物从营养生长向生殖生长的过程中,花的发育是一个重要的环节,由一系列外部环境和内部因子决定[1-2]。大多数MADS-box基因参与花发育的不同阶段,相互之间可形成复杂的复合物并构成复杂的网络,控制花发育的整个过程[2-4]。SOC1基因作为MADS-box家族中的一员,能够整合自主途径、春化途径、光周期途径和赤霉素途径中的信号分子,作用于下游特异性基因,进而调控花期[2, 5]。在光周期途径中,SOC1不仅受CO的调控,同时SOC1还反馈作用于CO。实验表明CO的过量表达能够促进下游基因SOC1的表达,此外功能缺失的SOC1可以通过CO转基因植株而提前开花[6-9]。SOC1基因的活化同时受到开花素蛋白FT的调控,另外在调控开花时,FT和FD的共同作用可以提高SOC1基因的表达[10-11]。SOC1编码的蛋白属于MIKC型转录因子,其结构域中MADS盒子能够与特异性的DNA结合形成复合物[12-13],并且与其他蛋白相互作用调控靶基因的表达[14]。SOC1的C末端属于保守的motif结构域[14-15],且能够调整MADS结构域的相互作用,稳定或增强K结构域介导的相互作用[16]。植物开花过程中,SOC1不仅能够与AGL24形成异源二聚体,整合开花信号来促进开花[16-17],还能够作为赤霉素(GA)的靶基因调控开花[1, 18-19]。植物开花具有多样性特征,如木本植物雷竹Phyllostachys violascens,开花时间不确定,通常零星开花,且开花类型复杂多样,花序为假花序,结实率低[20]。草本植物拟南芥Arabidopsis thaliana开花时间和形态具有确定性。雷竹和拟南芥开花时间特征明显不同,开花整合因子SOC1在这2种植物中均已被发现[21],并且PvSOC1在雷竹开花过程中的作用做了初步研究。作为研究SOC1对开花时间多样性作用的开始,这里我们分析雷竹和拟南芥SOC1在多聚体形成方面是否存在差异。研究采用同源克隆的方法,分别获得成花开关基因PvSOC1[21]和AtSOC1,同时构建2个基因全长的酵母双杂交载体,利用酵母双杂交方法,分析形成同源聚集状态的差异。通过构建不同结构域酵母双杂交载体,确定引起多聚体差异性对应的结构域。这一研究结果,对于理解SOC1基因在雷竹和拟南芥定时开花过程中的特异性作用,提供了一定的实验基础。
1 材料与方法
1.1实验材料
研究所用材料来自于实验室大棚内的已开花雷竹和温室内栽植的哥伦比亚野生型拟南芥。AtSOC1在开花的野生型拟南芥花、茎、叶中均有表达[4],故分别采取开花雷竹和拟南芥的茎、叶、花等不同组织,用液氮速冻保存,实验材料放置-80℃备用。
1.2RNA的提取和cDNA的反转录
将不同组织部位的样品等比例混合,用液氮磨碎,根据总核糖核酸(RNA)提取法(Trizol法)提取植物组织混合样品RNA,以10.0 g·L-1的琼脂糖凝胶电泳对RNA进行质量检测;采用PrimeScriptTM进行RNA的反转录,反转录的cDNA用于基因的克隆。
1.3PvSOC1和AtSOC1的基因克隆
根据美国生物技术信息中心(NCBI)中已知的拟南芥AtSOC1序列和实验室得到的雷竹PvSOC1序列,设计引物(表1),聚合酶链式反应(PCR)反应扩增目的片段,反应体系:cDNA 2.0 μL,10×PCR缓冲液3.0 μL,三磷酸碱基脱氧核苷酸(dNTPs)3.0 μL,上下游引物各1.5 μL,去离子水补足30.0 μL。琼脂糖凝胶电泳检测目的片段的扩增,胶回收目的片段,纯化后的产物连接到pMD-19(simple)载体上,转入感受态细胞DH5α蓝白斑筛选,PCR验证,提取质粒送往生物公司测序。
1.4PvSOC1和AtSOC1氨基酸序列分析
采用BioEidt软件对PvSOC1-like基因序列进行翻译,NCBI中进行氨基酸序列对比,结合DANman软件,进行PvSOC1-IKC(缺少MADS结构域部分)氨基酸序列同源性分析。
1.5PvSOC1和AtSOC1自激活活性检测
采用特异性引物(表1),构建SOC1酵母双杂交载体,双酶切产物分别连入pGADT7(AD-Active domain)和pGBKT7(BD-Binding domain)载体中去,转入感受态细胞DH5α,阳性单克隆提取质粒测序验证序列正确性,LiAc转化法将AD和BD重组载体分别转入Y187和AH109感受态细胞中,分别涂布在缺少亮氨酸和色氨酸(SD/-Leu和SD/-Trp)的培养基上,30℃培养3~5 d,挑取单克隆活化培养进行菌液PCR验证,阳性单克隆采用点滴法在含有X-a-Gal的缺陷培养皿上进行自激活活性检测,其中AD和BD载体为阴性对照,PcL为阳性对照。30℃培养,观察菌斑显色情况。

表1 实验过程中所用的引物Table 1 Primer sequences used in experiment
1.6PvSOC1和AtSOC1多聚体分析检测
经过验证的阳性单克隆菌液AD-PvSOC1/AtSOC1(或BD-PvSOC1/AtSOC1)分别与BD-PvSOC1/AtSOC1(AD-PvSOC1/AtSOC1),BD(AD)空载杂交,分别吸取10.0 μL的菌液,600.0 μL的完全培养剂(YPDA)液体过夜培养,100.0 μL培养液涂布在同时缺少亮氨酸和色氨酸(SD/-Leu-Trp)的培养皿上,30℃培养3~5 d,挑取单克隆在液体培养基SD/-Leu-Trp中培养,吸取10.0 μL培养液,点滴在含有X-a-Gal的4缺(SD/-Leu-Trp-Ade-His)固体培养皿上培养,观察是否显色,如果单克隆变蓝证明发生相互作用形成二聚体结构。
1.7PvSOC1和AtSOC1不同结构域载体的构建并转入酵母细胞
将PvSOC1和AtSOC1分成M,I,K和C 4个不同的结构域,构建包括M,MIK,KC和C不同结构域的酵母双杂交载体,设计引物(表1),纯化的PCR产物经双酶切后分别连入AD和BD载体中去,转入DH5α,菌液检测阳性克隆,提取质粒。采用LiAc转化法,PEG3350/DMSO制备感受态细胞。转入酵母宿主中去,在相应的缺陷培养皿上培养,挑取单克隆验证插入片段的大小。
1.8结构域重组体自激活活性检测和多聚体分析
将不同结构域酵母双杂载体杂交培养,在SD/-Leu-Trp培养皿上筛选杂合体,并在含有X-a-Gal的SD/-Leu-Trp缺培养皿上进行显色反应。为进一步确定实验的结果,将SD/-Leu-Trp缺培养皿上挑选出来的单克隆并在SD/-Leu-Trp+X-a-Gal培养皿上进行生长状态的培养,观察酵母的生长状态。
2 结果与分析
2.1PvSOC1和AtSOC1目的片段的结构域分析
部分结构域同源性分析结果表明:雷竹和其他SOC1基因序列存在差异性的部位主要集中在I和C结构域。不同的植物中I结构域差异性极大,大约有10~20个氨基酸组成。另外,C结构域氨基酸保守性较差,多疏水氨基酸结构。I和C结构域之间具有相对保守性的K结构域(图1)。
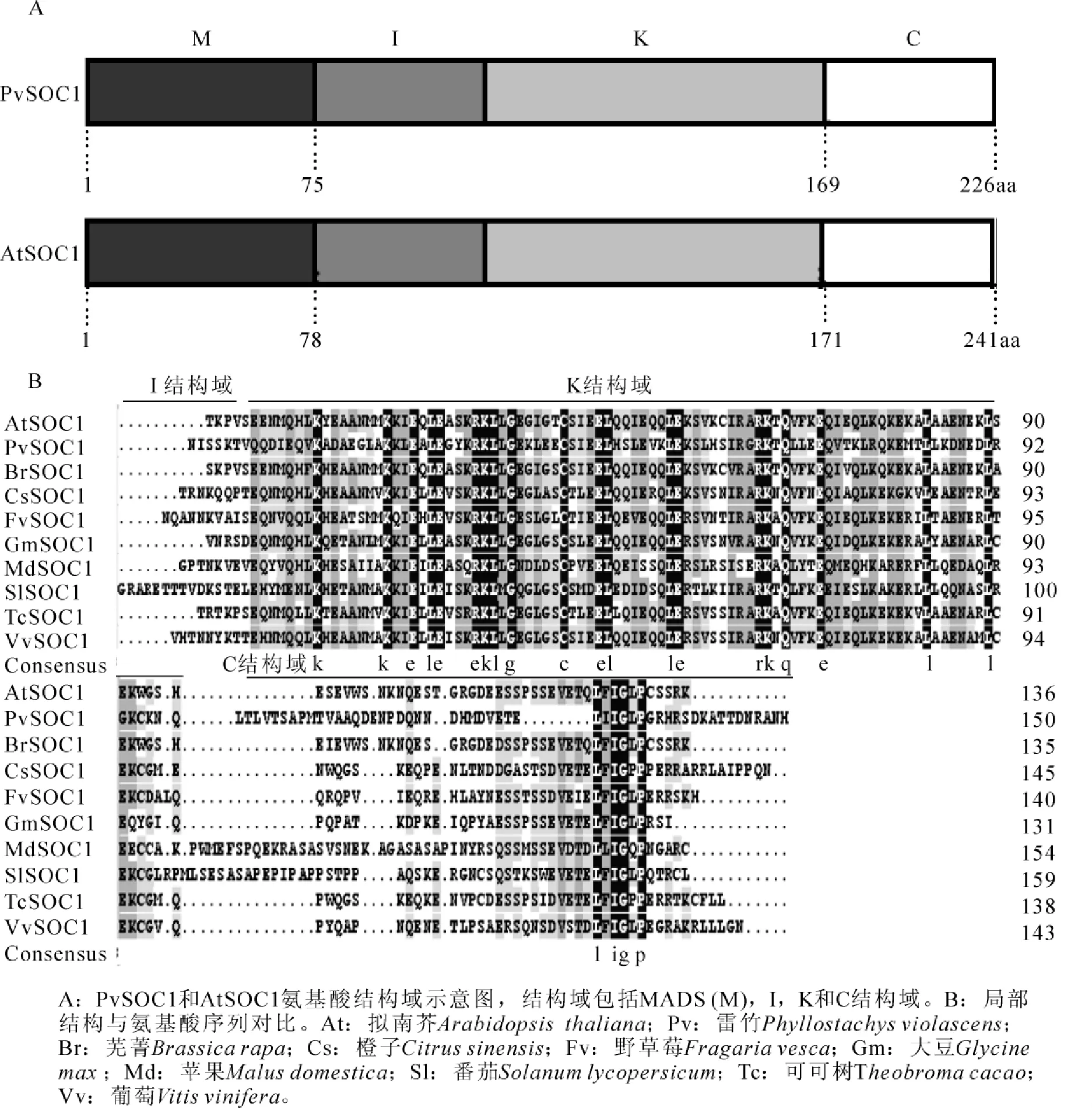
图1 结构域示意图和不同植物SOC1局部氨基酸序列对比Figure 1 Structural diagrams and amino acid sequence alignment
2.2全长PvSOC1和AtSOC1自激活和多聚体分析
实验结果分析可表明:雷竹PvSOC1和拟南芥AtSOC1都不存在自激活活性(图2A)。酵母双杂交多聚体分析结果表明:雷竹PvSOC1蛋白自身不存在相互作用,而AtSOC1易形成二聚体现象,自身相互作用(图2B和图2C)。
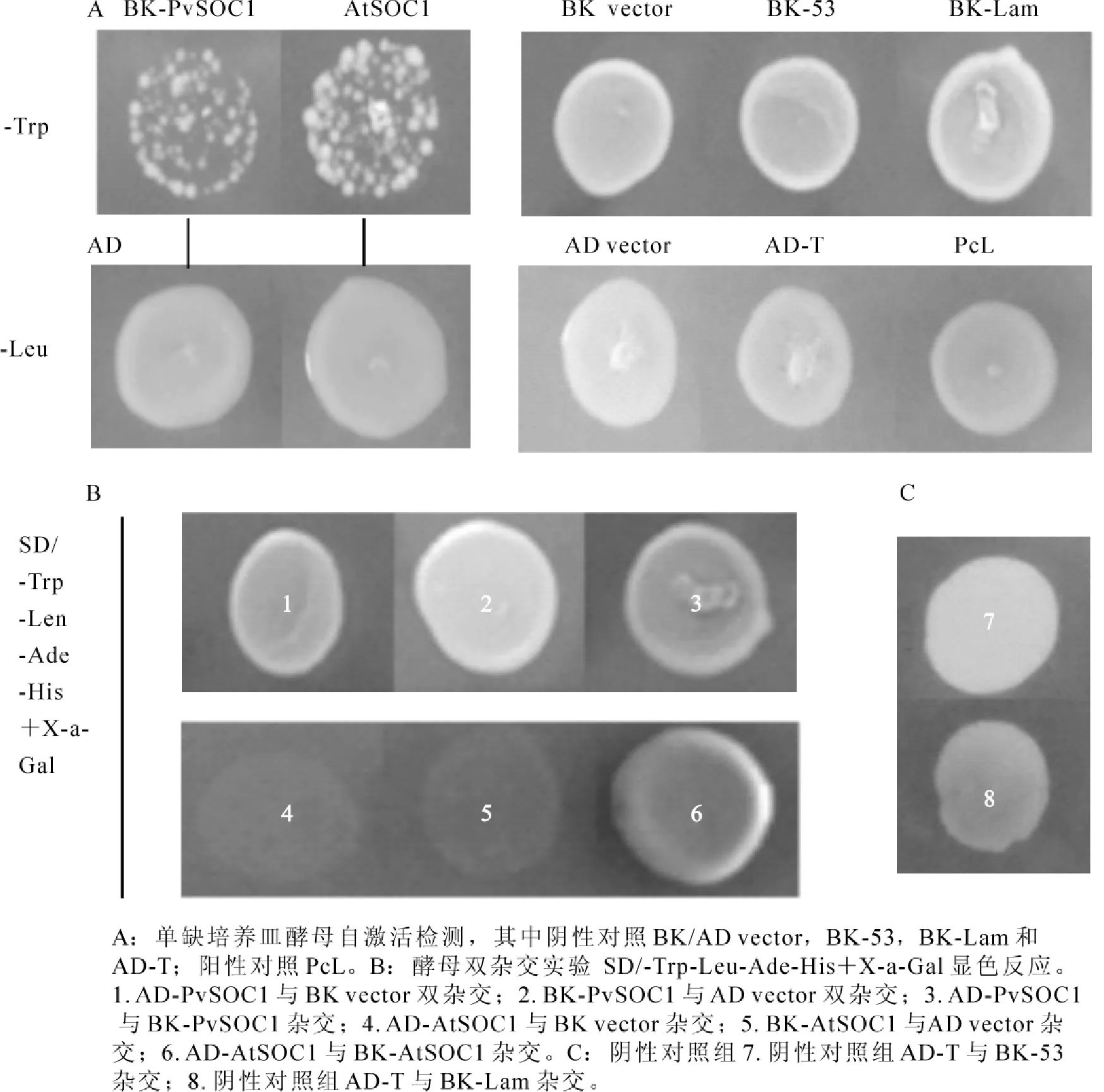
图2 PvSOC1和AtSOC1自激活检测和酵母双杂交实验Figure 2 Analysis of transcriptional activation and polymerization for PvSOC1 and AtSOC1
2.3雷竹PvSOC1不同结构域双杂交分析
PvSOC1基因不同结构域酵母双杂交实验可知:AD/BD-M/MIK/KC/C不存在自激活活性现象(图3B),不同结构域双杂实验可知PvSOC1中的KC结构域存在二聚体现象,自身相互作用;M,MIK和C结构域蛋白没有相互作用,图3C为阳性与阴性对照组(图3)。

图3 PvSOC1和AtSOC1不同结构域蛋白酵母转录激活检测Figure 3 Yeast two hybrid system to detect the transcriptional activation among different domains in PvSOC1 and AtSOC1, respectively

图4 PvSOC1不同结构域蛋白酵母双杂交实验多聚体分析Figure 4 Yeast-two hybrid assays to analyze the domain polymerization in PvSOC1
2.4拟南芥AtSOC1不同结构域双杂交分析
AtSOC1酵母双杂交不同结构域实验显示:结构域之间不存在自身活性现象(图3A);尽管实验中AtSOC1全长存在相互作用,能形成同源多聚体,但是单独的M和C结构域没有同样的多聚体现象发生;KC结构域并没有发生相互作用,在有I存在的MIK结构域蛋白可以形成多聚体状态,发生相互作用(图5)。
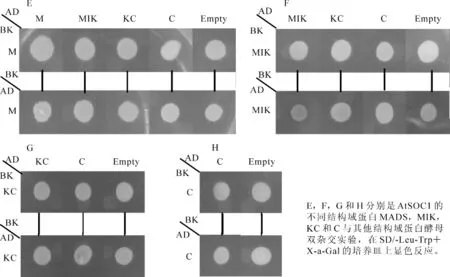
图5 AtSOC1不同结构域蛋白酵母双杂交实验多聚体分析Figure 5 Yeast-two hybrid assays to analyze the domain polymerization in AtSOC1
3 讨论
本研究以单子叶木本植物雷竹和双子叶草本植物拟南芥作为研究对象,针对PvSOC1和AtSOC1进行研究。拟南芥在开花的过程中,AtSOC1起到主要的枢纽作用。AtSOC1通过和自己形成不同的多聚体或者与其他MADS-box转录因子形成蛋白复合物来调节上下游基因的蛋白表达,进而调控花期[17, 22-23]。通过相关实验的证明,揭示了PvSOC1和AtSOC1的多聚体存在差异性。拟南芥中,酵母双杂交实验表明:AtSOC1自身可发生相互作用,形成同源二聚体,这一结果与文献[24]报道的一致;通过不同结构域双杂交实验进一步可知:C末端缺失的MIK结构域也能形成同源二聚体,KC结构域不能发生相互作用。由此判定,AtSOC1主要功能部位的是I和K结构域。另外,有研究发现K结构域在MADS转录因子蛋白中相对保守。K结构域包括3个疏水性的K1,K2和K3结构域,这些疏水性的氨基酸不仅仅能够协调自身同源二聚体的形成,还能够促进一些开花基因异源二聚体的形成。比如K结构域中的某些疏水氨基酸可以促进AP3和PI异源二聚体的形成从而调节花器官的发育[25]。同时K结构域在植物进化过程中也扮演着重要的角色。例如所有的MADS家族蛋白都能与特定的DNA相互结合形成同源或者异源二聚体[26],或者与其他非MADS家族中的蛋白形成三聚体。但是,K结构域的疏水特异性,更能够促进MADS家族内部成员形成各种各样复杂的高聚体,调节植物内部生殖生长的需要[27-28]。
对雷竹PvSOC1进行酵母双杂交实验,实验发现:尽管PvSOC1不易形成同源二聚体,但是在MADS和C结构域同时缺失的情况下,KC结构域可以形成同源二聚体,结构域K是主要的作用部位。雷竹PvSOC1和拟南芥AtSOC1酵母双杂交实验进行对比(表2),结果发现:引起PvSOC1和AtSOC1多聚体差异性的原因主要在于I结构域。I结构域大约有20~30个氨基酸组成,这些氨基酸相对的不保守,但是有实验发现I结构域不仅能够帮助转录因子结合DNA,还能够起到促进自身二聚体形成的作用[7, 22, 29]。氨基酸序列对比进一步表明,PvSOC1和AtSOC1中的I序列差异性极大,这种差异性有可能是PvSOC1和AtSOC1形成不同聚体状态的一个主要原因。尽管如此,雷竹与拟南芥SOC1蛋白在形成多聚体模式上的差异性,是否与PvSOC1在调控雷竹花期过程中的特异功能相关联,尚需通过转基因功能实验进行验证。

表2 PvSOC1和AtSOC1不同结构域双杂结果总结Table 2 Summary of the yeast two hybrid
4 参考文献
[1]MOON J, SUH S S, LEE H, et al.The SOC1 MADS-box gene integrates vernalization and gibberellin signals for flowering in Arabidopsis[J].Plant J, 2003, 35(5): 613 - 623.
[2]KIMURA Y, AOKI S, ANDO E, et al.A flowering integrator, SOC1, affects stomatal opening in Arabidopsis thaliana [J].Plant Cell Physiol, 2015, 56(4): 640 - 649.
[3]MELZER R, THEIβEN G.MADS and more: transcription factors that shape the plant[J].Methods Mol Biol, 2009, 754: 3 - 18.
[4]LEE H, SUH S S, PARK E, et al.The AGAMOUS-LIKE 20 MADS domain protein integrates floral inductive pathways in Arabidopsis[J].Genes & Dev, 2000, 14(18): 2366 - 2376.
[5]周佳平,林新春,徐英武.拟南芥SEPALLATA3蛋白质原核表达与纯化[J].浙江农林大学学报,2014,31 (1):14 - 18.ZHOU Jiaping, LIN Xinchun, XU Yingwu.Arabidopsis thaliana SEPALLATA3 protein in a prokaryotic system[J].J Zhejiang A & F Univ, 2014, 31(1): 14 - 18.
[6]SAMACH A, ONOUCHI H, GOLD S E, et al.Distinct roles of CONSTANS target genes in reproductive development of Arabidopsis[J].Science, 2000, 288(5471): 1613 - 1616.
[7]SONG Guoqing, WALWORTH A, HILDEBRANDT B, et al.Constitutive expression of the K-domain of a Vaccinium corymbosum SOC1-like(VcSOC1-K)MADS-box gene is sufficient to promote flowering in tobacco[J].Plant Cell Rep, 32(11): 1819 - 1826.
[8]KHAN M R, KHAN I U, ALI G M.MPF2-like MADS-box genes affecting expression of SOC1 and MAF1 are recruited to control flowering time[J].Mol Biotechnol, 2013, 54(1): 25 - 36.
[9]WIGGE P A, KIM M C, JAEGER K E, et al.Integration of spatial and temporal information during floral induction inArabidopsis[J].Science, 2005, 309(5737): 1056 - 1059.
[10]SOLOMON G L.A 6 1/2-pound device saves me tons of time[J].Med Econ, 1992, 69(21): 179 - 182.
[11]SEARLE I, HE Yuehui, TURCK F, et al.The transcription factor FLC confers a flowering response to vernalization by repressing meristem competence and systemic signaling in Arabidopsis[J].Gene & Dev, 2006, 20(7): 898 - 912.
[12]朱龙飞,徐英武,林新春.绿竹花发育相关基因BoAP3的克隆与分析[J].浙江农林大学学报,2013,30(6):839 - 842.ZHU Longfei, XU Yingwu, LIN Xinchun.Cloning and analysis of the flowering-related gene, BoAP3, in Bambusa oldhamii[J].J Zhejiang A & F Univ, 2013, 30(6): 839 - 842.
[13]POLLOCK R, TREISMAN R.Human SRF-related proteins: DNA-binding properties and potential regulatory targets [J].Genes Dev, 1991, 5(12a): 2327 - 2341.
[14]DING Lihua, WANG Yanwen, YU Hao.Overexpression of DOSOC1, an ortholog of Arabidopsis SOC1, promotes flowering in the orchid Dendrobium Chao Parya Smile[J].Plant Cell Physiol, 2013, 54(4): 595 - 608.
[15]NAKAMURA T, SONG I J, FUKUDA T, et al.Characterization of TrcMADS1 gene of Trillium camtschatcense (Trilliaceae)reveals functional evolution of the SOC1/TM3-like gene family[J].J Plant Res, 2005, 118(3): 229 -234.
[16]FAN Huaying, HU Yi, TUDOR M, et al.Specific interactions between the K domains of AG and AGLs, members of the MADS domain family of DNA binding proteins[J].Plant J, 1997, 12(5): 999 - 1010.
[17]LEE J, OH M, PARK H, et al.SOC1 translocated to the nucleus by interaction with AGL24 directly regulates LEAFY[J].Plant J, 2008, 55(5): 832 - 843.
[18]LIU Chang, CHEN Hongyan, ER H L, et al.Direct interaction of AGL24 and SOC1 integrates flowering signals in Arabidopsis[J].Development, 2008, 135(8): 1481 - 1491.
[19]JUNG J H, JU Y, SEO P J, et al.The SOC1-SPL module integrates photoperiod and gibberellic acid signals to control flowering time in Arabidopsis[J].Plant J, 2012, 69(4): 577 - 588.
[20]林新春,袁晓亮,林绕,等.雷竹开花生物学特性研究[J].福建林学院学报,2010,30(4):333 - 337.LIN Xinchun, YUAN Xiaoliang, LIN Rao, et al.Studies on floral biology of Phyllostachys violascens[J].J Fujian Coll For, 2010, 30(4): 333 - 337.
[21]马腾飞,林新春.植物SOC1/AGL20基因研究进展[J].浙江农林大学学报,2013,30(6):930 - 937.MA Tengfei, LIN Xinchun.Advanced research on SOC1/AGL20 genes in plants: a review[J].J Zhejiang A & F U-niv, 2013, 30(6): 930 - 937.
[22]SONG Guoqing, WALWORTH A, ZHAO Dongyan, et al.Constitutive expression of the K-domain of a Vaccinium corymbosum SOC1-like(VcSOC1-K)MADS-box gene is sufficient to promote flowering in tobacco[J].Plant Cell Rep, 2013, 32(11): 1819 - 1826.
[23]MELZER S, LENS F, GENNEN J, et al.Flowering-time genes modulate meristem determinacy and growth form in Arabidopsis thaliana[J].Nat Genet, 2008, 40(12): 1489 - 1492.
[24]LESEBERG C H, EISSLER C L, WANG X, et al.Interaction study of MADS-domain proteins in tomato[J].J Exp Bot, 2008, 59(8): 2253 - 2265.
[25]YANG Yingzhen, FANNING L, JACK T.The K domain mediates heterodimerization of the Arabidopsis floral organ identity proteins, APETALA3 and PISTILLATA[J].Plant J, 2003, 33(1): 47 - 59.
[26]BALLERINI E S, MOCKAITIS K, ARNOLD M L.Transcriptome sequencing and phylogenetic analysis of floral and leaf MIKC(C)MADS-box and R2R3 MYB transcription factors from the monocot Iris fulva[J].Gene, 2013, 531(2): 337 - 346.
[27]KAUFMANN K, MELZER R, THEIβEN G.MIKC-type MADS-domain proteins: structural modularity, protein interactions and network evolution in land plants[J].Gene, 2005, 347(2): 183 - 198.
[28]SEO E, LEE H, JEON J, et al.Crosstalk between cold response and flowering in Arabidopsis is mediated through the flowering-time gene SOC1 and its upstream negative regulator FLC[J].Plant Cell Online, 2009, 21(10): 3185 - 3197.
[29]MA H, YANOFSKY M F, MEYEROWITZ E M.AGL1-AGL6, an Arabidopsis gene family with similarity to floral homeotic and transcription factor gene[J].Genes & Dev, 1991, 5(3): 484 - 495.
Oligomeric status of the SOC1 gene from Phyllostachys violascens and Arabidopsis thaliana
SHI Quan, CHEN Xiaopei, LIN Xinchun, XU Yonghan, XU Yingwu
(The Nurturing Station for the State Key Laboratory of Subtropical Silviculture, Zhejiang A & F University, Lin’an 311300, Zhejiang, China)
Abstract:MADS-box genes are a super family, which can form different polymers to mediate the development of floral primordia and floral organs.The important one of MADs-box genes, SOC1[suppressor of overexpression of cytochrome oxidase 1], determine the flowering time.The MADS-box transcription factor, SOC1 contains four different functions domains: MADS, I, K, and C.The K domain controls the homologous or heterologous protein polymer formation.The I domain could stabilize the MADS-box proteins binding the DNA.In order to control the floral development, MADS-box proteins can form different complex.Visible difference in floral timing is demonstrated in Phyllostachys violascens and Arabidopsis thaliana.A.thaliana is certain in floral timing while Phyllostachys violascens is not.Though we cannot compare the difference in floral timing with the difference in SOC1 complex formation, it is still interesting.MADS-box genes such as SOC1 containing four different functions: MADS, I, K and C, control floral timing.To determine whether SOC1’s from different species demonstrated similar patterns in forming a complex, this study analyzed the differences of polymer for-book=184,ebook=5mation for SOC1 that originated from Phyllostachys violascens and Arabidopsis thaliana using a yeast two-hybrid assay.Results of the assay showed that the full-length AtSOC1 gene from A.thaliana formed strong homopolymers with the I and K domains being the main regions for formation of the interaction.However, the fulllength SOC1 from Phyllostachys violascens(PvSOC1)did not form a homodimer.Thus, even though the K protein domain could form a homodimer, the presence of the I protein domain disrupted the dimer meaning the I domain could be a key factor in SOC1 polymer formation; the role of the I domain in floral timing should be verified with a plant transgene study.[Ch, 5 fig.2 tab.29 ref.]
Key words:botany; MADS-box; SOC1; Phyllostachys violascens; Arabidopsis thaliana; yeast two-hybrid; polymer; I and K protein domain
作者简介:施泉,从事植物蛋白互作研究。E-mail:702431524@qq.com。通信作者:徐英武,教授,博士,博士生导师,从事蛋白和药物结构生物学等研究。E-mail:yxu@zafu.edu.cn
基金项目:国家自然科学基金资助项目(31270715,31000295);浙江省林学一级重中之重学科开放基金资助项目(KF201304);国家重点基础研究发展计划(“973”计划)项目(2012CB723008);浙江农林大学研究生创新基金资助项目(3122013240226)
收稿日期:2015-04-03;修回日期:2015-05-12
doi:10.11833/j.issn.2095-0756.2016.02.001
中图分类号:S718.3
文献标志码:A
文章编号:2095-0756(2016)02-0183-08

