流体剪切力对内皮细胞miR-21和miR-199a表达的影响
张 燕,王玉彩,刘振东,赵颖馨,张 华
(1.山东省医学科学院基础医学研究所, 济南 250062;
2.济南大学,山东省医学科学院医学与生命科学学院, 济南 250022;
3.山东省齐河县人民医院,山东齐河 251100)
流体剪切力对内皮细胞miR-21和miR-199a表达的影响
张燕1,2,3,王玉彩3,刘振东1*,赵颖馨1,张华1
(1.山东省医学科学院基础医学研究所, 济南 250062;
2.济南大学,山东省医学科学院医学与生命科学学院, 济南 250022;
3.山东省齐河县人民医院,山东齐河 251100)
摘要:为探讨流体剪切力对内皮细胞micorRNAs表达的影响。采用旋转锥形圆盘剪切力系统对内皮细胞分别加载低(4 dyn/cm2)、中(10 dyn/cm2)和高(15 dyn/cm2)3种不同梯度的剪切力作用24h。对照组未加载剪切力。采用高通量筛选芯片检测microRNAs表达变化,qRT-PCR验证,并进行生物信息学分析。与对照组比较,低剪切力组表达差异的microRNAs有33个(FC>1.5或<0.5倍,P<0.05),其中28个上调,5个下调;中剪切力组表达差异的microRNAs有8个(FC>1.5或<0.5倍,P<0.05),其中6个上调,2个下调;高剪切力组表达差异的microRNAs有31个(FC>1.5或<0.5倍,P<0.05),其中25个上调,6个下调。miR-21在高剪切力组中上调最显著(FC = 0.026), 在低剪切力组中显著下调(FC = 3.531)。miR-199a在低剪切力组中上调最显著(FC = 0.075),在高剪切力组中显著下调(FC = 3.031)。表达差异的microRNA的靶基因主要与内皮细胞的力学信号转导、细胞跨膜迁移、钙离子信号通路、细胞内吞作用等相关。流体剪切力可诱导内皮细胞miR-21和miR-199a表达发生改变。
关键词:剪切力;内皮细胞;microRNA;表达
血管内皮细胞(Endothelial cell, EC)是连接血流和血管壁的重要结构,是血流剪切力(Shear stress, SS)作用的靶细胞,其功能障碍是导致动脉粥样硬化形成的关键因素。研究表明[1-3],不同梯度的血流剪切力对内皮细胞的影响不同。microRNA是一类高度保守、内源性非蛋白编码小分子RNA,参与调节细胞分化、增殖、凋亡、代谢以及多种生物组织生长发育的重要过程[4],并且在机械生物力调节血管细胞生物学效应中也发挥着不可或缺的作用[5-6]。但目前,血流剪切力对内皮细胞microRNA表达的影响仍不清楚。本研究旨在通过高通量芯片筛选技术,探讨剪切力对内皮细胞microRNA表达的影响。
1材料和方法
1.1主要材料
人脐静脉内皮细胞(Cascade Biologics公司),TRIzol试剂(Invitrogen公司),microRNA高通量筛选芯片(Exiqon公司), microRNA逆转录试剂盒(Exiqon公司),miR-21和miR-199a PCR引物(Exiqon公司),U6引物(Exiqon公司),microRNA SYRB Green实时荧光定量试剂盒(Exiqon公司)。Res(纯度99.12%)购于陕西赛德生物股份有限公司,TRIzol试剂购于Invitrogen公司;逆转录试剂盒购于Promega公司;小鼠FITC标记的抗CD4、PE标记的CD25抗体购于eBioscience公司;mirVanaPARIS试剂盒购于Ambion公司,Quant cDNA第一链合成试剂盒、RealMasterMix (SYBR Green)等PCR相关产品均购自天根特殊化科技有限公司;AG490购自Sigma公司;STAT3及其磷酸化(Tyr705)抗体(p-STAT3)、β-tubulin购于Bioworld公司。
1.2方法
1.2.1细胞培养
将人脐静脉内皮细胞计数后种植在载玻片上,在含5% CO2的混合气体,温度为37℃的环境下培养,长满后用于实验。应用旋转锥形圆盘剪切力系统对培养的内皮细胞分别加载低(4 dyn/cm2)、中(10 dyn/cm2)和高(15 dyn/cm2)3种不同梯度的剪切力作用24 h。对照组未加载剪切力作用。
1.2.2总RNA提取
剪切力作用结束后,将收集的细胞用TRIzol裂解,冰上静置5 min后,加入氯仿,剧烈震荡15 s,15~30℃下孵育2~3 min,于4 ℃、12 000 g条件下离心15 min,将上清移至新的离心管,加入等体积异丙醇并混匀,冰上静置10 min,4 ℃、12 000 g条件下离心5 min。去上清,沉淀加入75%乙醇洗涤,漩涡振荡30 s后,于4 ℃,7 500 r/min离心5 min,DEPC(Diethypyrocar-bonate)水溶解RNA。凝胶电泳鉴定提取RNA的完整性,紫外分光光度仪测定RNA的含量和纯度。
1.2.3microRNA表达谱检测
采用Exiqon公司提供的microRNA高通量筛选芯片,并按说明书检测microRNA的表达谱,筛选表达差异的microRNA。1 μg总RNA用poly (A) polymerase和ATP作用后。microRNA被加上poly (A),按Flash Tag Biotin HSR Ligation标记并与芯片杂交,洗脱未杂交的分子后,采用Affymetrix扫描仪对芯片进行扫描,生成数据并分析差异表达。差异表达以变化倍数(Fold of change,FC)表示。
1.2.4microRNA qRT-PCR验证
选择miR-21和miR-199a用实时定量PCR(qRT-PCR)验证。cDNA合成操作严格按microRNA逆转录试剂盒说明书进行,反应体系为20 μl,模板RNA为25 ng。反应条件为:42 ℃,60 min;95 ℃,5 min,反应结束后直接用于PCR反应或-20 ℃保存备用。qRT-PCR使用ABI 7 500检测系统进行,以rRNA U6作为内参。反应体系为20 μl,反应条件为:95 ℃ 预变性10 min;95 ℃变性20 s,60 ℃退火1 min,72 ℃延伸30 s,循环40次。基因相对表达水平采用2-△△Ct法计算[7-8],计算公式为:△Ct值=目的基因Ct值-内参基因Ct值,△△Ct=△Ct实验-△Ct对照。表1为相关分析的引物序列。

表1 microRNA实时定量PCR检测相关引物序列
1.2.5microRNA靶基因预测和富集
采用miRanda、PicTar、TargetScan及miRBase 4个实时更新的在线数据库联合预测,将其交集的基因集合作进一步分析。采用跨平台芯片与路径数据的综合分析(Integrated analysis of Cross-platform MicroArray and Pathway data,IncroMAP)数据库进行靶基因富集分析[9],以P< 0.01为显著性阈值,分别得到具有统计学意义的信号转导和疾病通路。该数据库包含靶基因的生物学过程和分子功能分析,最新IncroMAP数据库可从网址(http://www.ra.cs.uni-tuebingen.de/software/InCroMAP/)免费下载,并附有Video使用教程。
1.3统计学分析
qRT-PCR检测数据采用SPSS17.0软件分析。计量资料以均数±标准差表示,采用t检验分析,P< 0.05为差异有统计学意义。
2结果
2.1高通量筛选表达差异的microRNAs
内皮细胞经不同梯度剪切力作用后,与对照组比较,低剪切力组表达差异的microRNAs有33个(FC>1.5或<0.5倍,P<0.05),其中28个上调,5个下调;中剪切力组表达差异的microRNAs有8个(FC>1.5或<0.5倍,P<0.05),其中6个上调,2个下调;高剪切力组表达差异的microRNAs有31个(FC>1.5或<0.5倍,P<0.05),其中25个上调,6个下调。表2为不同剪切力作用的内皮细胞表达差异的microRNAs。表达差异的microRNAs的聚类热图(图1)也显示出相同的结果,表达程度相似的microRNA聚类在一起,从绿色*到红色*表达水平依次增高。其中,miR-21在高剪切力组中上调最显著(FC=8.91), 在低剪切力组中显著下调(FC=0.47)。miR-199a在低剪切力组中上调最显著(FC=9.27),在高剪切力组中显著下调(FC=0.33)。
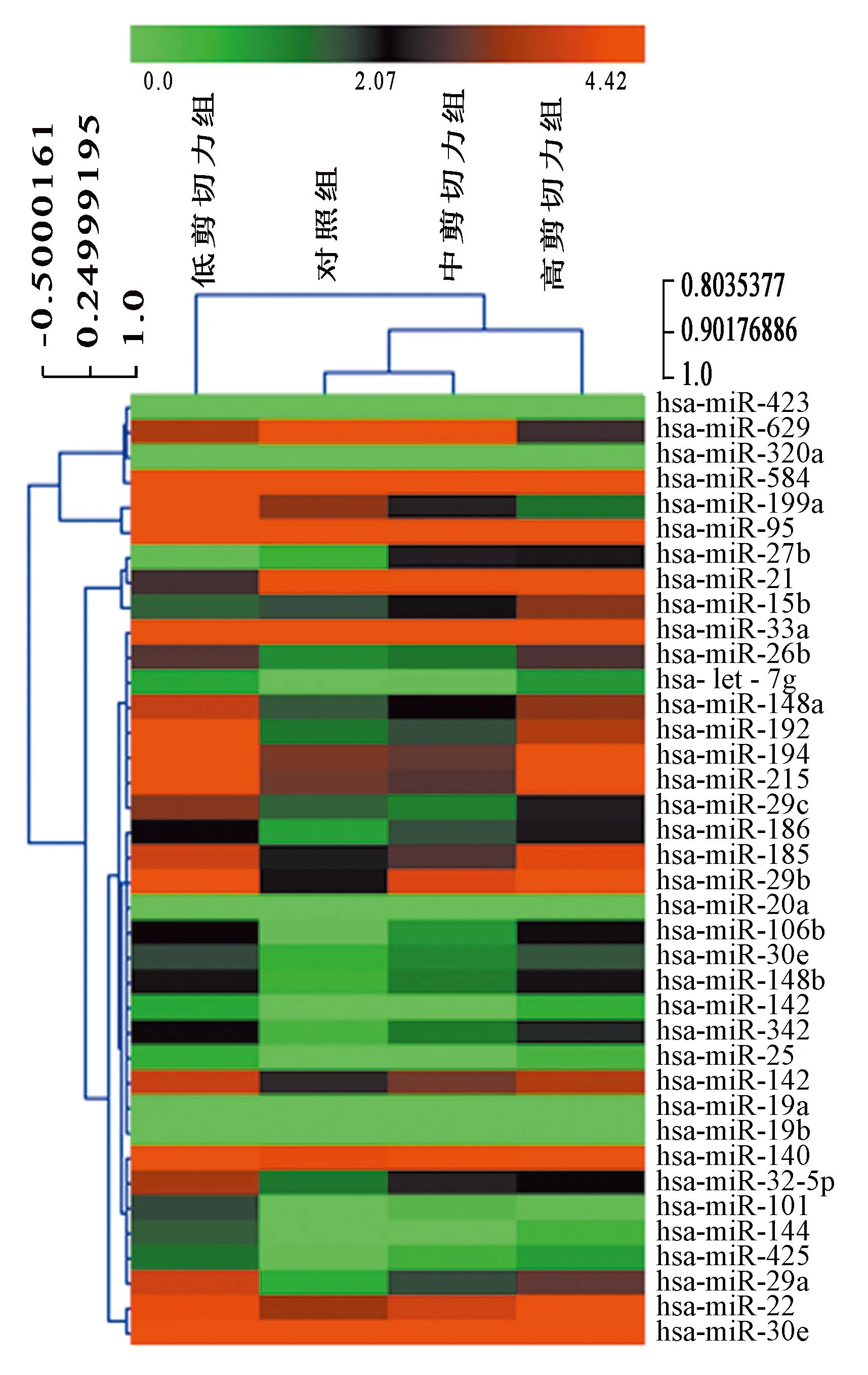
图1 不同剪切力作用后内皮细胞表达差异的 microRNAs聚类热图*Fig. 1 The heat map of differential expressed microRNAs in endothelial cells after effected by different shear stress
注:*彩图见电子版(http://swxxx.alljournals.cn/index.aspx)(2016年第1期)。
2.2qRT-PCR鉴定表达差异的microRNA
选取在低及高剪切力组表达差异最显著的miR-21和miR-199a进行qRT-PCR检测。以rRNA U6作为内参,对照组及低、中、高剪切力组miR-21表达分别为4.34、2.52、7.69和9.58,miR-199a表达分别为3.03、6.76、2.28和1.43。与对照组比较,低剪切力组miR-21显著下调,miR-199a显著上调(P< 0.05);高剪切力组miR-21显著上调,miR-199a显著下调(P< 0.05)。图2为miR-21和miR-199a扩增和融解曲线图,图3为miR-21及miR-199a qRT-PCR表达水平。
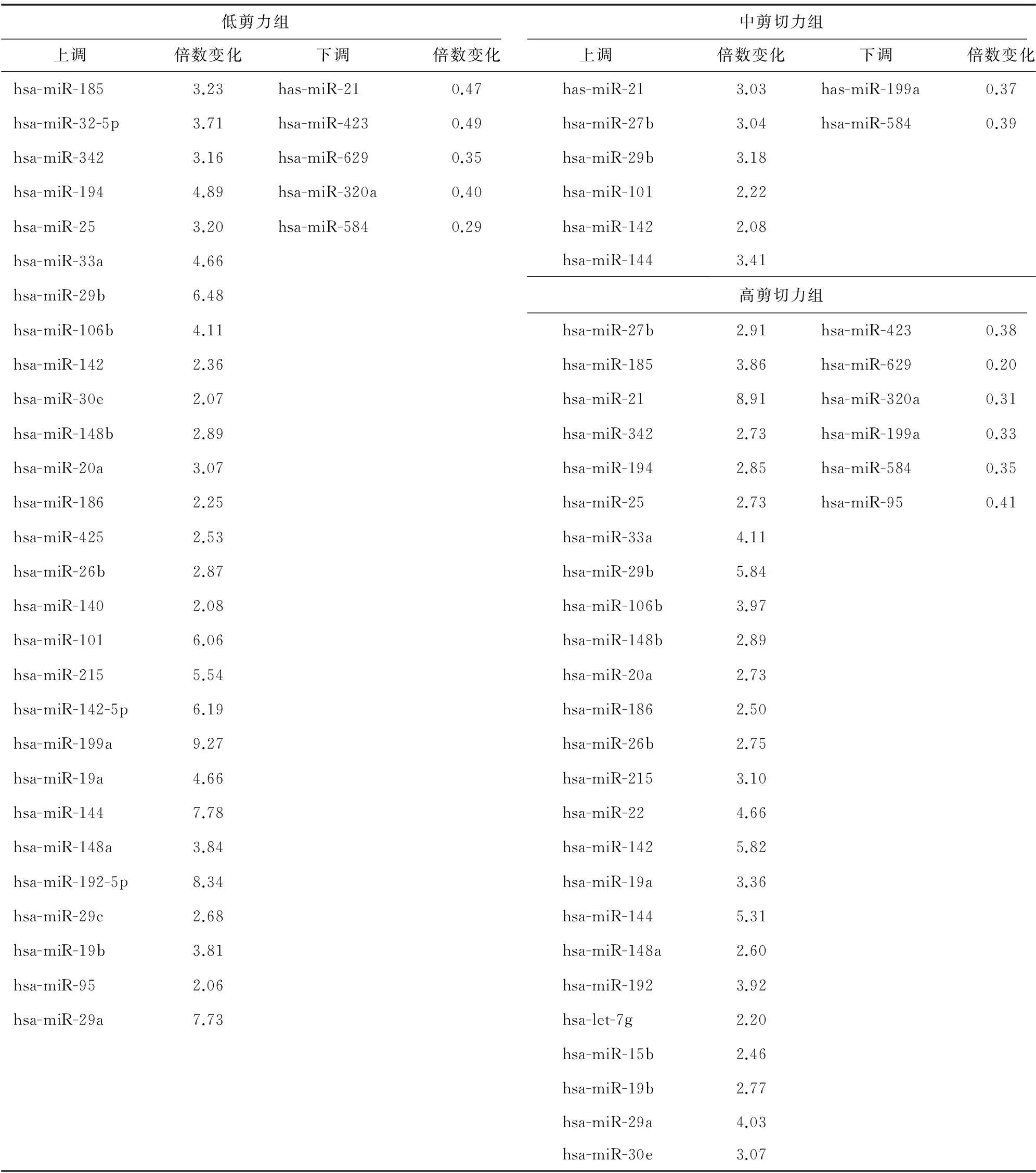
表2 3组内皮细胞表达差异microRNAs
2.3microRNAs靶基因的预测及富集
对在低及高剪切力组内皮细胞表达变化的39个microRNA的靶基因进行联合预测,结果显示,靶基因数目有396个。对预测的靶基因富集后,GO(Gene Ontology)功能分析表明,这些靶基因与免疫应答、细胞跨膜迁移、力学信号转导等相关。KEGG(Kyoto encyclopedia of genes and genomes)信号通路分析表明,这些信号通路主要与免疫应答(如:PI3K-Akt、细胞受体信号通路)、钙离子信号通路以及细胞内吞作用等相关。表3为has-miR-21和has-miR-199a GO基因功能分析主要结果,表4为has-miR-21和has-miR-199a KEGG信号通路分析主要结果。
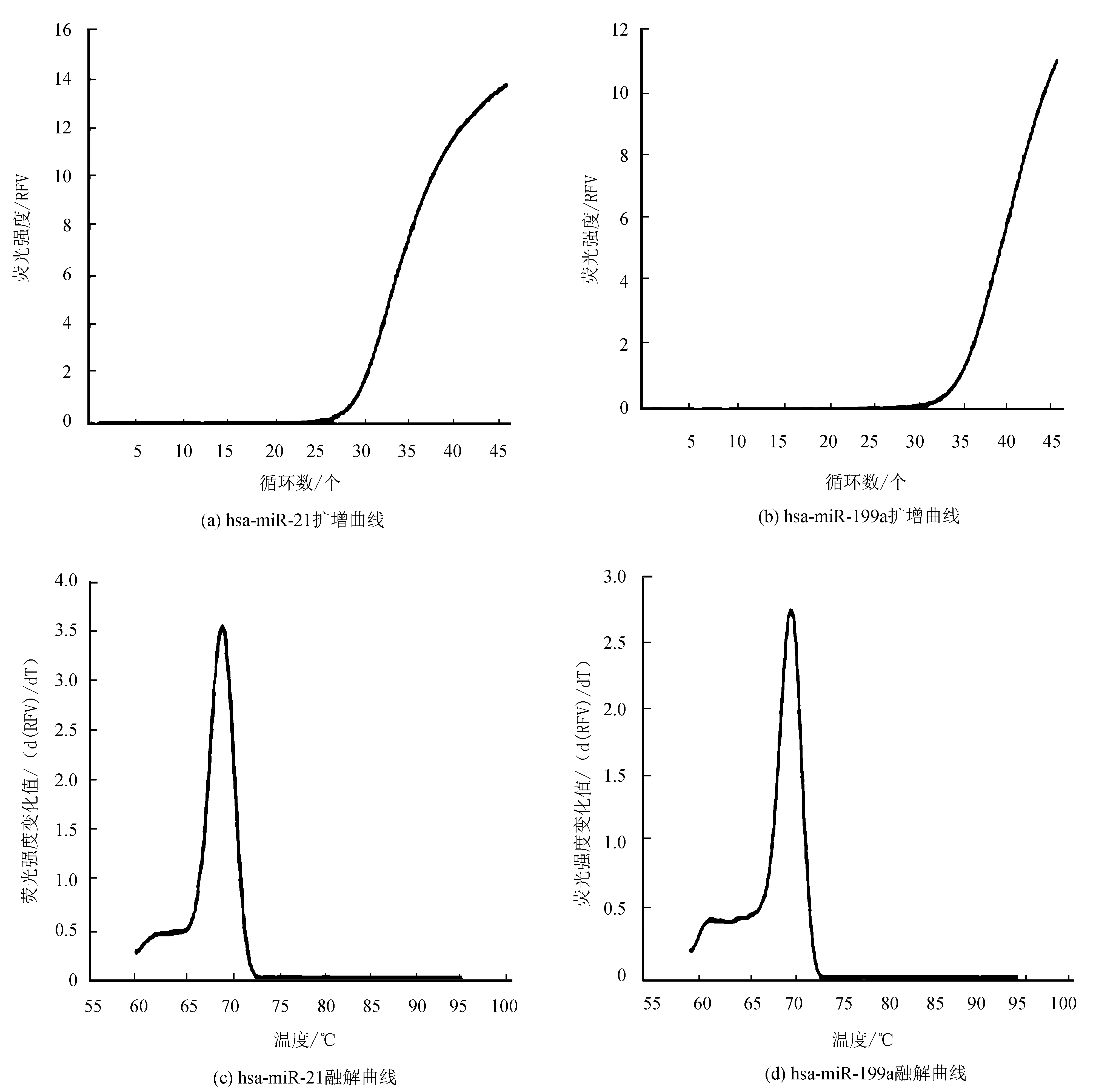
图2 miR-21和miR-199a qRT-PCR扩增和融解曲线图Fig. 2 qRT-PCR amplification and melting cures of miR-21 and miR-199a

图3 miR-21及miR-199a qRT-PCR表达水平Fig. 3 The expression of miR-21 and miR-199a using qRT-PCR
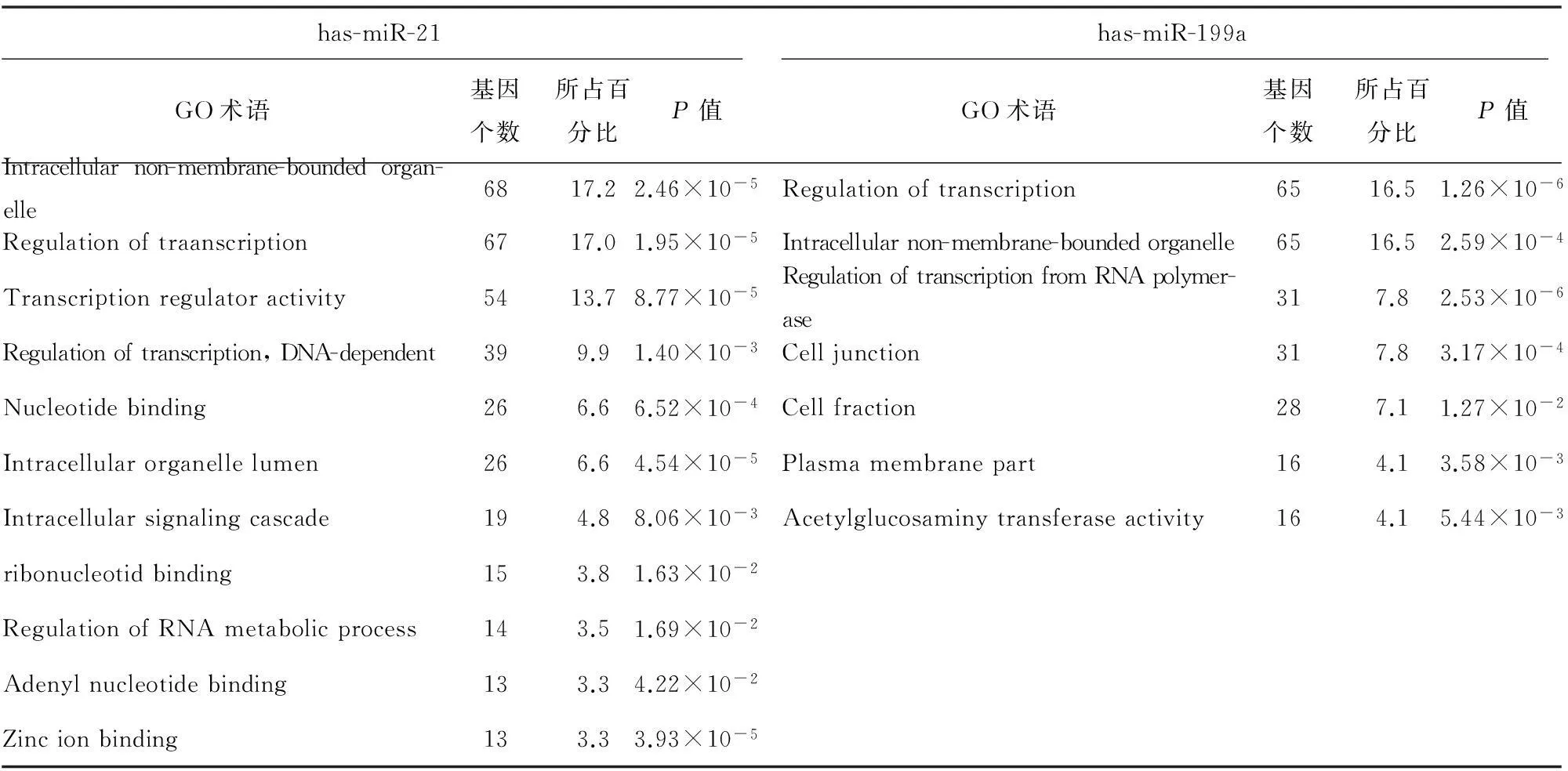
has-miR-21has-miR-199aGO术语基因个数所占百分比P值GO术语基因个数所占百分比P值Intracellularnon-membrane-boundedorgan-elle6817.22.46×10-5Regulationoftranscription6516.51.26×10-6Regulationoftraanscription6717.01.95×10-5Intracellularnon-membrane-boundedorganelle6516.52.59×10-4Transcriptionregulatoractivity5413.78.77×10-5RegulationoftranscriptionfromRNApolymer-ase317.82.53×10-6Regulationoftranscription,DNA-dependent399.91.40×10-3Celljunction317.83.17×10-4Nucleotidebinding266.66.52×10-4Cellfraction287.11.27×10-2Intracellularorganellelumen266.64.54×10-5Plasmamembranepart164.13.58×10-3Intracellularsignalingcascade194.88.06×10-3Acetylglucosaminytransferaseactivity164.15.44×10-3ribonucleotidbinding153.81.63×10-2RegulationofRNAmetabolicprocess143.51.69×10-2Adenylnucleotidebinding133.34.22×10-2Zincionbinding133.33.93×10-5
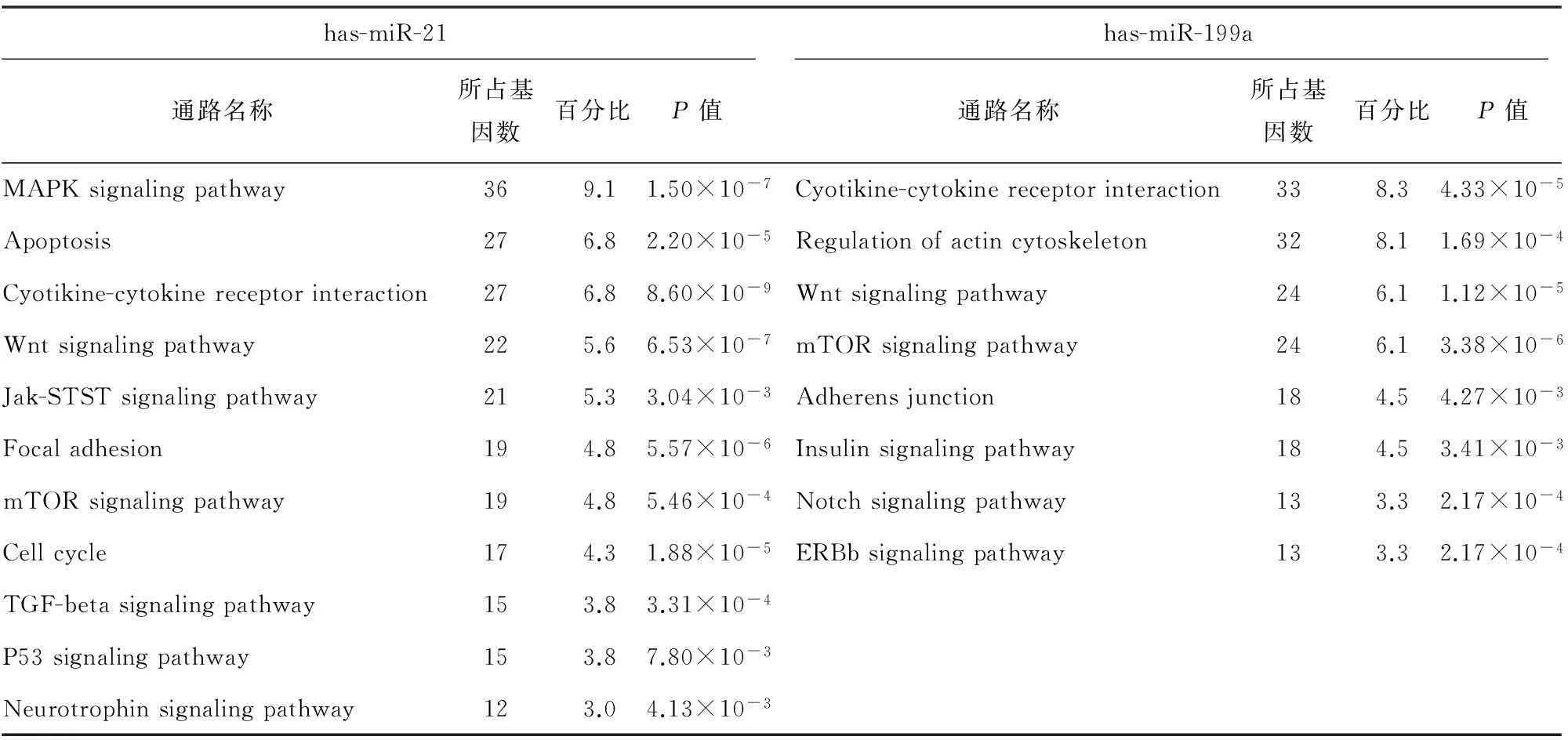
表4 has-miR-21和has-miR-199a KEGG信号通路分析主要结果
3讨论
研究表明[5-6],microRNA在机械生物力调节血管细胞生物学效应中发挥着重要的作用。体外培养的血管内皮细胞在不同剪切力作用下,其microRNAs表达水平具有显著差异,而这些microRNAs在调控内皮细胞的生长周期和凋亡以及调节炎症反应中发挥重要作用[5-6]。
He等[10]研究发现,在层流剪切力作用下,阻断PI3K信号通路可使miR-19a表达下调,阻断MAPK信号通路可下调miR-23b和27b表达。本研究显示,内皮细胞在低剪切力作用后,有28个microRNA表达上调,5个microRNA表达下调;而在高剪切力作用后,有25个microRNA表达上调,6个microRNA表达下调。选取表达差异显著的miR-21和miR-199a采用qRT-PCR技术验证,结果也显示,低剪切力组miR-21表达显著下调,miR-199a表达显著上调;而高剪切力组miR-21表达显著上调,miR-199a表达显著下调。这表明细胞外的流体剪切力可诱导内皮细胞的microRNAs表达发生改变。
microRNAs表达改变又可导致内皮细胞功能发生变化。Wu等[11]研究发现,miR-92a在剪切力诱导内皮细胞一氧化氮释放增加,改变内皮细胞功能过程中发挥重要作用。miR143/145则在剪切力诱导内皮细胞降低血管紧张素转换酶表达中发挥重要的调控作用[12]。研究还表明[13],剪切力还可通过microRNA诱导血管内皮细胞的分化,保持不同剪切力作用下内皮细胞的稳态。本研究采用IncroMAP对表达差异的microRNAs靶基因进行富集分析也发现,这些靶基因与力学信号转导、细胞跨膜迁移、钙离子信号通路、细胞内吞作用以及免疫应答等相关。表明血流剪切可通过microRNA诱导内皮细胞功能发生改变。
本研究结果与其他研究者的结果基本一致。结果存在差异的原因可能是对内皮细胞施加的剪切力程度、作用时间不同,而这些条件的不同可能导致microRNA表达发生变化,从而导致表达差异的microRNA以及靶基因富集分析结果不同。
综上所述,流体剪切力可诱导内皮细胞的microRNAs表达谱发生改变,而表达差异的microRNAs在剪切力作用下通过其靶基因诱导内皮细胞功能发生改变,这对深入了解剪切力诱导血管内皮依赖性舒缩功能改变,阐明动脉粥样硬化发生发展机制具有重要意义。
参考文献
[1]CHAI Q, WANG X L, ZELDIN D C, et al. Role of caveolae in shear stress-mediated endothelium-dependent dilation in coronary arteries[J].Cardiovascular Research, 2013,100(1):151-159.
[2]CHAI Q, LU T, WANG X L, et al. Hydrogen sulfide impairs shear stress-induced vasodilation in mouse coronary arteries[J]. Pflügers Archiv-European Journal of Physiology,2015,467(2):329-340.
[3]XU Y P, QI R Q, CHEN W, et al. Aging affects epidermal Langerhans cell development and function and alters their miRNA gene expression profile[J]. Aging,2012,4(11):742-754.
[4]NETH P, NAZARI-JAHANTIGH M, SCHOBER A, et al. MicroRNAs in flow-dependent vascular remodelling[J]. Cardiovascular Research, 2013,99(2):294-303.
[5]ALEXY T, JAMES A M, SEARIES C D.Shear sensitive microRNAs and atherosclerosis[J].Biorheology, 2014,51(2):147-158.
[6]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△C(T)Method[J].Method,2001,25(4):402-408.
[7]邹阮敏,胡芝,陈昊,等. miR-199a在宫颈癌及宫颈上皮内瘤样病变中的表达及意义[J]. 医学研究杂志, 2011,40(7):55-59.
ZOU Ruanmin, HU Zhi, CHEN Hao, et al.Clinical significance of miR-199a expression in cervical cancer and cervical intraepithelial neoplasia[J].Journal of Medical Research, 2011,40(7)55-59.
[8]WRZODEK C, EICHNER J, BUCHEL F, et al. IncroMap: integrated analysis of cross-platform MicroArray and Pathway data[J].Bioinformatics, 2013,29(4):506-508.
[9]HE J,LI Y,YANG X,et al.The feedback regulation of PI3K-miR-19a,and MAPK-miR-23b/27b in endothelial cells under shear stress[J].Molecules,2012,18(1):1-13.
[10]WU W, XIAO H, LAGUNA-FERNANDEZ A, et al. Flow-dependent regulation of Kruppel-Like factor 2 is mediated by microRNA-92a[J]. Circulation,2011,124(5):633-641.
[11]KOHLSTEDT K,TROUVAIN C,BOETTGER T,et al. AMP-activated protein kinaes regulates endothelial cell angiotensin-converting enzyme expression via p53 and the post-transcriptional regulation of microRNA-143/145[J].Circle Research,2013,112(8):1150-1158.
[12]CHEN K,FAN W,WANG X,et al. MicroRNA-101 mediates the suppressive effect of laminar shear stress on mTOR expression in vascular endothelial cells[J].Biochemical and Biophysical Research Communications,2012,427(1):138-142.
Effect of fluid shear stress on expression of miR-21 and miR-199a in endothelial cells
ZHANG Yan1,2,3, WANG Yucai3, LIU Zhendong1*, ZHAO Yingxin1,ZHANG Hua1
(1.InstituteofBasicMedicine,ShandongAcademyofMedicalSciences,Jinan250062,China;2.SchoolofMedicineandLifeSciences,UniversityofJinan&ShandongAcademyofMedicalSciences,Jinan250022,China;3.People’sHospitalofQihe,QiheShandong251100,China)
Abstract:To evaluate the effect of fluid shear stress on expression of microRNAs in endothelial cells.Low (4 dyn/cm2), middle (10 dyn/cm2), and high (15 dyn/cm2) fluid shear stress were loaded onto endothelial cells for 24 h using rotating cone disc shear stress system, respectively. No shear stress was loaded onto endothelial cells in control group. Changes of microRNAs expression were assessed using high throughput screening chip. The results were verified using quantitative real-time polymerase chain reaction (qRT-PCR). Bioinformatics analysis was performed in difference-expressed microRNAs.Compared to control group, there were 33 differentially expressed microRNAs in low shear stress group. Among them, 28 microRNAs expression were up-regulated and 5 microRNAs expression were down-regulated. In middle shear stress group, there were 8 differentially expressed microRNAs compared to control group. Among them, 6 microRNAs expression were up-regulated and 2 microRNAs expression were down-regulated. In high shear stress group, there were 31 microRNAs expression changed compared to control group. Among them, 25 microRNAs expression were up-regulated and 6 microRNAs expression were down-regulated.MiR-21 was markedly up-regulated in high shear stress group (fold change: 0.026) and significantly down-regulated in low shear stress group (fold change:3.531). MiR-199a was markedly up-regulated in low shear stress group (fold change: 0.075) and significantly down-regulated in high shear stress group (fold change:3.031). The results of bioinformatics analysis showed that target genes of differentially expressed microRNAs related to mechanical signal transduction, cell trans membrane transport, calcium ion signaling pathway, and endocytosis of cells.The change of the expressions of miR-21 and miR-199a were induced by fluid shear stress in endothelial cells.
Keywords:Shear stress; Endothelial cell; MicroRNA; Expression
中图分类号:Q344+.13
文献标志码:A
文章编号:1672-5565(2016)01-019-07
doi:10.3969/j.issn.1672-5565.2016.01.04
作者简介:张燕 ,女, 主治医师,硕士研究生,研究方向:动脉粥样硬化机制;E-mail:dzqhzhy@163.com.*通信作者:刘振东,男,博士,研究方向: 动脉粥样硬化机制; E-mail:zhendongliu876@126.com.
基金项目:国家自然科学基金项目(81470489);山东省自然科学基金项目(ZR2014HM098,);山东省医药卫生科技发展计划项目(2014WS0312,2014WS0316)。
收稿日期:2015-10-26;修回日期:2016-12-18.

