氮掺杂碳点的制备及在六价铬检测中的应用
曾 强,朱浩波,朱红艳,朱小利,戴昌雄,邓 淳,何 瑜,张修华,宋功武
(1.武汉红金龙印务股份有限公司,湖北 武汉 430056;2.湖北大学化学化工学院,湖北 武汉 430062)
氮掺杂碳点的制备及在六价铬检测中的应用
曾强1,朱浩波1,朱红艳1,朱小利1,戴昌雄1,邓淳2,何瑜2,张修华2,宋功武2
(1.武汉红金龙印务股份有限公司,湖北 武汉 430056;2.湖北大学化学化工学院,湖北 武汉 430062)
摘要:以破壁灵芝孢子粉为碳源、尿素为含氮掺杂剂,采用一步超声法制备了氮掺杂荧光碳点(N-CDs),并将其作为荧光探针检测Cr(6+)。向碳点溶液中加入Cr(6+)后,碳点荧光发生了猝灭,表明碳点与Cr(6+)发生了作用,并在Cr(6+)浓度为0~300 μmol·L(-1)范围内荧光强度变化值与Cr(6+)浓度表现出良好线性关系,相关系数为0.9818,检出限为0.3 μmol·L(-1)。在实际样品检测中,回收率较好,为94%~102%,说明所制N-CDs可用于Cr(6+)的检测,具有较高的实用价值。
关键词:Cr(6+);灵芝孢子粉;荧光碳点;氮掺杂;荧光检测
铬是一种重要的金属元素,广泛应用于电镀、制革、染料及冶金工业中[1]。在环境中主要以Cr3+和Cr6+两种形式存在[2]。铬的毒性与其所处化学价态有关[3],Cr3+为人体所需微量元素[4],主要功能为促进人体糖类[5]、蛋白质[6]和脂类的新陈代谢及人体生长发育[7-8],而Cr6+对人体有毒,易穿透细胞并在细胞内沉积,其强氧化性可引起肾脏、肝脏、神经系统和血液的广泛病变[9]。因此,对Cr6+的检测显得十分必要。
荧光碳点(fluorescentcarbondots,CDs)[10]是继量子点之后又一种新型的荧光纳米材料,具有良好的发光性能与小尺寸特性,而且还具有很低的生物毒性和良好的生物相容性[11],克服了传统荧光染料的缺点,在细胞成像[12]、标记[13]及检测[14]等领域具有广阔的应用前景,有望代替量子点成为最具应用前景的环保型荧光纳米材料。
作者以破壁灵芝孢子粉为碳源、尿素为含氮掺杂剂,采用一步超声法制备氮掺杂荧光碳点(N-CDs),并将其作为荧光探针检测环境水样中Cr6+。
1实验
1.1试剂与仪器
灵芝孢子粉;尿素,分析纯,国药集团化学试剂有限公司;二次去离子水。
LS55型荧光分光光度计、Spectrumone型傅立叶变换红外分光光度计、Lambda35型紫外分光光度计,美国Perkin-Elmer公司;TecnaiG20型透射电子显微镜,美国FEI公司;DTC-8型超声波清洗机,鼎泰(湖北)生化科技设备制造有限公司。
1.2方法
1.2.1N-CDs的制备及表征
准确称取1 g破壁灵芝孢子粉溶于100 mL去离子水,向其中加入1 g尿素,搅拌均匀,超声反应4 h。反应结束后冷却至室温,离心抽滤,得到淡黄色上清液即为N-CDs溶液,将其稀释100倍,4 ℃储存,备用。
通过荧光光谱、TEM、FTIR、UV-Vis对制备的N-CDs进行表征。
1.2.2N-CDs的稳定性
N-CDs在应用中会受到环境酸碱度及离子强度的影响,测定N-CDs溶液在pH值2~12、KCl溶液浓度在0~100 mmol·L-1范围内的440 nm处的荧光强度,考察酸碱度和离子强度对N-CDs荧光性质的影响。
1.2.3N-CDs对Cr6+的检测
配制一系列不同浓度(0~300 μmol·L-1)的铬酸钾溶液,与N-CDs溶液混合。在900 V电压、激发与发射狭缝分别为15 nm和20 nm的条件下,固定激发波长325 nm,测定体系荧光强度,得到荧光猝灭谱图。
2结果与讨论
2.1N-CDs的表征(图1)
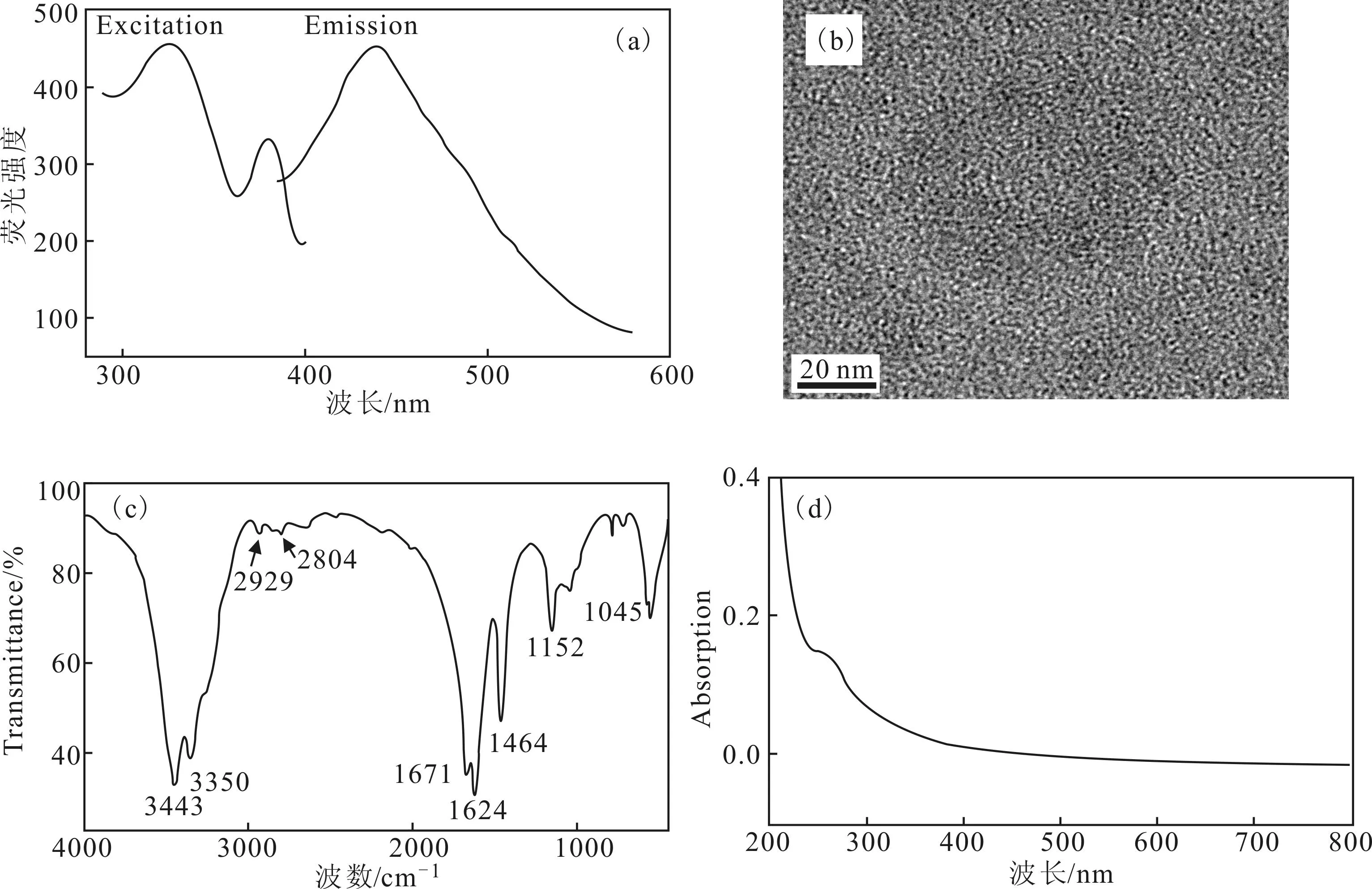
图1 N-CDs的荧光激发光谱和发射光谱(a)、透射电镜照片(b)、红外光谱(c)、紫外光谱(d)
由图1a可知,制备的N-CDs具有良好的荧光特性,激发峰和发射峰分别在325 nm和440 nm处,表明N-CDs可以用于荧光方面的应用。由图1b可知,制备的N-CDs粒度均一,分散性好,粒径为2 nm左右,符合碳点基本特性。由图1c可知,3 443 cm-1、3 350 cm-1为氨基伸缩振动峰,1 671 cm-1为氨基弯曲振动峰,表明成功掺杂了氮。由图1d可知,N-CDs在250 nm处具有紫外吸收。
2.2N-CDs的稳定性(图2)
由图2a可知,在pH值为2~12时,N-CDs的荧光强度变化不大,表明N-CDs具有良好的pH值稳定性。由图2b可知,在不同浓度KCl溶液中,N-CDs在440 nm处的荧光强度与未加KCl的荧光强度几乎一致,表明制备的N-CDs在较高离子强度溶液中具有良好的稳定性。
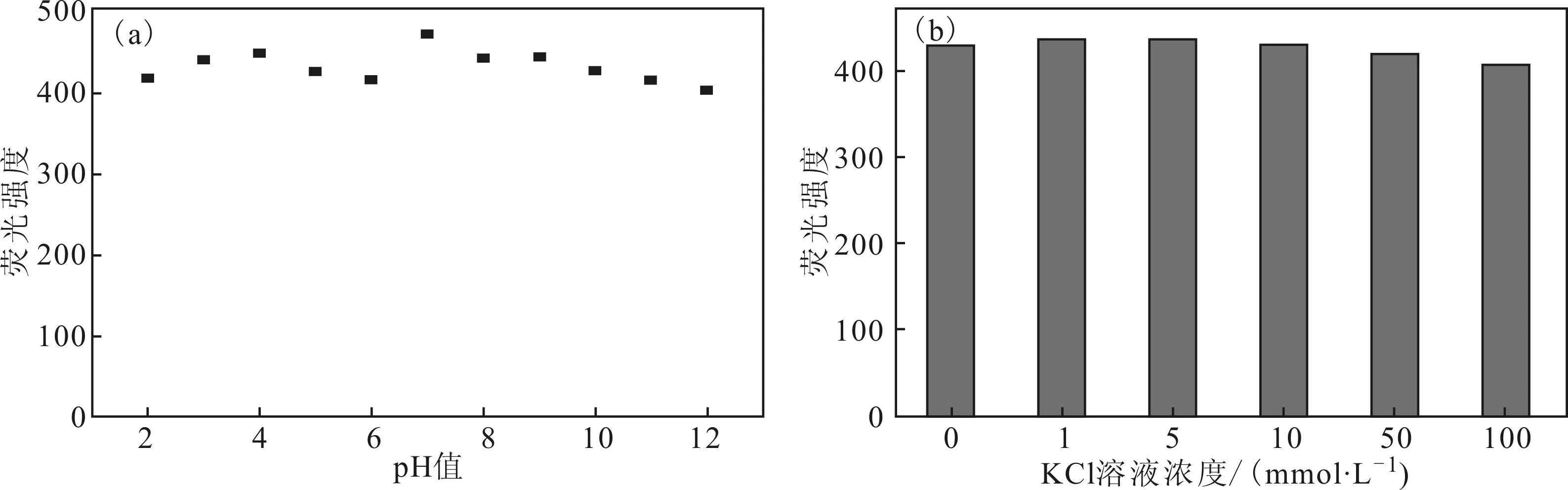
图2N-CDs在不同pH值(a)和离子强度(b)下的荧光强度
Fig.2The fluorescence intensity of N-CDs at different pH values(a) and ionic strengths(b)
2.3N-CDs检测Cr6+的可行性
为探究所制备的N-CDs检测溶液中Cr6+的可行性,测定了加Cr6+前后N-CDs的荧光发射光谱,见图3。
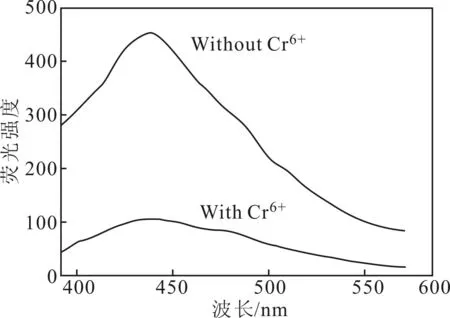
图3 加Cr6+前后N-CDs的荧光发射光谱
由图3可知,加Cr6+后N-CDs溶液在440 nm处荧光强度极大降低,发生了猝灭,表明制备的N-CDs具有检测Cr6+的可行性。
环境酸碱度不仅可能影响N-CDs荧光强度,也可能会影响N-CDs在检测中对目标物的荧光响应性,测试150 μmol·L-1Cr6+在不同pH值环境中对N-CDs荧光强度猝灭百分比,结果见图4。
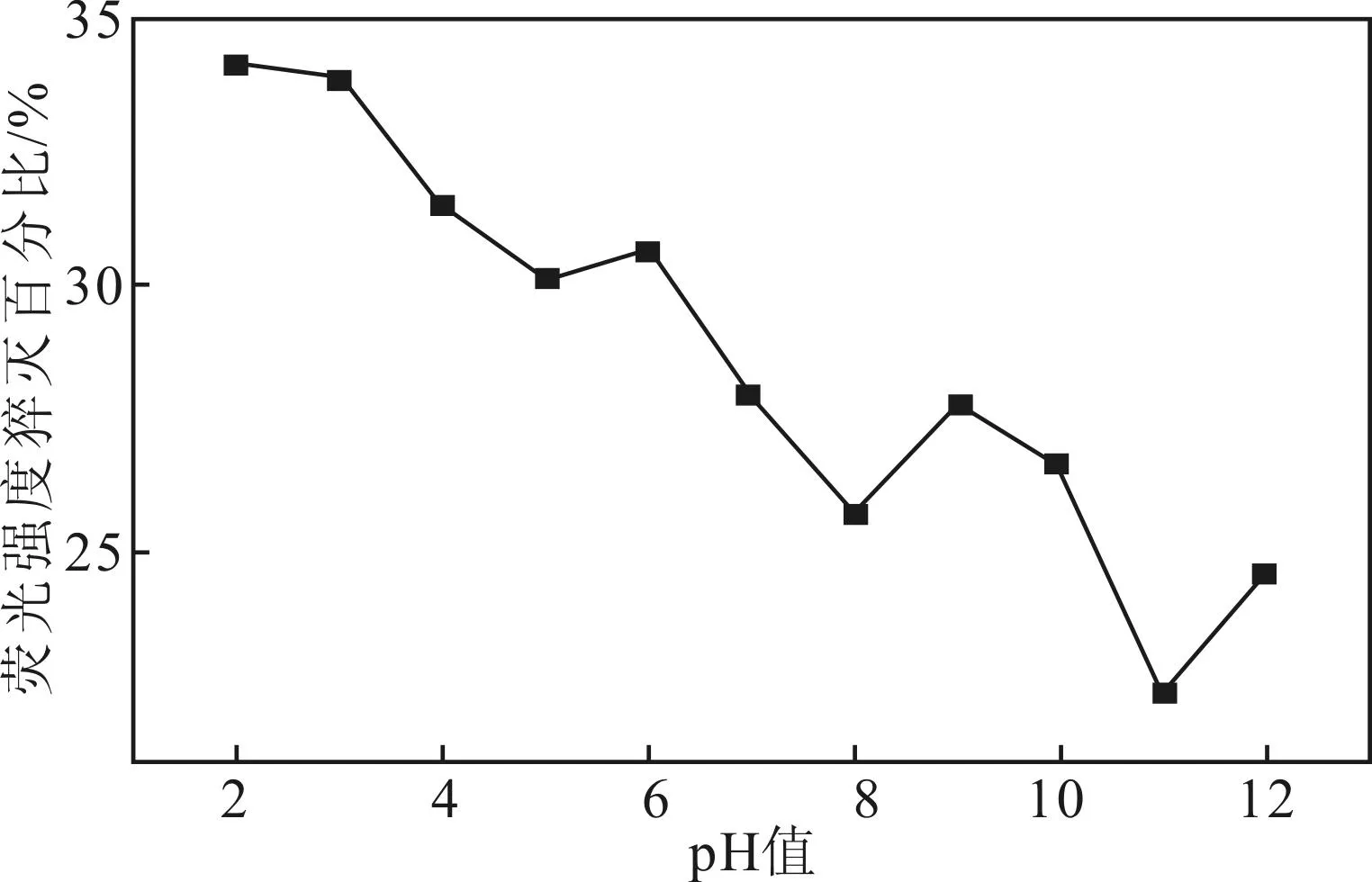
图4 不同pH值下Cr6+对N-CDs荧光强度猝灭百分比
由图4可知,在pH值为2和3的条件下,Cr6+对N-CDs荧光强度猝灭百分比最大,响应最灵敏,故选取溶液pH值为3作为最佳检测条件。
在pH值为3的条件下,考察不同浓度Cr6+对N-CDs荧光强度的影响,结果见图5。
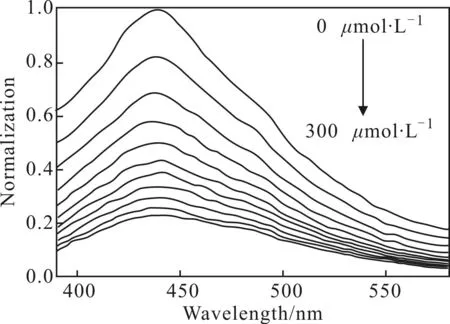
图5 不同浓度Cr6+对N-CDs荧光强度的影响
由图5可知,N-CDs荧光强度随着Cr6+浓度的增大而逐渐减弱,说明Cr6+与N-CDs发生了相互作用,并且猝灭十分明显,表明N-CDs可以应用于Cr6+检测。
为验证N-CDs对Cr6+检测的灵敏度,测定440 nm处N-CDs溶液加Cr6+前后的荧光强度(F0、F),由F0/F对Cr6+浓度作图(图6),得到检测Cr6+的工作曲线,线性拟合方程为F0/F=0.732+0.011cCr6+,相关系数R2=0.9818。Cr6+浓度线性范围为0~300 μmol·L-1,检出限为0.3 μmol·L-1,表明该检测方法可行,并且检测灵敏。
2.4离子选择识别性
N-CDs在检测Cr6+过程中,可能会受到环境中各种金属离子的干扰,对N-CDs检测Cr6+的灵敏度进行了选择识别性测试实验。在pH值为3、Cr6+浓度为200 μmol·L-1的条件下,测试了环境中的其它12种浓度为1 mmol·L-1的金属离子(Ni2+、Mn2+、Co2+、Fe2+、Fe3+、Ag+、Mg2+、Zn2+、Cd2+、Cu2+、Hg2+、Cr3+)对N-CDs荧光强度猝灭百分比,结果见图7。
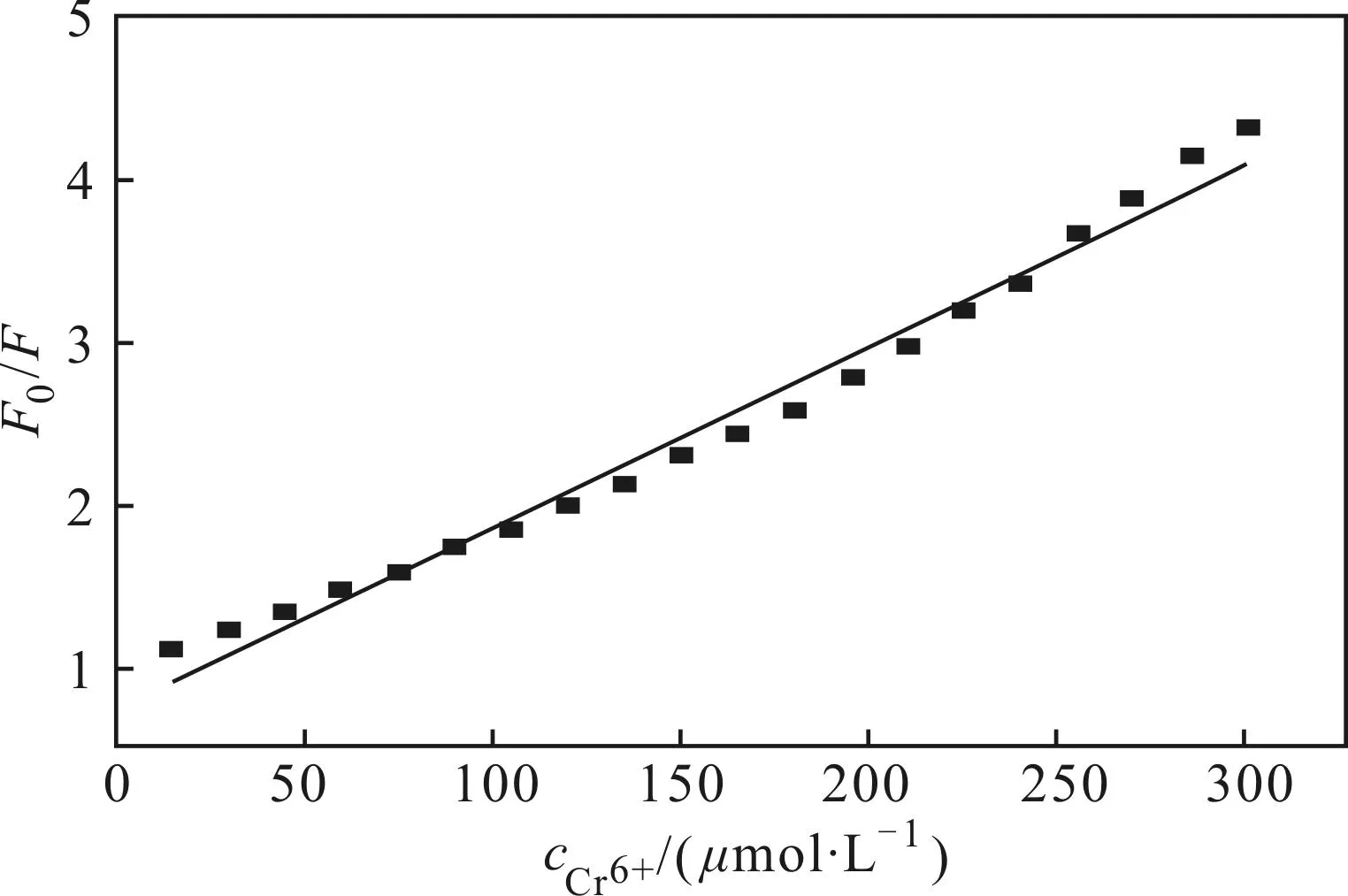
图6 440 nm处荧光强度与Cr6+浓度关系
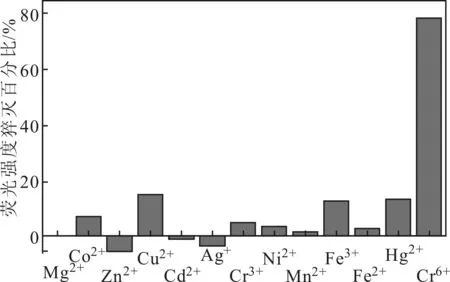
图7 N-CDs对Cr6+选择识别性
由图7可知,12种金属离子对N-CDs荧光响应较小,表明N-CDs对Cr6+的选择识别性较好。
2.5实际样品检测
分别对长江水、东湖水、沙湖水进行简单过滤后,进行加标回收测试,N-CDs对3种未稀释实际水样中的Cr6+加标回收检测结果见表1。
表1
实际样品检测结果(n=3)
Tab.1The detection results of real samples(n=3)

样品加入量μmol·L-1测得值μmol·L-1回收率/%长江水6058.64±0.3598±0.59东湖水6059.28±1.6099±2.67沙湖水6056.85±0.4595±0.75
由表1可知,N-CDs在实际样品检测中的结果达到期望值,回收率均在94%~102%之间,适合微量分析,说明制备的N-CDs在Cr6+检测中具有较高的实用价值。
2.6N-CDs荧光检测Cr6+的机理
荧光猝灭机理通常分为2种:动态猝灭和静态猝灭。动态猝灭机理一般用Stern-Volmer方程(式1)描述;静态猝灭机理则用Lineweaver-Burk方程(式2)解释。
F0/F=1+KSVcq
(1)
1/(F0-F)=1/F0+KLB/(F0cq)
(2)
式中:F、F0分别是猝灭剂存在与不存在下体系的荧光强度;KSV为动态猝灭常数(即Stern-Volmer猝灭常数),KLB为静态猝灭常数(即Lineweaver-Burk猝灭常数);cq为猝灭剂浓度。
以不同浓度猝灭剂存在下的荧光强度F0/F对猝灭剂浓度作图,得到线性方程F0/F=0.732+0.011cCr6+,线性相关系数为0.9818,表明Cr6+猝灭N-CDs遵循Stern-Volmer方程,属于动态猝灭,说明荧光猝灭可能是Cr6+与激发态的N-CDs发生相互碰撞而导致的。
为了进一步讨论Cr6+的检测机理,考察了加Cr6+前后N-CDs的紫外光谱,见图8。
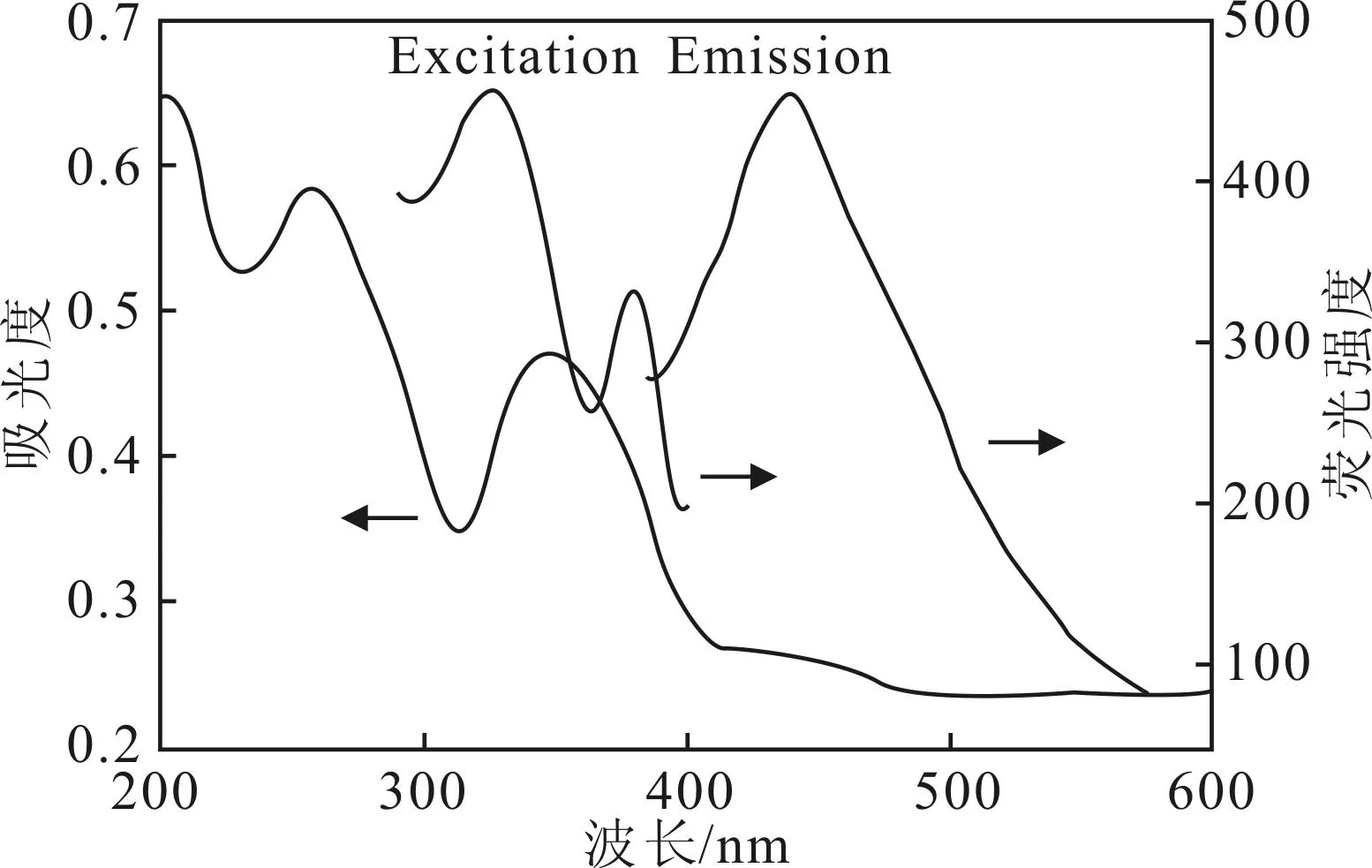
图8 N-CDs的荧光猝灭机理
由图8可知,Cr6+在350 nm处的紫外吸收峰与N-CDs在325 nm处的荧光激发峰部分重合,在440 nm处的紫外吸收峰与N-CDs在440 nm处的荧光发射峰重合,说明在检测过程中,Cr6+不仅能吸收N-CDs的激发能量也能吸收N-CDs的发射能量,即检测过程中存在能量传递行为[15]。
3结论
以破壁灵芝孢子粉为碳源、尿素为含氮掺杂剂,采用一步超声法制备了N-CDs。所制备的N-CDs粒径为2 nm左右,粒度均一,荧光性质稳定,对Cr6+选择识别性好,可以作为Cr6+荧光探针。在Cr6+浓度为0~300 μmol·L-1范围内N-CDs荧光强度变化值与Cr6+浓度表现出良好线性关系,相关系数为0.9818,检出限为0.3 μmol·L-1。N-CDs对Cr6+的检测灵敏度较高,并且在实际样品检测中得到预期结果,表明制备的N-CDs可以较好地应用于实际样品检测,具有较高的实用价值。该方法简单快速,测定条件温和,极具推广价值。
参考文献:
[1]AJMAL M,RAO R A K,AHMAD R,et al.Removal and recovery of heavy metals from electroplating wastewater by using kyanite as an adsorbent[J].Journal of Hazardous Materials,2001,87(1-3):127-137.
[2]DORSA M,PEREIRA M C,BARTOLOEE V,et al.Toxic effects and specific chromium acquired resistance in selected strains ofDyctiosphaeriumchlorelloides[J].Chemosphere,2010,81(2):282-287.
[3]KOCBERBER N,DONMEZ G.Chromium(Ⅵ) bioaccumulation capacities of adapted mixed cultures isolated from industrial saline wastewater[J].Bioresour Technol,2007,98(11):2178-2183.
[4]SANG D K,KYEONG S P,MAN B G.Toxicity of hexavalent chromiumDaphniamagnainfluence of reduction reaction by ferrous iron[J].Journal of Hazardous Materials,2002,93(2):155-164.
[5]邓莉.葡萄糖耐量因子在治疗糖尿病中的应用[J].中国农村医学,1997,(9):29-32.
[6]王永芳.铬与健康研究进展[J].中国食品卫生杂志,2001,13(1):46-48.
[7]WANG Y S,PAN Z Y,LANG J M,et al.Bioleaching of chromium from tannery sludge by indigenousAcidithiobacillusthiooxidans[J].Journal of Hazardous Materials,2007,147(S1-2):319-324.
[8]RAI V,VAJPAYEE P,SINGH S N,et al.Effect of chromium accumulation on photosynthetic pigments,oxidative stress defense system,nitrate reduction,proline level and eugenol content ofOcimumtenuiflorumL.[J].Plant Science,2004,167(5):1159-1169.
[9]ARUN K S,CARLOS C,HERMINIA L T,et al.Chromium toxicity in plants[J].Environment International,2005,31:739-753.
[10]黄淮青,曾萍,韩宝福,等.荧光碳点的合成及对酿酒酵母的毒性研究[J].无机化学学报,2012,28(1):13-19.
[11]RAY S C,ARINDAM S,NIKHIL R,et al.Fluorescent carbon nanoparticles:Synthesis,characterization,and bioimaging application[J].J Phys Chem C,2009,113(43):18546-18551.
[12]NIU X,LIU G,LI L,et al.Green and economical synthesis of nitrogen-doped carbon dots from vegetables for sensing and imaging applications[J].RSC Advance,2015,5(115):95223-95229.
[13]LI Z,NI Y,KOKOT S.A new fluorescent nitrogen-doped carbon dot system modified by the fluorophore-labeled ssDNA for the analysis of 6-mercaptopurine and Hg(Ⅱ)[J].Biosensors & Bioelectronics,2015,74:91-97.
[14]LIU L,FENG F,PAAU M C,et al.Carbon dots isolated from chromatographic fractions for sensing applications[J].RSC Advances,2015,5(129):106838-106847.
[15]BARATI A,SHAMSIPUR M,ABDOLLAHI H.Hemoglobin detection using carbon dots as a fluorescence probe[J].Biosensors & Bioelectronics,2015,71:470-475.
Preparation of Nitrogen Doped Carbon Dots and Their Application as Fluorescence Probe for Cr6+Detection
ZENG Qiang1,ZHU Hao-bo1,ZHU Hong-yan1,ZHU Xiao-li1,DAI Chang-xiong1,DENG Chun2,HE Yu2,ZHANG Xiu-hua2,SONG Gong-wu2
(1.WuhanHongjinlongPrintingCo.,Ltd.,Wuhan430056,China;2.CollegeofChemistry&ChemicalEngineering,HubeiUniversity,Wuhan430062,China)
Abstract:In this paper,using the Ganoderma lucidum spores as a carbon source,urea as a nitrogen dopant,nitrogen doped fluorescent carbon dots(N-CDs) were prepared with one-step ultrasound method.The prepared N-CDs were used as a fluorescence probe for Cr(6+) detection.The fluorescence intensity of N-CDs quenched after adding Cr(6+).The fluorescence intensity showed a good linear relationship with the concentration of Cr(6+) range from 0 to 300 μmol·L(-1),the correlation coefficient was 0.9818 and the detection limit was 0.3 μmol·L(-1).The recoveries of real samples were 94%~102%,which indicated a good practical application of N-CDs.
Keywords:chromium(Ⅵ);Ganoderma lucidum spores;fluorescent carbon dots;nitrogen doped;fluorescence detection
中图分类号:O 613.71
文献标识码:A
文章编号:1672-5425(2016)03-0048-05
doi:10.3969/j.issn.1672-5425.2016.03.013
作者简介:曾强(1980-),男,湖北武汉人,工程师,研究方向:环境分析,E-mail:zengqiang@hjlprint.com。
收稿日期:2015-12-28
——以在线评价平台为例

