一株耐镉细菌的筛选、鉴定与性质研究
周 赓,邓成刚,曹林友,陈 帅,田 云,卢向阳
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.湖南农业大学东方科技学院,
湖南 长沙 410128;3.湖南省农业生物工程研究所,湖南 长沙 410128)
一株耐镉细菌的筛选、鉴定与性质研究
周赓1,3,邓成刚1,2,3,曹林友1,2,3,陈帅1,2,3,田云1,3,卢向阳1,3
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.湖南农业大学东方科技学院,
湖南 长沙 410128;3.湖南省农业生物工程研究所,湖南 长沙 410128)
摘要:从重金属镉污染土壤中分离筛选出一株耐镉能力为25 mmol·L(-1)的细菌,根据形态学观察、生理生化实验和分子鉴定,确定为鞘氨醇单胞菌属(Sphingomonas sp.),命名为CdTB02。该菌株的最佳生长条件为:NaCl浓度1%、装液量30 mL/250 mL、pH值6.0、温度35 ℃;而在含1 mmol·L(-1) Cd(2+)的环境中,最佳耐镉生长条件为:NaCl浓度1%、装液量30 mL/250 mL、pH值7.0、温度30 ℃。镉吸附实验结果显示,菌株CdTB02在最佳耐镉生长条件下对Cd(2+)的吸附率达到94%以上,表明菌株CdTB02对治理镉污染能发挥一定的作用。
关键词:镉污染;耐镉细菌;鞘氨醇单胞菌属;耐受性;吸附率
近年来,随着采矿、电镀、金属冶炼、化肥和农药等相关行业的不断发展,大量有毒重金属直接或间接地被释放进入环境,它们持续地对生态环境和人类健康造成巨大的影响和危害[1]。镉(Cd)是环境中一种常见的有毒重金属,对人类和动物的健康都能造成持续性的危害[2-3]。近年来,随着镉使用量的增加、镉污染土壤面积不断扩大以及镉污染的食品没有得到充分合理的处理,使得人们接触镉的风险日益增加[4]。因此,镉污染的治理成为急需解决的问题。
用于镉污染治理的常规方法包括:电化学处理法、离子交换法、化学沉淀法、反渗透和吸附法等,但是这些物理和化学方法都受到技术和成本的约束,而且处理过程中释放的化学物质和处理后的副产品容易对环境造成二次污染,因此,需要用效益更高和更环保的生物方法来处理镉污染[5]。人们开始不断探索更多的生物修复方法[6-7]。其中细菌、真菌和藻类等微生物由于具有比表面积大、繁殖迅速、代谢能力旺盛、种类多、适应性强、易扩大培养且生产成本低等优势,其在镉污染治理中的独特地位逐渐受到人们的重视[8-10]。
目前,耐镉微生物的筛选越来越受到专家学者的关注。大量的耐镉和具有镉吸附作用的微生物通过传统的分离筛选手段被发现,这些微生物主要属于Pseudomonassp.、Cupriavidus metallidurans、Bacillus cereus和Enterococcus faecalis等[11-13]。Zhang等[3]筛选得到了33株具有抗镉毒性的乳酸菌,其中Lactobacillus plantarumCCFM8610耐镉能力最强,能达到1 000mg·L-1,对镉离子的吸附率达到31.34%。Limcharoensuk等[14]从锌矿山土壤中分离筛选得到Pseudomonas aeruginosaB237,对镉离子有明显的吸附能力,其对Cd2+最大吸附能力为16.89mg·g-1。Surasak等[15]同样从锌矿区的土样中筛选得到24株耐镉细菌,其平均耐受CdCl2能力达到2.5mmol·L-1。
鞘氨醇单胞菌(Sphingomonassp.)对芳香化合物的代谢能力极强[16],并且该菌属某些菌种能够合成有价值的胞外生物高聚物。所以该菌株通常作为降解有机污染物的一类环保细菌被学者们所认识[17]。但是关于其耐镉特性方面的研究报道较少。
作者从湘西镉污染的土壤中筛选了一株耐镉细菌CdTB02,对其进行了鉴定和生长条件的优化,并对其在镉环境中的生长情况以及该菌株对Cd2+的吸附能力进行研究,拟为该菌株在生物修复镉污染环境中的应用提供理论依据。
1实验
1.1土壤样品采集
采样点:湖南省湘西凤凰县、古丈县、泸溪县3个重金属镉污染地区。
采样方法:各采样点取5~10cm表层重金属镉污染土样,将其混合均匀后备用。
1.2培养基
分离培养基:蛋白胨10g,NaCl10g,酵母膏10g,琼脂12g,调节pH值为7,加浓度为1mol·L-1的CdCl2溶液10mL,定容至1 000mL,121 ℃下灭菌20min,倒平板。
筛选培养基:配制Cd2+浓度分别为10mmol·L-1、15mmol·L-1、20mmol·L-1、25mmol·L-1、30mmol·L-1的分离培养基。
1.3耐镉细菌的分离
取10g镉污染混合土样置于500mL三角瓶中,加入100mL去离子水和20颗小玻璃珠,置于200r·min-1、30 ℃振荡培养箱中处理1h,静置10min,取上层悬液稀释至10-4、10-5、10-6数量级,吸取稀释液涂布在含Cd2+浓度为10mmol·L-1的平板上,置于28 ℃恒温振荡培养箱中培养,观察结果。
1.4耐镉细菌的筛选
挑取平板上的单菌落,分别在Cd2+浓度为10mmol·L-1、15mmol·L-1、20mmol·L-1、25mmol·L-1、30mmol·L-1的平板上划线,置于28 ℃恒温振荡培养箱中培养。重复上述操作得到镉耐受能力最强的细菌。
1.5耐镉细菌的鉴定
1.5.1形态及生理生化鉴定
参考《伯杰氏细菌鉴定手册》[18]、《微生物学实验教程》[19]、《污染土壤生物修复理论基础与技术》[20]以及《常见细菌系统鉴定手册》[21]等对耐镉细菌进行鉴定。
1.5.216S rDNA序列分析
采用磁珠法基因组DNA抽提试剂盒(上海生工生物工程股份有限公司)提取细菌CdTB02的总基因组DNA,扩增细菌CdTB02的16S rDNA,设计引物为:27F:AGAGTTTGATCMTGGCTCAG;1492R:GGCTACCTTGTTACGACTT。PCR反应体系为:5 μL的10×buffer,0.25 μL的Ex Taq DNAase,4 μL的 dNTP,2 μL的引物,2 μL的模板,总反应体系为50 μL。PCR条件为:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸2 min,共32个循环;72 ℃延伸10 min。回收PCR扩增产物,将其连接到pMD18-T vector上,经阳性鉴定后送华大基因公司进行测序。
1.6生长条件对菌株CdTB02生长和耐镉的影响
分别测试菌株CdTB02在250 mL三角瓶中不同装液量(10 mL、30 mL、50 mL、70 mL、90 mL)、不同NaCl浓度(0%、1%、2%、3%、4%、5%)、不同温度(25 ℃、30 ℃、35 ℃、40 ℃)、不同pH值(5.0、6.0、7.0、8.0、9.0)条件下的生长情况和在含镉浓度为1 mmol·L-1的上述不同液体培养基中的生长情况。接种母液OD600均为1,接种量为2%,于转速200 r·min-1的恒温振荡培养箱中培养18 h,每组设3个平行。
1.7最佳耐镉生长条件下菌株CdTB02的镉吸附实验
配制100 mL LB液体培养基,加镉使培养基中Cd2+的初始浓度分别为100 mg·L-1、500 mg·L-1、900 mg·L-1、1 300 mg·L-1、1 700 mg·L-1,先分别取2 mL培养基作为对照,再以2%接种量接种,接种母液OD600为1,于30 ℃、200 r·min-1下振荡培养24 h,离心后取上清液2 mL做消化。
消化方法:将消化管洗净,烘干。取待测样加入消化管中。称取硫酸铜0.5 g、硫酸钾6 g、浓硫酸12 mL于消化管中。做一个空白对照,将对照组样品加入消化管中,其它条件相同。将消化管放入仪器上进行消化。调整温度为350~400 ℃,待颜色变为澄清(大约2 h以上),再继续加热0.5 h,关闭仪器,将消化管静置、冷却至室温。消化后采用TAS-986原子吸收分光光度计火焰法测定镉浓度。
菌株CdTB02对镉的吸附率(%)和吸附量(mg·L-1)的计算公式如下:

吸附量=(Cd2+初始浓度-吸附后Cd2+浓度)×0.1
2结果与讨论
2.1耐镉细菌的筛选与鉴定
通过对镉污染土壤中微生物进行镉耐受性筛选,得到一株耐镉细菌,命名为CdTB02,该菌的最大镉耐受浓度为25 mmol·L-1。对菌株CdTB02进行形态学和生理生化鉴定,结果见表1。菌株CdTB02总DNA和16S rDNA扩增的部分电泳结果见图1。
由图1可知,菌株CdTB02的16S rDNA序列全长为1 451 bp。将测定所得序列提交NCBI数据库,通过在线序列BLAST比对检索,构建CdTB02菌株系统进化树,见图2。
表1耐镉细菌CdTB02的生化特征
Tab.1

Biochemical properties of the cadmium
注:“+”为阳性反应,“-”为阴性反应。
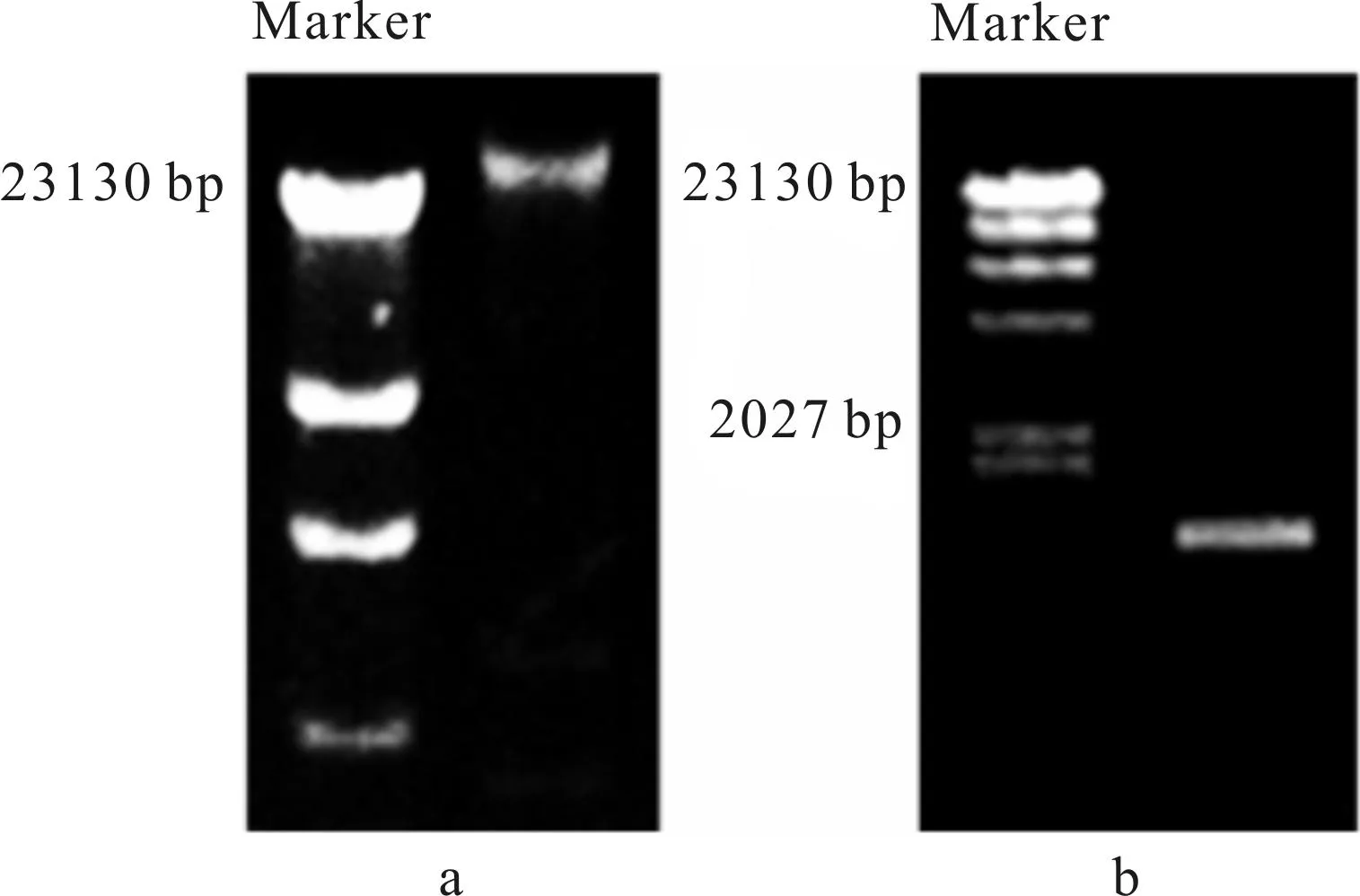
图1 菌株CdTB02总DNA(a)和16S rDNA扩增(b)电泳图

图2 菌株CdTB02与其它相关细菌的系统进化树
结合该菌株的形态学、生理生化鉴定,并参考《伯杰氏细菌鉴定手册》[18],确定耐镉细菌CdTB02为鞘氨醇单胞菌属(Sphingomonassp.)。
2.2生长条件对菌株CdTB02的生长和镉耐受能力的影响(图3)

图3NaCl浓度、装液量、pH值和温度对菌株CdTB02生长和镉耐受能力的影响
Fig.3Effects of NaCl concentration,liquid loading,pH value and temperature on growth and cadmium resistance of CdTB02
培养微生物时,培养基中NaCl含量与细胞渗透压密切相关;装液量的多少会影响培养基中溶解氧的含量,进而影响微生物的呼吸作用和某些代谢产物的合成;pH值和温度直接影响微生物相关代谢酶的活性。由图3a可知,无论环境中是否含有镉离子,随着NaCl浓度的升高,菌株CdTB02的生长都会受到抑制,在NaCl浓度为5%以上时,菌株CdTB02不能生长,其生长最佳NaCl浓度为1%;菌株CdTB02在含镉环境中的生长情况优于不含镉的环境,说明NaCl能提高该菌株的镉耐受能力。由图3b可知,菌株CdTB02在装液量30 mL/250 mL时生长状况最好,但装液量对该菌株镉耐受能力影响不大。由图3c可知,菌株CdTB02适合在中性或偏酸性条件下生长,pH值为9.0时该菌停止生长,说明pH值过高会严重抑制菌体生长;pH值为6.0时该菌生长最佳,含镉环境下pH值为7.0时该菌生长最佳;在碱性环境中pH值对菌株CdTB02的镉耐受能力影响小,偏酸性环境中会降低其镉耐受能力。由图3d可知,菌株CdTB02最佳生长温度为35 ℃,而含镉环境中最佳生长温度为30 ℃。
2.3最佳耐镉生长条件下菌株CdTB02的镉吸附能力
在最佳耐镉生长条件下,即NaCl浓度1%、装液量30 mL/250 mL、pH值7.0、温度30 ℃时,测定菌株CdTB02的镉吸附量和吸附率,结果见表2。
由表2可知,菌株CdTB02对镉的吸附率均高于94.736%,表明该菌的细胞内有较多的活性酶,能提高代谢效率,使细胞与镉的结合率提高,并且呼吸作用提供了足够的能量以运输镉离子进入细胞[6,12]。Cd2+初始浓度为500 mg·L-1时,菌株CdTB02对Cd2+的最高吸附率为97.659%,随着Cd2+浓度的升高,菌株CdTB02对Cd2+的吸附率呈下降趋势,表明菌株CdTB02对镉的吸附能力有限,Cd2+浓度过高会影响菌株CdTB02对镉的吸附能力。
表2
菌株CdTB02的镉吸附量和吸附率
Tab.2

Cadmium adsorption amount and cadmium
3结论
采用常规纯培养方法从重金属镉污染土壤中分离筛选耐镉微生物,并获得一株耐镉能力强的细菌CdTB02,该菌株能在含25 mmol·L-1Cd2+的LB固体培养基中生长。通过形态学观察、生理生化实验及分子鉴定,确定该菌株为鞘氨醇单胞菌属(Sphingomonassp.)。进一步研究发现,CdTB02最佳生长条件为:NaCl浓度1%,装液量30 mL/250 mL,pH值6.0,温度35 ℃;而在含1 mmol·L-1Cd2+的环境中,最佳耐镉生长条件为:NaCl浓度1%,装液量30 mL/250 mL,pH值7.0,温度30 ℃。该菌株在有无镉的环境下均生长良好,说明该菌镉耐受能力强。在最佳生长条件下,菌株CdTB02对Cd2+的最高吸附率为97.659%,表明该菌株对Cd2+有较强的吸附能力,具有在镉污染治理中应用的潜力。
参考文献:
[1]AHEMAD M.Remediation of metalliferous soils through the heavy metal resistant plant growth promoting bacteria:Paradigms and prospects[J].Arabian Journal of Chemistry,2014,158:1-13.
[2]SATARUG S,GARRETT S H,SENS M A,et al.Cadmium,environmental exposure,and health outcomes[J].Environmental H-ealth Perspectives,2011,16(5):2587-2602.
[3]ZHANG W L,DU Y,ZHAI M M,et al.Cadmium exposure and its health effects:A 19-year follow-up study of a polluted area in China[J].Science of the Total Environment,2014,470-471:224-228.
[4]QI X Z,RUI J Y,LEI L Y,et al.Screening of lactic acid bacteria with potential protective effects against cadmium toxicity[J].Original Research Article Food Control,2015,54:23-30.
[5]MOHAMMED U M,NORMALA H.Screening and isolation of heavy metal tolerant bacteria in industrial effluent[J].Procedia Environmental Sciences,2015,30:33-37.
[6]林晓燕,牟仁祥,曹赵云,等.耐镉细菌菌株的分离及其吸附镉机理研究[J].农业环境科学学报,2015,34(9):1700-1706.
[7]CHATURVEDI R,ARCHANA G.Cytosolic expression of synthetic phytochelatin and bacterial metallothionein genes inDeinococcusradioduransR1 for enhanced tolerance and bioaccumulation of cadmium[J].Biometals,2014,27(3):471-482.
[8]MOHAMED Y M,GHAZY M A,SAYED A,et al.Isolation and characterization of a heavy metal-resistant,thermophilic esterase from a Red Sea brine pool[J].Scientific Reports,2013,28(3):3350-3358.
[9]CHEN B,ZHANG Y,RAFIG M T,et al.Improvement of cadmium uptake and accumulation inSedumalfrediiby endophytic bacteriaSphingomonasSaMR12:Effects on plant growth and root exudates[J].Chemosphere,2014,117(1):367-373.
[10]刘爱民,黄为一.应用红外方法探讨耐镉菌株高积累Cd2+的机理[J].环境科学学报,2005,25(11):1502-1506.
[11]HUANG F,GUO C L,LU G N,et al.Bioaccumulation characterization of cadmium by growingBacilluscereusRC-1 and its mechanism[J].Chemosphere,2014,109:134-142.
[12]SHAMIM S,REHMAN A,QAZI M H.Cadmium-resistance mechanism in the bacteriaCupriavidusmetalliduransCH34 andPseudomonasputidamt2[J].Arch Environ Contam Toxicol,2014,67(2):149-157.
[13]WU G,SUN M,LIU P,et al.Enterococcusfaecalisstrain LZ-11 isolated from Lanzhou reach of the Yellow River is able to resist and absorb cadmium[J].Journal of Pure and Applied Microbiology,2014,16(5):1172-1180.
[14]LIMCHAROENSUK T,SOOKSAWAT N,SUNARNROTE A,et al.Bioaccumulation and biosorption of Cd2+and Zn2+by bacteria isolated from a zinc mine in Thailand [J].Ecotoxicology and Environmental Safety,2015,122:322-330.
[15]SURASAK S,WILAILAK S.Cadmium-tolerant bacteria reduce the uptake of cadmium in rice:Potential for microbial bioremediation[J].Ecotoxicology and Environmental Safety,2013,94(1):94-103.
[16]MULLA S,HU A,WANG Y,et al.Degradation of triclocarban by a triclosan-degradingSphingomonassp.strain YL-JM2C[J].Chemosphere,2015,144:292-296.
[17]苟敏,曲媛媛,杨桦,等.鞘氨醇单胞菌:降解芳香化合物的新型微生物资源[J].应用与环境生物学报,2008,14(2):276-282.
[18]布坎南R E,吉本斯N E.伯杰氏细菌鉴定手册[M].第八版.北京:科学出版社,1984.
[19]周德庆.微生物学实验教程[M].第二版.北京:高等教育出版社,2006:3-54.
[20]李法云.污染土壤生物修复理论基础与技术[M].北京:化学工业出版社,2006:70-99.
[21]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:162-167.
Screening,Identification and Characterization of A Cadmium Resistant Strain
ZHOU Geng1,3,DENG Cheng-gang1,2,3,CAO Lin-you1,2,3,CHEN Shuai1,2,3,TIAN Yun1,3,LU Xiang-yang1,3
(1.CollegeofBioscienceandBiotechnology,HunanAgriculturalUniversity,Changsha410128,China;2.CollegeofOrientScience&Technology,HunanAgriculturalUniversity,Changsha410128,China;3.HunanAgriculturalBioengineeringResearchInstitute,Changsha410128,China)
Abstract:In this paper,a strain with maximum cadmium tolerated concentration of 25 mmol·L(-1) was isolated from the soil of heavy metal cadmium polluted area.It was identified as Sphingomonas sp. and named as CdTB02 by morphological observation,physiological-biochemical identification and molecular identification.The optimum growth conditions for strain CdTB02 were as follows:NaCl concentration of 1%,liquid loading of 30 mL/250 mL,pH value of 6.0 and temperature of 35 ℃.In the environment of containing 1 mmol·L(-1) Cd(2+),the optimum growth conditions of cadmium resistance were as follows:NaCl concentration of 1%,liquid loading of 30 mL/250 mL,pH value of 7.0 and temperature of 30 ℃.Cadmium adsorption experiment showed that the adsorption rate of Cd(2+)was more than 94% under the optimum growth conditions of cadmium resistance,which indicated that the strain CdTB02 could play an important role in the treatment of cadmium pollution.
Keywords:cadmium pollution;cadmium resistant bacteria;Sphingomonas sp.;tolerability;adsorption rate
中图分类号:X 703
文献标识码:A
文章编号:1672-5425(2016)03-0043-05
doi:10.3969/j.issn.1672-5425.2016.03.012
作者简介:周赓(1989-),男,湖南津市人,硕士研究生,研究方向:应用微生物学,E-mail:1019583003@qq.com;通讯作者:田云,教授,E-mail:tianyun79616@163.com;卢向阳,教授,E-mail:xiangyangcn@163.com。
收稿日期:2015-12-02

