苔藓中多环芳烃的测定研究
吴让添,安 娜,李崇瑛(成都理工大学材料与化学化工学院,四川成都 610059)
苔藓中多环芳烃的测定研究
吴让添,安娜,李崇瑛
(成都理工大学材料与化学化工学院,四川成都610059)
摘要:采用超声提取及气相色谱质谱联用的方法对苔藓样品中的多环芳烃进行了检测,并对提取前处理中样品的状态、溶剂的种类、溶剂的用量及提取时间进行了优化。
关键词:超声提取;多环芳烃;苔藓;前处理
多环芳烃(PAHs)是一类包含有两个或两个以上稠环的芳香族化合物[1],由于具有一定的挥发性且能够进行迁移[2],使得它们在环境中无处不在。作为一类持久性有机污染物,潜在的危害着人们的健康,因此,对多环芳烃的检测也越来越引起研究学者的关注。目前的检测手段主要有两种:一种是传统的大容积空气采样,另一种是被动采样[3]。传统的采样方式虽然能够用更直接地监测环境中多环芳烃的含量,但这种方法比较耗时且成本较高。相比较,被动采样的成本低、方便、经济,使得它成为了近些年最为常见的采样方式。
由于苔藓这种植物没有真正的根系[4],一切营养都来自于空气。因此,苔藓对大气中的污染情况极其敏感。同时,苔藓表面有一层蜡质层,它能够更好地吸附环境中具有疏水性的PAHs。苔藓的比表面积也比较大,大约有1.6 m2/g,这决定了其吸附能力也较大[5]。且目前还没有文献报导,苔藓本身能够产生PAHs[6],从而使苔藓被研究者广泛地用来当作多环芳烃的被动采样器。目前,用苔藓提取多环芳烃的的前处理方法主要有:索式提取、加速溶剂提取、超声提取、微波辅助提取和超临界流体提取等[7-11],而超声提取相比较而言,具有节省时间、使用有机溶剂量少及操作方便等优点,已经被广泛地用于提取样品中的PAHs。而随着技术的不断进步,用于检测PAHs的方法也在不断地改进,由最初的薄层色谱法逐渐向高效液相色谱法(HPLC-UV)及气相色谱法(GC-FID)发展,为了进一步提高检测的灵敏度,气相色谱质谱联用的方法(GCMS)在近些年已经成为了最常见的检测PAHs的方法。
本文采用超声提取及气相色谱质谱联用的方法对苔藓样品中的多环芳烃进行检测,并对提取前处理的一些条件进行了优化,为植物中多环芳烃的提取提供了数据参考。
1 实验部分
1.1仪器与试剂
美国Thermo公司的TSQ Quantum气相色谱-质谱联用仪;昆山市超声仪器有限公司的KQ2200DE超声仪;永康市绿可食品机械有限公司的HC-300T2粉碎机;上海雅荣生化设备仪器有限公司的旋转蒸发仪,带恒温水浴。多环芳烃的标准液(美国o2si smart solutions公司);正己烷、二氯甲烷等有机试剂均为色谱纯,购于科密欧试剂公司。所有玻璃器材经过重铬酸钾洗液浸泡,清洗干净,最后用超纯水清洗烘干。
1.2实验方法
1.2.1样品处理
将采集回来的苔藓样品用冷冻干燥机进行干燥。然后用食品粉碎机将苔藓样品粉碎处理。准确称取2.0 g的苔藓样品和2.0 g无水硫酸钠(提前在650℃下烘4 h)放入50 mL的聚丙烯塑料离心管中,将它们混合均匀。加入20 mL的二氯甲烷,在室温下用超声清洗仪超声20 min。静置,将提取液转移到一个干净的离心管中,残渣再用10 mL的二氯甲烷提取一次。合并两次提取液,用0.45 μm的过滤膜进行过滤。滤液用旋转蒸发仪进行浓缩,最后定容到2 mL,取1 mL装入进样瓶中,用GC-MS/MS分析。
1.2.1仪器的分析条件
色谱条件:以高纯的氦气作为载气,载气速度调为1.0 mL/min,进样体积为1.0 μL,采用不分流进样,进样口温度为280℃,程序升温的过程为:70℃下保持2 min,然后以每分钟10℃上升到300℃,保持7 min。
质谱条件:选择电子轰击源(EI)作为离子源,其能量为70 eV,离子源温度控制在260℃;采用选择性反应监测模式SRM;传输线温度保持在280℃;溶剂延迟时间为6 min。

表1 气相色谱分析结果
2 结果与讨论
实验采用超声的方法对苔藓样品中的多环芳烃进行提取,并对提取的条件进行了一系列优化。
2.1苔藓状态的比较
首先,实验对三种不同大小的苔藓样品(分别是未处理、剪成1 cm及粉碎状态)进行了提取效果比较。它们的提取效果如图1:

图1 对不同状态的苔藓提取效果
结果表明:对粉碎的苔藓样品提取效果明显要优于其它两者,剪碎的效果次之。这是因为苔藓样品的粒径越小,与溶剂的接触面积就越大,提取效果也就越好。
2.2提取溶剂的优化
选择合适的提取溶剂对于提取条件的优化具有重要影响,其选择原则是溶剂不溶或难溶于水,同时提取溶剂要对目标物有较高的萃取效率,且溶剂峰与目标化合物峰不发生干扰,正己烷、二氯甲烷、丙酮以及他们的混合溶剂等[12-14]都是PAHs提取常用的溶剂。为了达到提取效率最大化、提取液中干扰物质最小以及绿色环保的目的,本实验以苔藓为样本对二氯甲烷、正己烷、正己烷/二氯甲烷混合溶液(体积比1:1)的提取效果进行探究。

图2 三种不同提取溶剂的提取效果
从图2可以看出:除了萘以外,采用二氯甲烷对多环芳烃的提取效果最佳,混合溶剂的提取效果次之,正己烷的提取效果最差。因为PAHs中的高环组分具有一定的极性,而萘的结构比较对称,极性很小,根据相似相溶的原理,增加溶剂中二氯甲烷的比列,更容易提取极性较大的高环组分,因此本实验采用二氯甲烷作为提取溶剂。
2.3溶剂用量的选择
目前,用于提取苔藓中多环芳烃的溶剂基本上都是有机溶剂,且具有一定的挥发性。如果使用大量的溶剂进行提取,不仅仅是一种浪费,还会对环境产生污染。因此,本实验在保证提取效果的前提下尽量减少溶剂用量,进行了溶剂用量优化实验。使用溶剂用量分别为10 mL、20 mL、30 mL、40 mL,对多环芳烃的提取效果如图3:

图3 溶剂用量的优化
大多数PAHs在30 mL溶剂用量时便达到比较理想的提取效果,之后随提取溶剂用量的增加提取效果无较大的变化,因此没有再增加提取用量的必要性,由此,我们确定了最佳超声提取溶剂用量为30 mL。
2.4提取时间的筛选
为了缩短分析过程的总时间,实验对提取的时间也进行了优化。不同提取时间的效果如图4:

图4 超声提取时间的优化
由图可知,在前40 min,随着提取时间的延长,提取效果不断的增加;当提取时间达到40 min,提取效果已经不再有明显的提升。因此,为了节省过程的时间,超声提取的时间选择为40 min。
2.5苔藓样品多环芳烃的含量测定
将苔藓样品在上述优化实验找出的最佳条件下进行多环芳烃的提取,最后测出样品中多环芳烃的含量和回收率如表2。
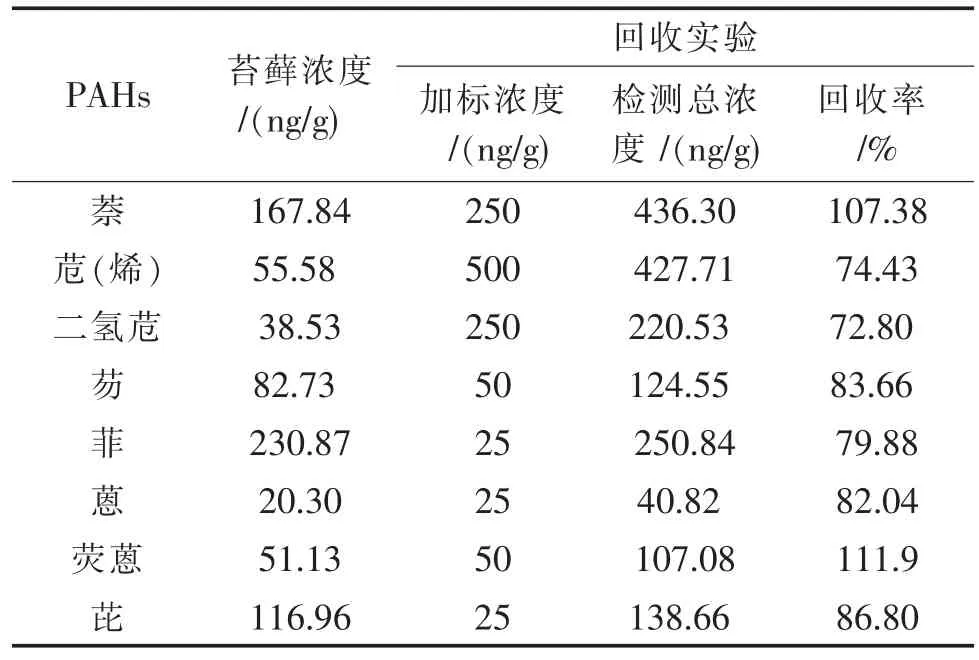
表2 样品中PAHs的含量及回收率
由表2可知,苔藓的多环芳烃中主要是含菲、萘和芘,它们的含量明显要高于其它的多环芳烃,这与国内的结果基本相符合。实验的回收率范围在72.80%~111.9%,这说明检测方法的可行的。
参考文献:
[1] Kouzayha A, Al Iskandarani M, Mokh S, et al. Optimization of a solid-phase extraction method using centrifugation for the determination of 16 polycyclic aromatic hydrocarbons in water [J]. Journal of agricultural and food chemistry, 2011, 59: 7592-7600.
[2]刘征涛.持久性有机污染物的主要特征和研究进展[J].环境科学研究,2005,18: 93-102.
[3]张萍,李崇瑛,刘敏,等.植物被动采样器监测大气中多环芳烃(PAHs)研究现状[J].广州化工,2011,39(18): 4-7.
[4]孙守琴,王定勇.苔藓植物对大气污染指示作用的研究进展[J].四川环境,2004,23(5): 31-35.
[5]黄建斌,肖化云.苔藓生物监测大气沉降中多环芳烃(PAHs)污染研究进展[J].江西科学,2008,26(3): 511-516.
[6]许春晖,卢龙.苔藓植物监测大气多环芳烃研究进展[J].广东化工,2010,37(3):181-183.
[7] Dolegowska S,Migaszewski Z M. PAH concentrations in the moss s,pecies Hylocomium splendens(Hedw.)B.S.G. and Pleurozium schreberi(Brid.)Mitt. from the Kielce area(south -central Poland)[J]. Ecotoxicology and environmental safety,2011,74: 1636-1644.
[8] Ratola N,Alves A,Psillakis E. Biomonitoring of polycyclic aromatic hydrocarbons contamination in the island of crete using pine needles[J]. Water,Air,& Soil Pollution,2010,215: 189-203.
[9] Ares A,Aboal J R,Fernández J A,et al. Use of the terrestrial moss pseudoscleropodium purum to detect sources of small scale contamination by PAHs [J]. Atmospheric Environment,2009,43: 5501-5509.
[10]刘向,张干,刘国卿,等.南岭北坡苔藓中多环芳烃的研究[J].中国环境科学,2005,25(1): 101-105.
[11] Librando V,Hutzinger O,Tringali G,et al. Supercritical fluid extraction of polycyclic aromatic hydrocarbons from marine sediments and soil samples [J]. Chemosphere,2004,54: 1189-1197.
[12] Domeño C,Blasco M,Sánchez C,et al. A fast extraction technique for extracting polycyclic aromatic hydrocarbons (PAHs)from lichens samples used as biomonitors of air pollution: dynamic sonication versus other methods [J]. Analytica Chimica Acta,2006,569: 103-112.
[13] Tremolada P,Parolini M,Binelli A,et al. Seasonal changes and temperature - dependent accumulation of polycyclic aromatic hydrocarbons in high-altitude soils[J]. The Science of the total environment,2009,407: 4269-4277.
[14] Holoubek I,Korinek P,Seda Z,et al. The use of mosses and pine needles to detect persistent organic pollutants at local and regional scales [J]. Environmental pollution,2000,109: 283-292.
The Determination of Polycyclic Aromatic Hydrocarbons in Mosses
WU Rang-tian, AN Na, LI Chong-ying
(College of Materials and Chemistry & Chemical Engineering, Chengdu University of Technology, Chengdou, Sichuan 610059, China)
Abstract:In the paper, polycyclic aromatic hydrocarbons(PAHs) in the moss samples were determined using the ultrasonic extraction method and gas chromatography mass spectrometry. The conditions of the sample size, the solvent, the dosage of solvent and the extracting time were optimized.
Keywords:ultrasonic extraction; polycyclic aromatic hydrocarbons; moss; pretreatment
作者简介:吴让添(1989-),男,湖北大冶人,在读硕士研究生,主要研究方向:环境分析。E-mail:503060080@qq.com。
收稿日期:2015-12-18
文章编号:1006-4184(2016)3-0051-04

