Pb(Ⅱ)在天然土壤纳米颗粒上的吸附-解吸:pH和离子强度的影响
安伟强,孙慧敏,2,吕家珑,2*,殷宪强,2*,韦革宏,李 俊
(1.西北农林科技大学资源环境学院,陕西杨凌712100;2.农业部西北植物营养与农业环境重点实验室,陕西杨凌712100;3.西北农林科技大学生命科学学院,陕西杨凌712100)
Pb(Ⅱ)在天然土壤纳米颗粒上的吸附-解吸:pH和离子强度的影响
安伟强1,孙慧敏1,2,吕家珑1,2*,殷宪强1,2*,韦革宏3,李俊1
(1.西北农林科技大学资源环境学院,陕西杨凌712100;2.农业部西北植物营养与农业环境重点实验室,陕西杨凌712100;3.西北农林科技大学生命科学学院,陕西杨凌712100)
摘要:选择提取自四种典型土壤的天然纳米颗粒作为吸附材料,研究了pH及离子强度(IS)对Pb(Ⅱ)在四种天然纳米颗粒上的吸附-解吸的影响,旨在为有效地控制土壤铅的环境行为提供依据。结果表明:在低pH时,四种土壤纳米颗粒Pb(Ⅱ)吸附量随pH的增大而增大,当pH>5后吸附量达到最大且趋于稳定。相同初始浓度下,四种吸附材料对Pb(Ⅱ)的吸附能力依次为黄绵土纳米颗粒>塿土纳米颗粒>风沙土纳米颗粒>黑垆土纳米颗粒。且四种土壤纳米颗粒的吸附量与离子强度(IS)有关,当IS为0.01 mol·L(-1)NaCl时,Pb(Ⅱ)吸附量最大,而0.1 mol·L(-1)NaCl时吸附效果最差,吸附在低IS时形成内表面络合物,高IS时形成外表面络合物。Pb(Ⅱ)解吸率随pH的增大而减小,pH为3时解吸率最大,pH>5后四种土壤纳米颗粒的解吸率降低。在不同IS的解吸液中,IS越大Pb(Ⅱ)的解吸率越大,解吸液为蒸馏水时解吸率最小。四种土壤纳米颗粒解吸率大小顺序为风沙土纳米颗粒>塿土纳米颗粒>黑垆土纳米颗粒>黄绵土纳米颗粒。
关键词:pH;离子强度;天然土壤纳米颗粒;吸附;解吸
安伟强,孙慧敏,吕家珑,等. Pb(Ⅱ)在天然土壤纳米颗粒上的吸附-解吸:pH和离子强度的影响[J].农业环境科学学报, 2016, 35(3):463-470.
AN Wei-qiang, SUN Hui-min, LÜ Jia-long, et al. Adsorption-desorption of Pb(Ⅱ)on natural soil nanoparticles:Effects of pH and ionic strength[J]. Journal of Agro-Environment Science, 2016, 35(3): 463-470.
吸附和解吸是重金属在土壤或固相介质中发生的主要物理化学过程。重金属在土壤胶体上的吸附-解吸受到许多因素的影响[1]。首先受到土壤胶体本身特性的影响,包括土壤胶体的组成、有机质含量、表面的带电性等。其次受到外在环境变化,土壤胶体悬液浓度等的影响,当外界环境温度、pH发生变化时外源重金属的吸附量也发生相应的变化,外界环境中竞争离子增多或者减少也会影响重金属的吸附[1]。胶体对铅具有较强的吸附能力,吸附在土壤胶体上的大量铅在条件变化时可能发生解吸,造成二次污染,因此研究吸附在土壤胶体上的铅的解吸行为,对于评价铅对土壤的二次污染具有重要意义[2]。
土壤胶体对重金属的吸附机理分为专性吸附和非专性吸附。专性吸附也叫选择性吸附或配位吸附,属于化学吸附,是土壤胶体中一些可溶性盐和重金属污染物发生化学反应,生成溶解度较低的化合物或螯合物,一般通过配位键和共价键而产生吸附,主要发生在胶体的决定电位层,受介质的pH值影响较大。非选择性吸附也叫物理吸附或者离子交换吸附,发生在土壤胶体表面,吸附速率较快,属于可逆吸附[3]。由于pH的改变会影响土壤表面电荷和离子水解程度的变化,大量学者研究pH对重金属吸附解吸的影响时,得出不同的吸附剂对重金属的吸附解吸行为随pH值的变化表现出各自不同的特征,乔冬梅等[2]采用一次平衡法研究发现,Pb(Ⅱ)的吸附量随pH值的升高而增大,解吸量随pH值的增大而减小。梁晶等[4]的研究结果也表明Pb(Ⅱ)的吸附量随pH值的增加而增加,而解吸量是先逐渐增加,在某一pH时达最大后又逐渐减小。一般来说,溶液的离子强度增加时,吸附质与吸附剂间的静电作用就会减弱,但在实际的吸附过程中,离子强度对吸附的影响则比较复杂,平衡吸附量可能随离子强度的增加而增加,也可能减小或可能基本不变[8]。周洪英[9]、杨亚提[5-7]和Julita[10]等研究发现随离子强度的增大,Pb(Ⅱ)与背景电解质产生竞争吸附,而且在离子周围的负离子形成的“离子氛”也增强,从而阻碍了Pb(Ⅱ)向吸附位点靠近,导致了最大吸附量降低。还有学者研究[11]发现在单一Pb(Ⅱ)溶液中,随离子强度增加吸附量降低;在有Pb(Ⅱ)与Cu(Ⅱ)竞争离子存在时,随离子强度增加,Pb(Ⅱ)的吸附量降低而Cu(Ⅱ)的吸附量提高。
以往研究土壤胶体吸附多集中于研究单一胶体黏土矿物(如蒙脱石胶体,伊利石胶体,腐植酸等)对重金属的吸附及影响[15],而对不同天然土壤纳米颗粒受pH和离子强度的影响研究较为少见。因此本研究从不同土壤中提取纳米粒径的土壤胶体,研究外界因素对土壤纳米颗粒吸附解吸Pb(Ⅱ)的影响,对寻求有效控制土壤中铅的环境行为的对策措施具有重要意义。
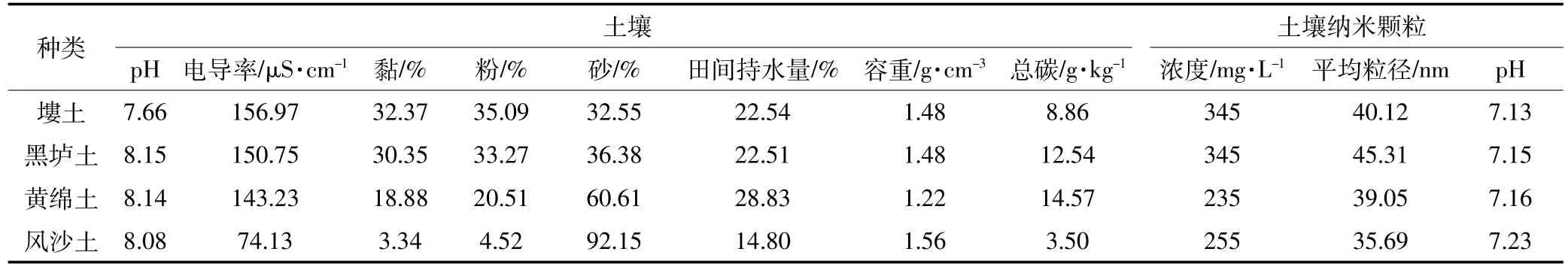
表1 供试土壤及纳米颗粒基本理化性质Table 1 Basic chemical and physical properties of soil and soil nanoparticles
1 材料与方法
1.1供试样品
供试土壤纳米颗粒分别提取于以下四种土壤:采自西北农林科技大学试验田的塿土,采自长武农业生态站试验田的黑垆土,采自安塞生态试验站试验田的黄绵土以及采自神木县六道沟林地的风沙土。土样采自0~20 cm耕层,去除植物残渣,自然风干后研磨过2 mm筛,虹吸法提取土壤纳米颗粒,稀释到一定浓度,制成土壤纳米颗粒悬液备用。供试土壤基本理化性质按照《土壤农化分析》[16]中方法进行测定分析,结果见表1。土壤纳米颗粒粒径用原子力显微镜(MultiMode-8,美国Bruker公司)测定,土壤纳米颗粒浓度用紫外分光光度计测定(UV2800),用烘干法定量。
供试铅为硝酸铅Pb(NO3)2,由天津化学试剂厂生产。
1.2实验方法
1.2.1天然土壤纳米颗粒的制备方法[17]
称取50 g四种供试土壤样品于500 mL烧杯,并置于105℃烘箱中烘干至恒重;取出冷却后,往烧杯中加入400 mL去离子水;置于超声分散仪中分散1 h后取下,于平台上静置24 h;而后用虹吸法吸取上层悬液于500 mL容量瓶中(虹吸时用蠕动泵,15 mL· min-1的流速),定容;将烧杯中剩余的土壤悬液再次置于105℃烘箱中烘干至恒重。
1.2.2pH对天然土壤纳米颗粒吸附Pb(Ⅱ)的影响
取20 mL的土壤纳米颗粒悬液(浓度见表1,下同)和20 mL的50 mg·L-1的铅污染液于100 mL离心管中,用NaOH和HNO3悬液将pH分别调为3、4、5、6、7、8、9,振荡24 h,于4000 r·min-1离心10 min,收集上清液,测定上清液中铅浓度,并测定平衡后溶液的pH。
1.2.3离子强度对天然土壤纳米颗粒吸附Pb(Ⅱ)的影响
取20 mL的纳米颗粒悬液和20 mL用0.1、0.01、0.001 mol·L-1NaNO3溶液配制的50 mg·L-1的铅污染液于100 mL离心管中,振荡24 h,于4000 r·min-1离心10 min,用石墨炉原子吸收光谱仪测定上清液中铅浓度(下同)。
1.2.4离子强度对天然土壤纳米颗粒Pb(Ⅱ)解吸的影响
取20 mL土壤纳米颗粒悬液和20 mL的50 mg· L-1的铅污染液于100 mL离心管中,振荡24 h,于4000 r·min-1离心10 min,收集上清液测定铅含量,加入去离子水清洗残渣,离心,倒出上清液,反复两次,之后分别向离心管中加入不同离子强度的溶液(蒸馏水、0.1、0.01、0.001 mol·L-1的NaNO3溶液)作为解吸剂[18],振荡3 h,解吸平衡后,于4000 r·min-1离心10 min,测定上清液中铅的含量。
1.2.5pH对天然土壤纳米颗粒Pb(Ⅱ)解吸的影响
取20 mL土壤纳米颗粒悬液,加入50 mg·L-1的铅污染液于100 mL离心管中,置于振荡机中振荡至平衡,离心后将上清液倒出(测定上清液中铅含量),用去离子水离心清洗两遍后加入20 mL用氢氧化钠和硝酸调节的pH为3、4、5、6、7、8、9的溶液,作为解吸液,室温下振荡至解吸平衡后取出,离心后测定上清液中铅的含量。
1.3数据处理
采用Excel进行数据处理作图,采用SPSS 20进行统计分析。
1.3.1吸附量的计算
计算吸附量是吸附-解吸试验中最基本也是最重要的方法,其方程如下:
S=(C-C0)V/m(1)
式中:S为平衡时土壤纳米颗粒对重金属的吸附量,mg·g-1;C0为加入液中重金属浓度,mg·L-1;C为平衡液中重金属的浓度,mg·L-1;V为平衡时液体体积,L;m为加入的土壤纳米颗粒质量,g。
1.3.2解吸率的计算
土壤纳米颗粒对重金属的解吸不能只靠解吸量的大小来衡量其解吸能力,需要借助无量纲因子——解吸率来比较其大小,计算公式如下:
解吸率=解吸量/吸附量

式中:S为土壤纳米颗粒对Pb2+的解吸量,mg·g-1;V为溶液体积,mL;C为土壤纳米颗粒悬液中Pb(Ⅱ)的解吸平衡浓度,mg·L-1;m为土壤纳米颗粒含量,g。
2 结果与讨论
2.1不同pH溶液对天然土壤纳米颗粒吸附Pb(Ⅱ)的影响
2.1.1pH对Pb(Ⅱ)在天然土壤纳米颗粒上吸附量的影响
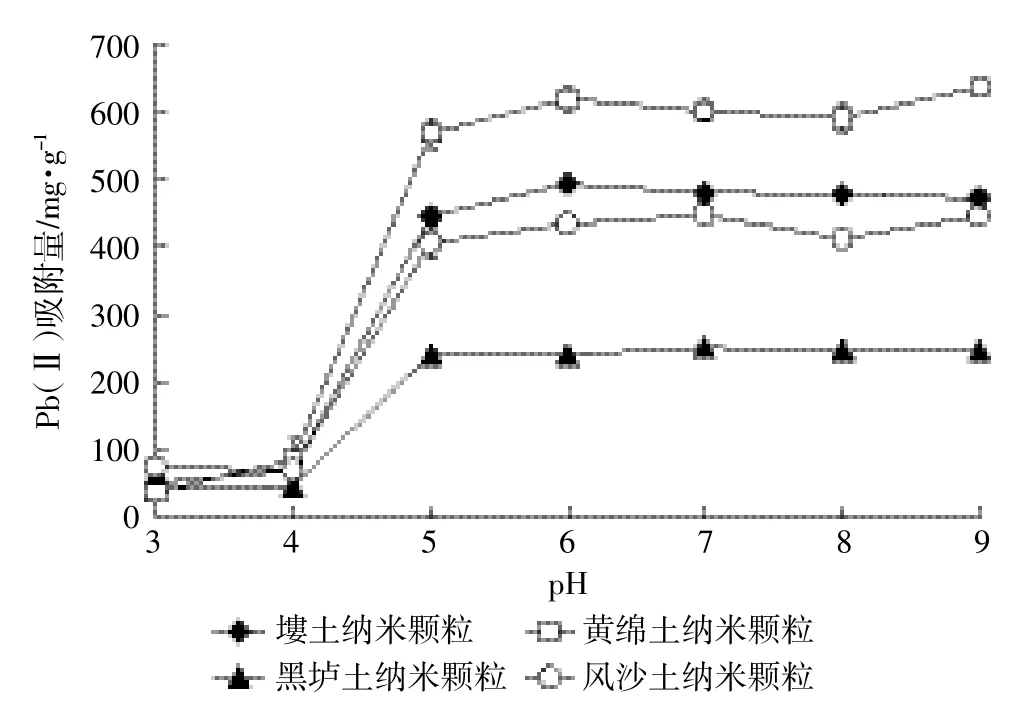
图1 pH对天然土壤纳米颗粒吸附Pb(Ⅱ)的影响Figure 1 Effect of pH on Pb(Ⅱ)adsorption on natural soil nanoparticles
Pb(Ⅱ)初始浓度在50 mg·L-1、温度25℃条件下四种土壤纳米颗粒对Pb(Ⅱ)的吸附量随pH的变化如图1所示,结合表2可知:当四种土壤纳米颗粒均达到最大吸附量时,各土壤纳米颗粒对Pb(Ⅱ)的吸附量间存在显著差异(P<0.05),其中黄绵土纳米颗粒>塿土纳米颗粒>风沙土纳米颗粒>黑垆土纳米颗粒。随着pH的增大,四种土壤纳米颗粒对Pb(Ⅱ)的吸附量均增大,由此可以看出,土壤纳米颗粒对Pb(Ⅱ)的吸附受pH的影响较大,这与Basta等[19]的研究结果一致。由图1得知,当溶液pH<5时,土壤纳米颗粒对Pb(Ⅱ)的吸附量不断增加;当pH>5时,四种土壤纳米颗粒对Pb(Ⅱ)的吸附量逐渐趋于稳定。出现这种现象的原因是由于低pH值时溶液中存在大量的H+,吸附剂表面基团上的吸附位点被H+所占据,阻碍了Pb(Ⅱ)与吸附剂结合,因此在低pH值时吸附量较小[20]。而随着pH的增大,溶液体系中的H+减少,吸附剂暴露出更多的带负电的活性基团,有利于Pb(Ⅱ)接近吸附剂,同时与吸附剂基团上的活性位点结合而被吸附。因此随着pH的增大,其吸附量也逐渐增大,但当pH达到5时吸附量就不再增大,其原因是pH升高时,土壤纳米颗粒的吸附位点有所增加,但增加量是有限的,Pb(Ⅱ)与土壤纳米颗粒上有限的-OH配位基配位,转化成氢氧化物沉淀而被吸附,故再继续增大pH时,吸附量不再增大[21]。

表2 不同pH环境下天然土壤纳米颗粒对Pb(Ⅱ)的吸附量Table 2 Results of Pb(Ⅱ)adsorption by natural soil nanoparticles in different pH solution
2.1.2四种天然土壤纳米颗粒零点电位分析
分别测定反应前和反应后的pH,以ΔpH对反应前pH作图得滴定曲线,当ΔpH=0时所对应的pH值即为土壤纳米颗粒的零点pH[22]。当溶液体系的pH值小于等电点时,土壤纳米颗粒吸附H+带正电荷,不利于土壤纳米颗粒对Pb(Ⅱ)的吸附,当溶液体系的pH值大于零点电位时,土壤纳米颗粒吸附OH-离子带负电荷,有利于土壤纳米颗粒对Pb(Ⅱ)的吸附。
由图2可知,塿土纳米颗粒、黄绵土纳米颗粒的零点电位pH在6.3左右,黑垆土纳米颗粒的零点电位pH为6,而风沙土纳米颗粒的零点电位pH在6.7左右。风沙土纳米颗粒的零点电位pH较大,因此在不同pH体系中风沙土纳米颗粒的吸附量有所增加,而黑垆土纳米颗粒的零点电位pH最小,因此在不同pH体系中黑垆土纳米颗粒的吸附量有所减小,不利于Pb(Ⅱ)的吸附,这一结论与上图分析结果一致。且根据吸附前以及吸附后体系的pH可知,塿土纳米颗粒、黑垆土纳米颗粒、黄绵土纳米颗粒吸附后平衡体系溶液pH基本都在6左右维持稳定,风沙土纳米颗粒在pH为7时趋于稳定。

图2 Pb(Ⅱ)吸附前后天然土壤纳米颗粒悬液pH的变化量随pH的变化Figure 2 Changes of pH in soil nanoparticles suspension after Pb(Ⅱ)adsorption
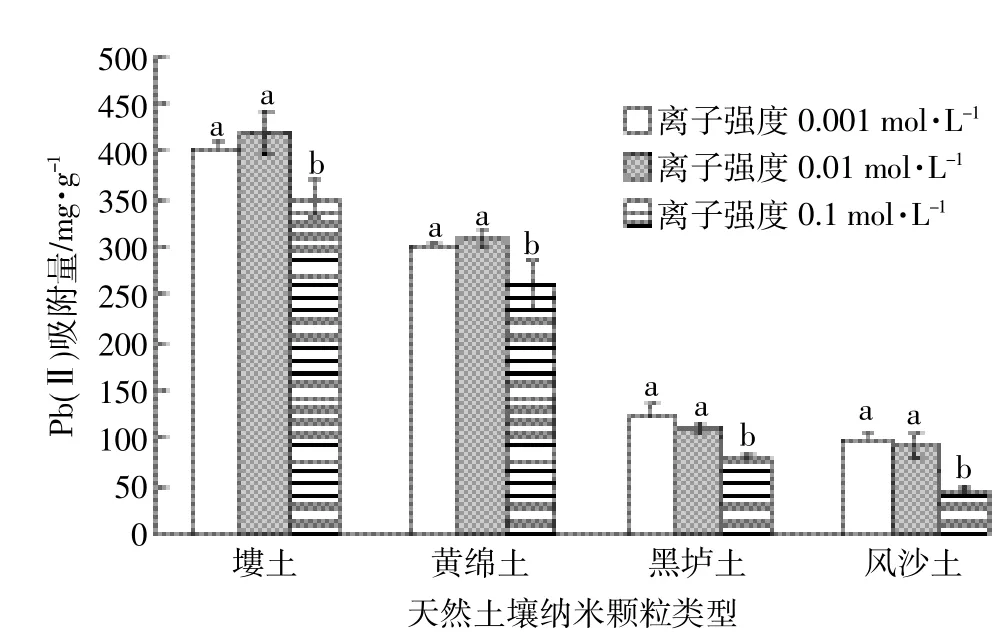
图3 离子强度对天然土壤纳米颗粒吸附Pb(Ⅱ)的影响Figure 3 Effect of ionic strength on Pb(Ⅱ)adsorption on natural soil nanoparticles
2.2不同离子强度溶液对Pb(Ⅱ)吸附的影响
如图3,分别在离子强度为0.1、0.01、0.001 mol· L-1的硝酸钠溶液中进行四种土壤纳米颗粒对Pb(Ⅱ)的吸附试验,结果表明:四种土壤纳米颗粒在离子强度为0.01 mol·L-1和0.001 mol·L-1时吸附量最大,0.1 mol·L-1时吸附量最小。方差分析结果表明,离子强度为0.01 mol·L-1时吸附量与离子强度为0.001 mol·L-1吸附量之间差异不显著,而离子强度为0.001 mol·L-1时吸附量与0.1 mol·L-1吸附量之间存在显著差异,四种土壤纳米颗粒均有相同的结果。出现这种现象可能的原因是,在低离子强度(小于0.01 mol·L-1)条件下,重金属离子与吸附剂之间形成内层表面络合物,因此随着离子强度的增大,其吸附能力也逐渐增大。在离子强度超过0.01 mol·L-1时,重金属离子与吸附剂之间形成外层表面络合物,加入电解质离子(Na+)会与Pb(Ⅱ)之间发生离子交换竞争吸附,因此抑制了吸附剂对重金属的吸附,而且,随溶液离子强度增加,外加电解质离子可能会压缩土壤纳米颗粒扩散的双电层厚度,削弱了土壤纳米颗粒微粒间的静电排斥作用,使之发生团聚,使土壤纳米颗粒的有效吸附位点数量减少[11],从而也导致Pb(Ⅱ)吸附量随离子强度的增加而减小[22]。
在不同离子强度条件下比较四种土壤纳米颗粒的吸附量发现其吸附量顺序大小为塿土纳米颗粒>黄绵土纳米颗粒>黑垆土纳米颗粒>风沙土纳米颗粒。多重比较结果发现风沙土纳米颗粒与黑垆土纳米颗粒之间吸附量不存在显著的差异,其余土壤纳米颗粒之间吸附量存在显著差异。
2.3不同pH解吸液对Pb(Ⅱ)解吸的影响
如图4和表3,将不同pH的解吸液加到Pb(Ⅱ)吸附饱和的土壤纳米颗粒中,根据解吸率的大小得出:不同pH的解吸液中Pb(Ⅱ)的解吸率不同,随着pH的增大解吸率逐渐减小,pH等于3时解吸率最大,其后解吸率迅速减小,pH等于5后的土壤纳米颗粒解吸率减小趋势逐渐变缓,这与四种土壤纳米颗粒在不同pH条件下的吸附量的大小顺序相反。方差分析显示塿土纳米颗粒对Pb(Ⅱ)的解吸率在pH为3、4、5之间存在显著差异,在pH为6、7、8、9之间差异不显著。黄绵土纳米颗粒在pH为3、4、5、6、7之间解吸率存在显著差异,pH在7、8、9之间差异不显著,pH为6与9之间存在显著差异。黑垆土纳米颗粒在pH为3、4时不存在显著差异,pH大于5后解吸率不存在显著差异。风沙土纳米颗粒在pH为3、4、5时解吸率与pH 9时存在显著差异,pH为5、6、7、8时不存在显著差异。
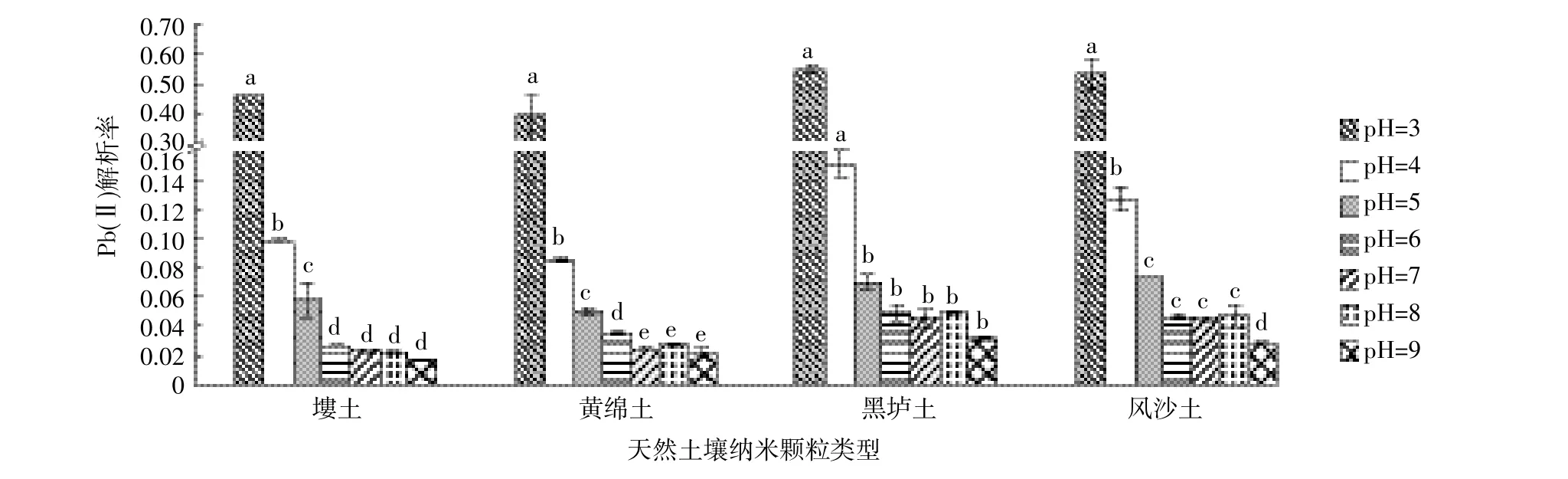
图4 pH对Pb(Ⅱ)在天然土壤纳米颗粒上解吸的影响Figure 4 Effect of pH on Pb(Ⅱ)desorption on natural soil nanoparticles
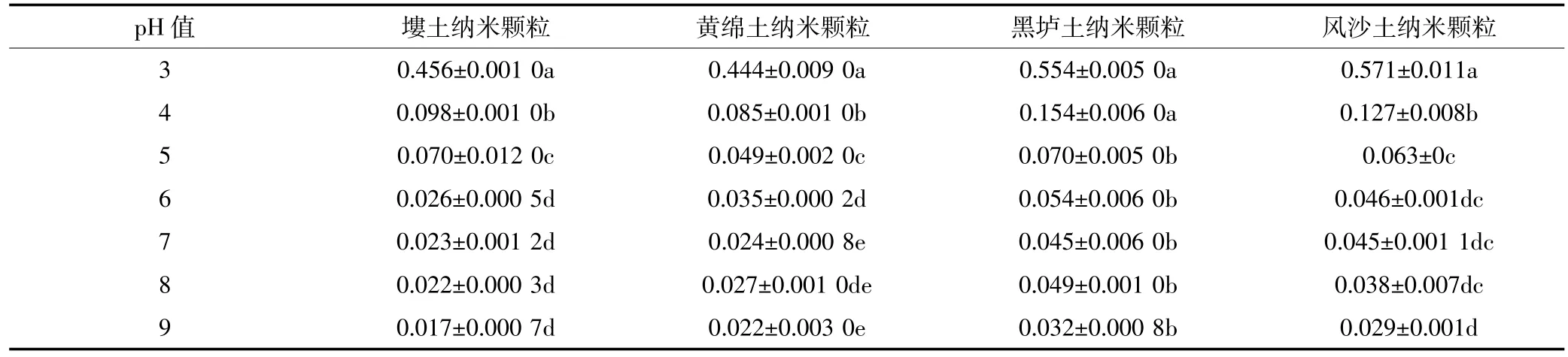
表3 Pb(Ⅱ)在不同pH解吸液中解吸的多重比较Table 3 Results of Pb(Ⅱ)desorption from natural soil nanoparticles in different pH desorption solution
Pb(Ⅱ)在pH较低时解吸率大的原因可能是离子交换作用和沉淀物的溶解作用,在较低pH条件下解吸液中存在大量的H+,H+与四种土壤纳米颗粒的Pb(Ⅱ)发生离子交换作用,促使Pb(Ⅱ)从土壤纳米颗粒表面置换下来[23]。另外可能由于Pb(Ⅱ)在土壤纳米颗粒表面沉积一部分Pb(OH)2,氢氧化物沉淀会在酸性条件与H+发生溶解作用,从而使Pb(Ⅱ)被解吸[19]。
四种土壤纳米颗粒解吸率的大小为黑垆土纳米颗粒>风沙土纳米颗粒>塿土纳米颗粒>黄绵土纳米颗粒。不同pH条件下解吸率的大小与吸附量的大小顺序刚好相反。黑垆土纳米颗粒的解吸率在3.2%~55.4%之间,风沙土纳米颗粒的解吸率在2.9%~57.1%之间,塿土纳米颗粒的解吸率在1.7%~45.6%之间,黄绵土纳米颗粒的解吸率在2.2%~44.4%之间。从四种土壤纳米颗粒的解吸率比较发现,风沙土纳米颗粒的解吸率较大,是由于风沙土的黏粒占3.34%,而土壤纳米颗粒的核心部分是黏粒矿物,所以重金属离子较容易从风沙土纳米颗粒中解吸出来[24],故四种纳米颗粒解吸率的大小可能与制备纳米颗粒相应土壤的矿物成分分析的结果有关。总体来说,各个土壤纳米颗粒的最大解吸量为吸附量的一半,可得出四种土壤纳米颗粒对Pb(Ⅱ)的吸附一半是非专性吸附,为可逆吸附,可以从土壤纳米颗粒表面解吸出来,而另一半为专性吸附,是不可逆吸附,很难在土壤纳米颗粒表面发生解吸[25]。
2.4不同离子强度解吸液对Pb(Ⅱ)解吸的影响
如图5,将不同离子强度的解吸液加入吸附饱和的四种土壤纳米颗粒离心管中,解吸平衡后测定解吸液中重金属铅的浓度从而计算出解吸率,试验结果表明:随着离子强度的增大,四种纳米颗粒的解吸率也逐渐增大,离子强度为0.1 mol·L-1时解吸率最大,离子强度为0.01 mol·L-1次之,然后为0.001 mol·L-1,解吸液为蒸馏水时解吸率最小,黄绵土纳米颗粒除外,其在离子强度为0.01 mol·L-1时解吸率小于0.001 mol·L-1。塿土纳米颗粒在四中不同离子强度的解吸液中解吸率大小存在显著差异;黄绵土纳米颗粒在0.1 mol·L-1与0.01 mol·L-1存在显著差异,0.01 mol·L-1与0.001 mol·L-1离子强度的解吸液之间不存在显著差异,0.001 mol·L-1离子强度的解吸液与蒸馏水之间存在显著差异;黑垆土纳米颗粒在0.1、0.01、0.001 mol· L-1离子强度的解吸液中解吸率存在显著差异,而0.001 mol·L-1与解吸液为蒸馏水的解吸率之间不存在显著差异;风沙土纳米颗粒差异分析与黄绵土纳米颗粒具有相同的结果,0.01 mol·L-1与0.001 mol·L-1离子强度的解吸液之间不存在显著差异,其余解吸液之间解吸率均存在显著差异。因为随着离子强度的增大,解吸液中的离子也会增多,钠离子会与重金属离子形成竞争作用而将吸附在纳米颗粒上的重金属置换下来,导致溶液中重金属越来越多[26]。
四种土壤纳米颗粒在不同离子强度条件下解吸的大小顺序是风沙土纳米颗粒>塿土纳米颗粒>黑垆土纳米颗粒>黄绵土纳米颗粒。四种土壤方差分析表明,风沙土纳米颗粒解吸率与其他土壤纳米颗粒之间存在极显著差异,而其余三个土壤纳米颗粒之间在不同条件下解吸率不存在显著差异。风沙土纳米颗粒的解吸率在17.5%~48%之间,塿土纳米颗粒解吸率在8.4%~25.3%之间,黑垆土纳米颗粒解吸率11%~22.2%之间,黄绵土纳米颗粒解吸率在6.5%~16.4%之间,四种土壤纳米颗粒在不同离子强度中的最大解吸率均比在不同pH的解吸液中小。
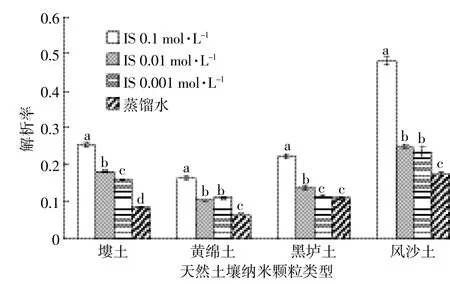
图5 不同离子强度对Pb(Ⅱ)在天然土壤纳米颗粒上解吸的影响Figure 5 Effect of different ionic strengths on desorption of Pb(Ⅱ)on natural soil nanoparticles
3 结论
(1)四种土壤纳米颗粒对Pb(Ⅱ)的吸附量在低pH值时随着pH的增大而增大。pH为3时吸附量最小,当pH为5时吸附量达到最大,趋于稳定。吸附量结果比较为黄绵土纳米颗粒>塿土纳米颗粒>风沙土纳米颗粒>黑垆土纳米颗粒。
(2)在不同离子强度条件下,四种土壤纳米颗粒的吸附量变化率较大。0.01 mol·L-1和0.001 mol·L-1NaCl时吸附量最大,吸附效果最好,0.1 mol·L-1NaCl时吸附效果最差,吸附在低离子强度时形成内表面络合物,高离子强度时形成外表面络合物。
(3)在不同pH的解吸液中,随着pH的增大解吸率逐渐减小,pH为3时解吸率最大。pH>5后四种土壤纳米颗粒的解吸率降低速率小,没有显著差异。
(4)解吸液离子强度越大Pb(Ⅱ)的解吸率越大,解吸液为蒸馏水时解吸率最小。四种土壤纳米颗粒解吸率大小顺序为风沙土纳米颗粒>塿土纳米颗粒>黑垆土纳米颗粒>黄绵土纳米颗粒。不同离子强度条件下最大解吸率小于pH条件下的最大解吸率。
参考文献:
[1]杨金燕,杨肖娥,何振立,等.土壤中铅的吸附-解吸行为研究[J].生态环境, 2005, 14(1):102-107. YANG Jin-yan, YANG Xiao-e, HE Zhen-li, et al. Advance in the studies of Pb adsorption and desorption in soils[J]. Ecology and Environmental Sciences, 2005, 14(1):102-107.
[2]乔冬梅,齐学斌,庞鸿宾,等.不同pH值条件下重金属Pb2+的吸附解吸研究[J].土壤通报, 2011, 42(1):38-41. QIAO Dong-mei, QI Xue-bin, PANG Hong-bin, et al. Effect of pH level on adsorption characteristics of Pb2+[J]. Chinese Journal of Soil Science, 2011, 42(1):38-41.
[3]何为红.重金属离子在粘土矿物-胡敏酸复合体上的吸附研究[D].南京:南京农业大学, 2007. HE Wei-hong. Adsorption of heavy metal on clay mineral-humic acid complexes[D]. Nanjing:Nanjing Agricultural University, 2007.
[4]梁晶,徐仁扣,蒋新,等.不同pH下两种可变电荷土壤中Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)吸附与解吸的比较研究[J].土壤, 2007, 39(6):992-995. LIANG Jing, XU Ren-kou, JIANG Xin, et al. Adsorption and desorption of Cu(Ⅱ), Pb(Ⅱ)and Cd(Ⅱ)in two variable charge soils different in pH[J]. Soils, 2007, 39(6):992-995.
[5]杨亚提,张一平.恒电荷土壤胶体对Cu2+、Pb2+的静电吸附与专性吸附特征[J].土壤学报, 2003, 40(1):102-109. YANG Ya-ti, ZHANG Yi-ping. The charactersitics of Cu2 +and Pb2+electrostatic and specific adsorptions of constant charge soil colloids[J]. Acta Pedologica Sinica, 2003, 40(1):102-109.
[6]杨亚提,张一平.土壤胶体表面吸附态铜的解吸动力学特征[J].土壤与环境, 2001, 10(3):181-184. YANG Ya-ti, ZHANG Yi-ping. Kinetics of copper desorption from constant charge soil colloid[J]. Soil and Environmental Sciences, 2001, 10 (3):181-184.
[7]杨亚提,张一平.离子强度对恒电荷土壤胶体吸附Cu2+和Pb2+的影响[J].环境化学, 2001, 20(6):566-571. YANG Ya-ti, ZHANG Yi-ping. Ionic strength effects on Cu2+, Pb2+adsorption in constant charge soil colloids[J]. Environmental Chemistry, 2001, 20(6):566-571.
[8]吴志坚,刘海宁,张慧芳.离子强度对吸附影响机理的研究进展[J].环境化学, 2010, 29(6):997-1003. WU ZHi-jian, LIU Hai-ning, ZHANG Hui-fang. Research progress on mechanism about the effect of ionic strength on adsorption[J]. Environmental Chemistry, 2010, 29(6):997-1003.
[9]周洪英,杨超喜. pH和离子强度对海藻吸附Pb2+的影响研究[J].广州化工, 2011, 39(8):45-47. ZHOU Hong-ying, YANG Chao-xi. Effect of pH and Ion strength for Pb2+biosorption onalgae[J]. Guangzhou Chemical Industry, 2011, 39(8):45-47
[10] Julita M P, Andrew H, Hanna P K. The interaction of heavy metals with urban soils:sorption behaviour of Cd, Cu, Cr, Pb and Zn with a typical mixed brown field deposit[J]. Environment International, 2005, 31:513-521.
[11]姚庆鑫,谢建军,刘军霞,等.离子强度对膨润土/木质素磺酸钠接枝丙烯酰胺-马来酸酐复合吸附树脂吸附Pb2+/Cu2+的影响[J].应用化学, 2015, 32(8):940-947. YAO Qing -xin, XIE Jian -jun, LIU Jun -xia, et al. Effect of ionic srength on the adsorption of Pb2+and Cu2+onto bentonite/sodium lignosulfonate graft-polymerized with acrylamide and maleic anhydride[J]. Journal of Applied Chemistry, 2015, 32(8):940-947.
[12]徐仁扣,肖双成,赵安珍.基于Zeta电位的水稻土吸附Pb(Ⅱ)和Cd(Ⅱ)能力的比较[J].环境化学, 2008, 27(6):742-745. XU Ren-kou, XIAO Shuang-cheng, ZHAO An-zhen. Comporison of adsorption abilities of three paddy soils for lead and cadmium based on zeta potential[J]. Environmental Chemistry, 2008, 27(6):742-745.
[13]朱丽珺,张金池,宰德欣,等.腐殖质对Cu2+和Pb2+的吸附特性[J].南京林业大学学报(自然科学版), 2007, 31(4):73-76. ZHU Li-jun, ZHANG Jin-chi, ZAI De-xin, et al. Study on the adsorption of heavy metal Cu2+, Pb2+by humus[J]. Journal of Nanjing Forestry University(Natural Sciences Edition), 2007, 31(4):73-76.
[14]朱丽珺,张金池,俞元春,等.胡敏酸吸附重金属Cu2+Pb2+Cd2+的特征及影响因素[J].农业环境科学学报, 2008, 27(6):2240-2245. ZHU Li-jun, ZHANG Jin-chi, YU Yuan-chun, et al. Characteristics and affecting factors of humic acid adsorbing heavy metals Cu2+Pb2+Cd2+[J]. Journal of Agro-Environment Science, 2008, 27(6):2240-2245.
[15]刘廷志,田胜艳,商平,等.蒙脱石吸附Cr3+、Cd2+、Cu2+、Pb2+、Zn2+的研究:pH值和有机酸的影响[J].生态环境, 2005, 14(3):353-356. LIU Ting-zhi, TIAN Sheng-yan, SHANG Ping, et al. Adsorption of heavy metals on Na-montmorillonite:Effects of pH and organic acid[J]. Ecology and Environmental Sciences, 2005, 14(3):353-356.
[16]鲍士旦.土壤农化分析[M].中国农业出版社, 2005. BAO Shi-dan. Soil and agricultural chemistry analysis[M]. China A-griculture Press, 2005.
[17]胡俊栋,沈亚婷,王学军.离子强度、pH对土壤胶体释放、分配沉积行为的影响[J].生态环境学报, 2009, 18(2):629-637. HU Jun-dong, SHEN Ya-ting, WANG Xue-jun. The effect of ionic strength and pH conditions on the release, deposition and dispersibility behaviors of natural soil colloid[J]. Ecology and Environmental Sciences, 2009, 18(2):629-637.
[18]徐宁彤,谷思玉,闫红.酸碱度对重金属镉,铜,锌在黑土中吸附解吸行为的影响[J].黑龙江水利科技, 1989, 4:62-64. XU Ning-tong, GU Si-yu, YAN Hong. The effect of pH value of heavy metal cadmium, copper, zinc in the black soil adsorption desorption behavior[J]. Heilongjiang Science and Technology of Water Conservancy, 1989, 4:62-64.
[19] Basta N T, Tabatabai M A. Effect of cropping systems on adsorption of metals by soils:Ⅱ. Effect of pH[J]. Soil Science, 1992, 153(3):195-204.
[20]陈苏,孙丽娜,晁雷,等.不同浓度组合的镉、铅在不同污染负荷土壤中的吸附-解吸动力学行为[J].应用基础与工程科学学报, 2007, 1(15):33-44. CHEN Su, SUN Li-na, CHAO Lei, et al. Sorption- desorption dynamic behavior of cadmium, lead with different concentrations combination in different metal burden soils[J]. Journal of Basic Science and Engineering, 2007, 1(15):33-44
[21]王未平,戴友芝,贾明畅,等.磁性海泡石表面零电荷点和吸附Cd2+的特性[J].环境化学, 2012, 31(11):1691-1696. WANG Wei-ping, DAI You-zhi, JIA Ming-chang, et al. Surface point of zero charge of magnetic sepiolite and adsorption characteristics of cadmium[J]. Environmental Chemistry, 2012, 31(11):1691-1696.
[22]张磊,宋凤斌,崔良,等.根际效应下镉在土壤中的吸附与解吸[J].农业环境科学学报, 2007, 26(4):1427-1431. ZHANG Lei, SONG Feng-bin, CUI Liang, et al. Adsorption and desorption of cadmium in soil with rhizosphere effects[J]. Journal of Agro-Environment Science, 2007, 26(4):1427-1431.
[23]徐洁,侯万国,周维芝,等.东北草甸棕壤对重金属铅的吸附行为研究[J].山东大学学报:理学版, 2007, 42(5):50-54. XU Jie, HOU Wan-guo, ZHOU Wei-zhi, et al. Sorption of lead on meadow brown soil in the Northeast of China[J]. Journal of Shandong University:Natural Science, 2007, 42(5):50-54.
[24] Dixon J B,朱永官.土壤中粘粒的作用[J].土壤学进展, 1992, 20 (3):33-35. Dixon J B, ZHU Yong-guan. Applied clay science[J]. Progress in Soil Science, 1992, 20(3):33-35.
[25] Abate G, Masini J C. Influence of pH, ionic strength and humic acid on adsorption of Cd(Ⅱ)and Pb(Ⅱ)onto vermiculite[J]. Colloids and Surfaces, 2005, 262(1):33-39.
[26]吴敏,刘振,朱睿,等.腐殖土对废水中Cu2+的吸附[J].同济大学学报(自然科学版), 2013, 41(2):240-246. WU Min, LIU Zhen, ZHU Rui, et al. Adsorption of Cu2+in wastewater on humus soil[J]. Journal of Tongji University(Natural Science), 2013, 41(2):240-246.
Adsorption-desorption of Pb(Ⅱ)on natural soil nanoparticles:Effects of pH and ionic strength
AN Wei-qiang1, SUN Hui-min1,2, LÜ Jia-long1,2*, YIN Xian-qiang1,2*, WEI Ge-hong3, LI Jun1
(1.College of Natural Resources and Environment, Northwest A&F University, Yangling 712100, China; 2.Key Laboratory of Plant Nutrition and the Agri-environment in Northwest China, Ministry of Agriculture, Yangling 712100, China; 3.College of Life Science, Northwest A&F University, Yangling 712100, China)
Abstract:Nanoparticles may play an important role in adsorption-desorption of heavy metals because of small sizes and huge surface area. In this study, natural soil nanoparticles were extracted from four typical soils, and adsorption and desorption of Pb(Ⅱ)by natural soil nanoparticles were investigated under different pH and ionic strengths(IS). Results showed that amount of adsorbed Pb(Ⅱ)on four different soil nanoparticles increased along with increases of pH when pH was lower than 3. Amount of Pb adsorption by four soil nanoparticles was in order of loessal soil>lou soil>aeolian sandy soil>black loam soil nanoparticles. Under different IS, adsorption rates of Pb by four soil nanoparticles varied greatly. The adsorption amount of Pb(Ⅱ)in 0.01 mol·L(-1)NaCl solution was highest, but lowest in 0.1 mol·L(-1)NaCl solution. The inner surface adsorption complex was formed at low IS, while the outer surface complex happened at high IS. The desorption rates of Pb decreased as pH values increased, with the highest desorption found at pH 3. In different IS solutions, the Pb desorption rates increased with increasing IS. The Pb desorption rates in four soil nanoparticles decreased in order of aeolian sandy soil colloid>lou soil colloid>black loam soil colloid>loessal soil colloid.
Keywords:pH; ionic strength; natural soil nanoparticle; adsorption; desorption
*通信作者:吕家珑E-mail:ljlll@nwsuaf.edu.cn;殷宪强E-mail:xianqiangyin@yahoo.com;
作者简介:安伟强(1991—),男,青海黄南州同仁县人,硕士研究生,主要从事土壤化学方面的研究工作。E-mail:ancn@vip.qq.com
基金项目:国家高技术研究发展计划(863计划,2012AA101402);国家自然科学基金(21207106,21207107);陕西省自然科学基础研究计划项目(2012JQ5012,2014JQ5184);中央高校基本科研业务专项(QN2011151,QN2011017)
收稿日期:2015-10-26
中图分类号:X131.3
文献标志码:A
文章编号:1672-2043(2016)03-0463-08
doi:10.11654/jaes.2016.03.008

