脊髓损伤后慢性中枢性疼痛大鼠血管内皮生长因子及一氧化氮合酶表达
陈锡栋 张凤林 黄 翔 谢逐月
(遵义医学院附属医院康复科,贵州 遵义 536000)
脊髓损伤后慢性中枢性疼痛大鼠血管内皮生长因子及一氧化氮合酶表达
陈锡栋张凤林黄翔谢逐月
(遵义医学院附属医院康复科,贵州遵义536000)
〔摘要〕目的探讨大鼠脊髓损伤后慢性中枢性疼痛血管内皮生长因子(VEGF)和一氧化氮合酶(NOS)表达变化。方法120只大鼠随机分为单纯椎板切除组(对照组)、脊髓损伤组(损伤组)、脊髓损伤后法舒地尔组(治疗组)。免疫组化检测脊髓损伤后1、3、7、14、21 d VEGF和NOS的表达;Western印迹法检测各组各个时间点VEGF的表达。结果治疗组BBB评分明显优于损伤组(P<0.05)。免疫组化:脊髓损伤后VEGF的表达升高,于3 d达到高峰,然后下降;治疗组VEGF的表达较损伤组降低(P<0.05)。脊髓损伤后NOS的表达升高,7 d达到高峰,然后下降;治疗组NOS的表达较损伤组增高(P<0.05)。Western印迹法结果:脊髓损伤后VEGF的表达升高,于3 d达到高峰,然后下降;治疗组VEGF的表达较损伤组降低。结论法舒地尔可以下调脊髓损伤后慢性中枢性疼痛大鼠VEGF的表达并上调NOS的表达,促进病症恢复。
〔关键词〕脊髓损伤;法舒地尔;血管内皮生长因子(VEGF);一氧化氮合酶(NOS)
目前研究认为中枢神经系统(CNS)损伤后微环境中的抑制因子对神经元的再生起重要的抑制作用,这些因子主要是髓鞘相关抑制物(MAIs)〔1〕。研究发现MAIs通过激活Rho/Rho相关激酶(ROCK)通路,活化的血管内皮生长因子(VEGF)引起神经元生长锥的塌陷从而抑制轴突再生〔2〕。一氧化氮合酶(NOS)是目前最能反映中枢神经元再生的标志性蛋白分子〔3〕。法舒地尔是目前临床唯一可用的ROCK选择性抑制剂,由于ROCK参与了细胞分化与迁移、细胞平滑肌收缩、细胞骨架的重构等多种细胞功能〔4〕,因此法舒地尔可以通过抑制ROCK从而发挥广泛而不同的药理作用。本文拟通过探讨法舒地尔对大鼠脊髓损伤后慢性中枢性疼痛VEGF和NOS表达影响。
1材料与方法
1.1实验材料清洁级SD大鼠(上海斯莱克实验动物公司)120只,体重200~220 g,雌雄不限。日本Olympus显微镜、德国Leica RM2245超薄切片机、灭菌锅、液氮罐、漂片机、烤箱、温控摇床、高速离心机、微量移液器、紫外分光光度仪、垂直板电泳转移装置、双垂直电泳槽(福建医科大学附属第一医院中心实验室提供)。盐酸法舒地尔注射液(川威),规格30 mg/支(天津红日药业股份有限公司,批号H20040356)、兔抗大鼠VEGF一抗、兔抗NOS抗体(Santa Cruz,美国);Polink-2puls免疫组化试剂盒、二氨基联苯胺(DAB)显色试剂盒、Harris苏木素液、丽春红染色试剂(北京中杉公司);聚偏二氟乙烯膜(PVDF)(MILLIPORE)(北京普利莱生物公司)。
1.2动物分组随机分为单纯椎板切除术切除组(对照组),脊髓损伤组(损伤组),脊髓损伤后慢性中枢疼痛治疗组(治疗组),各40只。1、3、7,14,21 d 5个时间点被分成两组,每亚组8只大鼠。脊髓损伤后治疗慢性中枢疼痛1 h处理腹腔内注射盐酸法舒地尔注入10 mg·kg-1·24 h-1,连续14 d。损伤组和对照组注射生理盐水,管理方法和剂量相同的治疗组。
1.3脊髓损伤动物模型的建立采用Allen重量法。老鼠的腹腔内注射10%水合氯醛麻醉(3~4 ml/kg)。麻醉成功之后,老鼠容易固定在手术台上,在无菌条件下T10集中为切口,咬除T9~11棘突和叶片暴露脊髓和硬膜外;对照组不损伤脊髓组织。损伤组和治疗组用重力打击装置,用质量10 g的金属砝码于5 cm高处,通过玻璃导向管自由坠落,撞击置于硬脑膜上的圆柱形撞击杆,造成脊髓的T10段损伤。成功的标准模型:鼠尾痉挛性摇摆和持续几秒钟,双下肢瘫痪和形状后和身体收缩颤动。硬脑膜的瘀紫,双下肢的复苏表现完全瘫痪。人工排尿和术后护理。
1.4疼痛检测疼痛检测运用热辐射-甩尾法。第一步把实验鼠固定,放置在特别制作的塑料筒当中,将尾巴露出在外,同时保持自然、下垂的状态,等待鼠安静20 min左右再进行测定。运用辐射热源18.5 V,可随意调节,采用8.75 mm放映式灯泡,通过透镜聚焦,之后发射φ=4 mm的灯光束,主要照射尾部中下1/3的交界处皮肤,其光源要和尾部的皮肤紧紧相贴。用计时器(光源并联电子计时器)进行同步记录,记录下照射的持续时间。当照射开始时,同时将秒表启动,当动物的尾巴部分出现了躲闪的情况时要关闭光源,在同时停止计时。这里所记录的时间间隔就是甩尾反应潜伏期(TFL)。
在正式测量前,要先进行电压调节,让TFL值保持在4~6 s,之后第5分钟测定一次,取3次测定平均值作为基础伤害性感受阈。如果鼠在镇痛的作用下,TFL延长至超过了15 s,那么要停止照射,并且将15 s当成是甩尾潜伏期的峰值,避免照射的时间过长而伤害皮肤。
1.5神经功能评分取左右两肢脊髓神经功能(BBB)评分平均值,作为每只大鼠的神经功能评分。由两名熟悉BBB评分标准的非实验人员进行评分,并详细记录。
1.6HE染色和免疫组化取材及切片准备各组分别于术后5个时间点取材,麻醉下剖胸,切取打击处上下各0.5 cm,全长约1 cm,放入4%多聚甲醛溶液中固定过夜,石蜡包埋,片厚5 μm连续切片,行HE染色,光学显微镜检查。
1.7Western印迹蛋白取材及保存各组分别于术后5个时间点行断头处死后在严格无菌操作下快速冰上剥离切取损伤段脊髓组织打击处上下各0.5 cm,全长约1 cm,放入液氮罐保存后转移至-70℃冰箱,用来提取蛋白质。
1.8免疫组化检测VEGF和NOS的表达取石蜡切片行免疫组织化学染色。切片常规脱蜡至水;高压锅煮沸法修复抗原3 min(枸橼酸盐缓冲液);磷酸盐缓冲液(PBS)冲洗3次每次2 min;3%H2O2去离子水孵育10 min后滴加过氧化物酶;PBS冲洗3次每次2 min,滴加相应一抗,4℃过夜;PBS冲洗3次每次2 min;滴加试1(Polymer Helper 即用型)后室温孵育15 min;PBS冲洗3次每次2 min;滴加试剂2(poly-HRP抗鼠/兔IgG即用型)后室温孵育15 min;PBS冲洗3次每次2 min;滴加DAB溶液显色1 min;蒸馏水冲洗3次每次2 min;苏木素核染0.5~1 min,自来水冲洗复染;梯度酒精脱水、二甲苯透明、中性树胶封片;于损伤处为中心取视野光镜下观察蛋白的表达情况,各实验组对比。以统一标本0.01 mmol/PBS缓冲液代替一抗作空白对照。
1.9Western印迹法测定VEGF蛋白的表达-70℃冰箱冻存脊髓组织加细胞裂解液(按每100 mg组织加入1 ml裂解液),于冰上孵育后快速匀浆。在4℃下,以12 000 r/min,离心5 min后分装上清液,测定蛋白浓度,取等量蛋白样品50 μg行8% SDS-聚丙烯酰胺凝胶电泳(PAGE),然后将蛋白转移至PVDF膜上,用溶有5%脱脂奶粉的洗涤缓冲液(TBST)封闭PVDF膜,放入温控摇床(37℃)轻摇1 h;PVDF膜剪成适应大小,加入溶有5%脱脂奶粉的TBST稀释VEGF一抗(1∶500),PVDF膜于4℃下孵育过夜;加入溶有5%脱脂奶粉的TBST稀释的相应二抗(1∶2 000),放入温控摇床(37℃)轻摇1 h;化学发光显影及定影,扫描胶片后检测和分析目的条带的灰度值。
1.10统计学方法采用SPSS17.0统计软件包进行单因素方差分析。
2结果
2.1行为学观察结果与对照组相比,损伤组和治疗组的BBB评分在各个时间点均降低(P<0.05)。损伤组和治疗组运动功能随着时间的变化均有所恢复;但治疗组BBB评分高于损伤组,在损伤后7、14及21 d两组差异有统计学意义(P<0.05)。见表1。

表1 各组各时间点BBB评分,分,n=8)
与对照组比较:1)P<0.05;与治疗组比较:2)P<0.05;下表同
2.2HE染色观察结果脊髓损伤后慢性中枢性疼痛2 w后大鼠脊髓结构见图1。对照组脊髓组织结构轮廓清晰,神经元结构较完整;损伤组脊髓组织结构紊乱、疏松,可见较明显的结构空白区,胶质瘢痕组织形成,神经元结构不完整;治疗组脊髓组织结构轮廓较损伤组清晰,坏死区域及胶质瘢痕组织均较脊髓损伤组少。
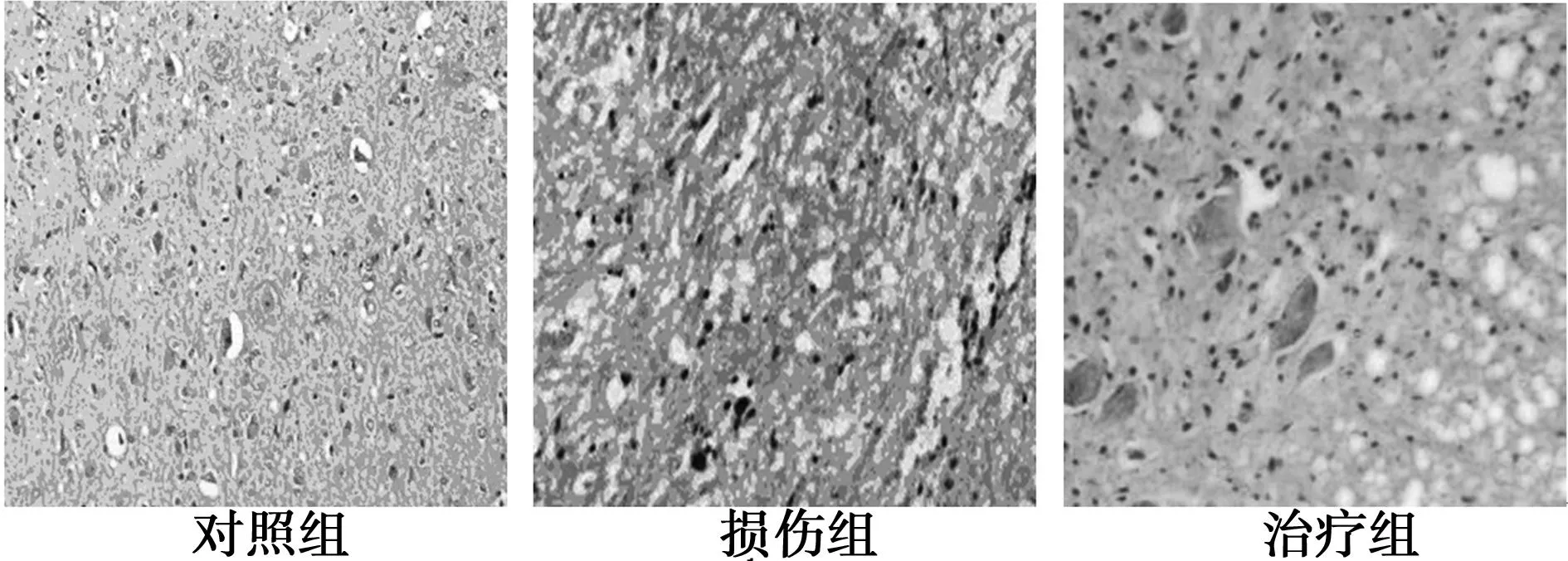
图1 脊髓损伤后慢性中枢性疼痛2 w后大鼠脊髓结构(HE染色,×200)
2.3VEGF免疫组织化学检测结果见表2。VEGF在各组各时间点均有阳性表达,在光镜观察下,胞质呈棕色或棕褐色者为阳性,而阴性对照组胞质呈蓝色,无棕色或棕褐色表现。术后对照组VEGF有少量表达,随时间变化无统计学意义(P>0.05);损伤组1 d后VEGF表达即开始增高,于3 d达到高峰,随后逐渐下降;与对照组相比,损伤组和治疗组VEGF表达增
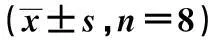
表2 各组各时间点VEGF表达的平均光密度
高,两组1、3及7 d差异有统计学意义(P<0.05);与损伤组相比,治疗组VEGF的表达减少,两组于1、3、7及14 d差异有统计学意义(P<0.05)。
2.4NOS免疫组化结果NOS在各组各时间点均有阳性表达,在光镜观察下,胞质呈棕色或棕褐色者为阳性,而阴性对照组胞质呈蓝色,无棕色或棕褐色者表现。免疫组化检测结果显示:对照组胞质颗粒染浅棕色,为弱阳性表达;损伤组胞质颗粒染棕色,为阳性表达;治疗组胞质颗粒染棕褐色,为强阳性表达,表达较损伤组强。术后对照组NOS有少量表达,随时间变化无统计学意义(P>0.05);脊髓损伤1 d后NOS表达即开始增高;与损伤组相比,治疗组NOS表达升高,两组于7、14、21 d差异有统计学意义(P<0.05)。见表3,图2。

图2 脊髓损伤后慢性中枢性疼痛7 d各组的NOS表达(DAB染色,×400)
时间对照组损伤组治疗组1d0.219±0.0180.225±0.0202)0.230±0.0213d0.205±0.0170.285±0.0251)2)0.295±0.0227d0.200±0.0150.365±0.0381)2)0.552±0.0291)14d0.204±0.0160.285±0.0251)2)0.425±0.0201)21d0.203±0.0150.210±0.0182)0.375±0.0191)
2.5VEGF蛋白Western印迹检测结果见表4和图3。各组各时间点均可检测出VEGF的表达,对照组VEGF有少量表达,
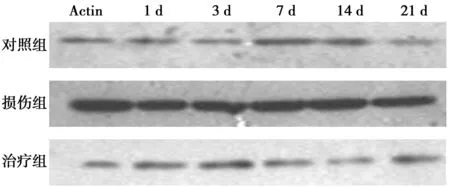
图3 各组各时间点VEGF蛋白Western印迹结果
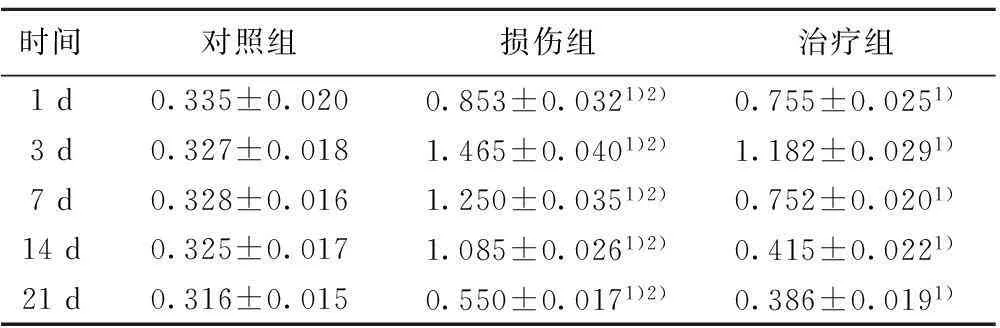
时间对照组损伤组治疗组1d0.335±0.0200.853±0.0321)2)0.755±0.0251)3d0.327±0.0181.465±0.0401)2)1.182±0.0291)7d0.328±0.0161.250±0.0351)2)0.752±0.0201)14d0.325±0.0171.085±0.0261)2)0.415±0.0221)21d0.316±0.0150.550±0.0171)2)0.386±0.0191)
随时间变化无统计学意义(P>0.05);脊髓损伤1 d后VEGF表达即开始增高,于3 d达到高峰,随后逐渐下降,至7 d仍高于对照组;治疗组表达低于损伤组。三组差异于各时间点均有统计学意义(P<0.05)。
3讨论
脊髓损伤后慢性中枢性疼痛的病理过程可分为原发性和继发性损伤。脊髓继发性损伤后由于脊髓组织发生出血水肿、免疫炎症反应及毒性物质沉,继而出现神经元坏死和凋亡、轴突脱髓鞘改变,最终形成胶质瘢痕组织〔5〕。由于脊髓损伤后慢性中枢性疼痛出现了上述改变,从而不利于神经元轴突的再生和功能的恢复。轴突生长抑制因子主要是通过结合共同受体即Nogo-66受体1(NgR1),进而激活小GTP酶ras同源基因家族成员(Rho),活化的Rho进而激活ROCK〔6〕。Rho激酶全称是Rho相关卷曲螺旋形成蛋白激酶,广泛分布于人体各种组织,主要存在于细胞质,调整细胞骨架运动,以两种同源性极高的异构体存在:ROCK1和VEGF,在神经系统中主要是VEGF。VEGF抑制剂如布洛芬、Y27632等通过抑制VEGF的活性而阻断Rho信号转导通路,可以促进成年大鼠脊髓损伤后慢性中枢性疼痛神经元轴突的再生和运动功能的恢复〔7〕。本实验研究提示脊髓损伤后慢性中枢性疼痛VEGF表达上调而发挥抑制轴突再生的作用;法舒地尔可以通过抑制VEGF而促进脊髓损伤后慢性中枢性疼痛的轴突再生和功能的恢复。
NOS(生长相关蛋白43)主要表达于神经元轴突生长锥质膜面,可通过促进肌动蛋白聚集,增强生长锥的活力而促进轴突生长〔8〕。研究表明,高表达NOS可以增强中枢神经元轴突的再生潜能,在生长锥中,NOS可促进肌动蛋白的聚集,使生长锥在形态上更具有活力,并抵抗其回缩,利于神经的发育及轴突的再生〔9〕。本实验结果提示法舒地尔可以通过上调NOS表达从而促进脊髓损伤后慢性中枢性疼痛的轴突再生和功能的恢复。法舒地尔为日本名古屋大学和旭化成株式会社合作研发的一种异喹啉磺酰类药物,1995年在日本首次应用于临床,主要用于防治脑血管痉挛和改善蛛网膜下腔出血的预后。于2004年我国批准了生产法舒地尔注射液,是目前临床唯一可用的ROCK选择性抑制剂。由于ROCK参与平滑肌收缩、细胞骨架的重构、细胞分化与迁移等多种细胞功能,因此法舒地尔可以通过制剂ROCK从而发挥广泛的药理作用。法舒地尔可以上调小鼠星形胶质细胞谷氨酸转运从而促进星形胶质细胞中的肌动蛋白重构〔10〕,ROCK抑制剂在体外可促进皮质脊髓束(CST)的出芽,同时在体内可改善CST受损大鼠的运动功能〔11〕,从而为法舒尔的应用开辟了新的思路,本实验也观察到ROCK抑制剂法舒地尔可促进改脊髓损伤后慢性中枢性疼痛大鼠轴突的再生及功能的恢复。
4参考文献
1Hiraga A,Kuwabara S,Doya H,etal.Rho-kinase inhibition enhances axonal regeneration after peripheral nerve injury〔J〕.J Peripher Nerv Syst,2014;11(3):217-24.
2Shao Z,Browning JL,Lee X,etal.TAJ/TROY,an orphan TNF receptor family member,binds Nogo-66 receptor 1 and regulates axonal regeneration〔J〕.Neuron,2012;45(3):353-9.
3Viberg H,Mundy W,Eriksson P.Neonatal exposure to decabrominated diphenyl ether(PBDE 209)results in changes in BDNF,CaMKⅡ and NOS,biochemical substrates of neuronal survival,growth and synaptogenesis〔J〕.Neurotoxicology,2008;29(1):152-9.
4孟祥军.盐酸法舒地尔的合成、药理和临床研究进展〔J〕.沈阳医学院学报,2010;12(1):45-50.
5Hagg T,Oudega M.Degenerative and spontaneous regenerative processes after spinal cord injury〔J〕.J Neurotrauma,2006;23(3-4):264-80.
6Llorens F,Gil V,del Rio JA.Emerging functions of myelin-associated proteins during development,neuronal plasticity and neurodegeneration〔J〕.FASEB J,2011;25(2):463-75.
7Wang X,Budel S,Baughman K,etal.Ibuprofen enhances recovery from spinal cord injury by limiting tissue loss and stimulating axonal growth〔J〕.J Neurotrauma,2009;26(1):81-95.
8Siddiq MM,Hannila SS,Carmel JB,etal.Metallothionein-Ⅰ/Ⅱ promotes axonal regeneration in the central nervous system〔J〕.J Biol Chem,2015;290(26):16343-56.
9Huo Y,Yin XL,Ji SX,etal.Amino-Nogo inhibits optic nerve regeneration and functional recovery via the integrin αv signaling pathway in rats〔J〕.Cell Physiol Biochem,2015;35(2):616-26.
10Lau CL,O'Shea RD,Broberg BV,etal.The Rho kinase inhibitor Fasudil up-regulates astrocytic glutamate transport subsequent to actin remodelling in murine cultured astrocytes〔J〕.Br J Pharmacol,2011;163(3):533-45.
11Hiraga A,Kuwabara S,Doya H,etal.Rho-kinase inhibition enhances axonal regeneration after peripheral nerve injury〔J〕.J Peripher Nerv Syst,2014;11:217-24.
〔2014-12-19修回〕
(编辑苑云杰)
〔中图分类号〕R744.9
〔文献标识码〕A
〔文章编号〕1005-9202(2016)07-1589-04;
doi:10.3969/j.issn.1005-9202.2016.07.023
基金项目:遵义市卫生局科技计划项目(No.30300099)
第一作者:陈锡栋(1977-),男,硕士,主治医师,主要从事康复研究。

