有氧运动对轻中度阿尔茨海默病患者生活能力、认知功能和精神症状的影响
母海艳,吕继辉,郝智慧,李文杰,李 沫
(北京老年医院精神心理2科,北京 100095)
阿尔茨海默病(Alzheimer’s disease,AD)是以进行性智能衰退为特征的一种神经系统变性疾病,因其高发病率、高致残率越来越受到人们的关注。张振馨等[1]研究显示,中国>65岁老年人AD的患病率达4.8%。美国最近的研究报告显示,2010年美国有AD患者470万,并预计至2050年将增至1380万[2]。现有药物并未达到延缓疾病进程和(或)治疗疾病的目的。自2003年以来,尚无一种治疗AD的新药获美国食品药物管理局(Food and Drug Administration,FDA)批准上市[3]。精神行为异常(behavioral and psychological symptoms of dementia,BPSD)是AD患者的常见症状,不管是传统抗精神病药物还是新型非经典抗精神病药物对BPSD治疗效果均不理想,且副作用常见, 近年来一些非药物治疗措施逐渐引起人们的重视。部分研究者将运动干预方式用于AD的研究领域,取得了重要的研究成果。适宜的有氧运动不仅能改善患者的健康状况,还能提高其认知功能[4]。在卫生保健财务管理研究(Health Care Financing Administration,HCFA)调查的13种体力活动中,步行和远足是与降低AD发生风险关联性最强的两种活动[5]。本研究将一定强度的有氧运动(快步行走)作为一种非药物治疗手段,观察其对轻、中度AD患者认知、情绪及日常生活能力的影响。
1 对象与方法
1.1 研究对象
收集2013年6月至2014年12月在北京老年医院痴呆病房住院的AD患者78例。入组标准:年龄65~80岁;符合美国国立神经疾病、语言交流障碍、满足卒中研究所-AD及相关疾病学会可能或很可能AD诊断标准;临床痴呆量表(Clinical Dementia Rating,CDR)对痴呆严重程度评定为轻度(CDR=1.0)或中度(CDR=2.0);获得患者监护人的知情同意;可配合完成所有研究项目,并有能力独自或在护理员的帮助下完成研究任务。排除标准:血管性痴呆、路易体痴呆、额颞叶痴呆、帕金森病痴呆及中枢神经系统其他疾患所致痴呆(如脑肿瘤、多发性硬化、脑炎、癫痫、正常颅内压脑积水等);代谢及营养缺乏所致痴呆(如甲状腺功能异常、持续性低血糖、维生素B12缺乏、叶酸缺乏等);酗酒、药物滥用及其他已知可能导致痴呆的疾病;过去3个月内有急性感染、外伤、心肌梗死等急症;严重躯体疾病不能耐受或配合研究;听力严重受损;严重语言障碍不能配合研究;体质量<40 kg;血压<90/60 mmHg(1 mmHg=0.133 kPa)或>160/100 mmHg,或患者入组前2周收缩压或舒张压波动>30 mmHg;按时间顺序入组后,根据随机数字表法分为有氧运动(快步行走)组和对照组,每组患者各39例。
1.2 治疗方法
有氧运动组干预方法:选择快步行走的方式,在病房花园沿圈道快步行走,圈道长约400 m,要求患者在8 min内走完1圈,每日≥60 min。根据老人具体情况分2~3次进行,≥20 min/次,自愿结伴,2~4人为1组,≥3次/周,累计运动时间≥200 min,连续进行16周。有工娱治疗师为每名患者记录每次具体的运动时间,保证每名患者完成每周的运动计划。对照组维持原有的生活习惯、饮食指导、日常生活护理,不参与上述运动干预。
1.3 评定工具及疗效评定
日常生活能力评估采用巴氏指数(Barthel index,BI)。BI是康复医学界最常用的测评患者日常生活能力的量表,内容包括10个项目:排便、排尿、修饰、如厕、进食、转移、运动、穿衣、洗澡及上下楼梯。每次测量5~10 min,满分100分,得分越高,独立性越好,依赖性越小。
认知功能评定采用简易智能精神状态检查量表(Mini-Mental State Examination,MMSE)[6]。MMSE内容包括时间定向、地点定向、语言即刻记忆、注意和计算,短时记忆、物理命名、语言复述、阅读理解、言语表达及图形描绘。MMSE总分范围0~30分,分值越低,认知功能受损程度越重。
采用国际通用的神经精神科量表(Neuropsychiatric Inventory,NPI)[7]对痴呆的BPSD进行评估。NPI由12个行为领域构成:妄想、幻觉、激越/攻击、抑郁/心境恶劣、焦虑、情感高涨/欣快、情感淡漠/漠不关心、脱抑制、易激惹/情绪不稳、异常的运动行为、睡眠/夜间行为和食欲和进食障碍。分数越高,患者的精神行为症状越重。
1.4 统计学处理
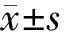
2 结 果
2.1 一般资料
共入组患者78例,其中对照组39例,包括轻度痴呆14例(35.9%)和中度痴呆25例(64.1%);服用胆碱酯酶抑制剂患者34例(87.2%)、石杉碱甲片者5例(12.8%)。有氧运动组39例,包括轻度痴呆15例(38.5%)和中度痴呆24例(61.5%),服用胆碱酯酶抑制剂患者35例(89.7%)、石杉碱甲片者4例(10.3%)。两组患者性别、年龄、病程、体质量、收缩压、舒张压比较,差异均无统计学意义(P>0.05;表1)。
2.2 两组治疗前后BI比较
治疗前两组患者BI差异无统计学意义(P>0.05)。治疗16周后,对照组BI较前下降(P<0.05); 而有氧运动组BI较治疗前无明显变化(P>0.05);两组治疗后BI差异具有统计学意义(P<0.05;表2)。

表1 两组一般临床资料比较
SBP: systolic blood pressure; DBP: diastolic blood pressure. 1 mmHg=0.133 kPa
2.3 两组治疗前后MMSE评分比较
治疗前两组患者MMSE评分差异无统计学意义(P>0.05)。治疗16周后,有氧运动组MMSE较治疗前升高(P<0.05);对照组与治疗前比较无明显变化(P>0.05);有氧运动组治疗后MMSE较对照组高,差异有统计学意义(P<0.05;表3)。
2.4 两组治疗前后NPI得分比较
治疗前两组NPI评分差异无统计学意义(P>0.05)。治疗16周后,有氧运动组NPI得分较治疗前下降(P<0.05);对照组较治疗前无明显变化(P>0.05);有氧运动组治疗后NPI得分低于对照组,差异具有统计学意义(P<0.05;表4)。

表2 两组治疗前后BI比较
BI: Barthel index. Compared with before treatment,*P<0.05; compared with exercise group,#P<0.05

表3 两组治疗前后MMSE评分比较
MMSE: Mini-Mental State Examination. Compared with before treatment,*P<0.05; compared with control group,#P<0.05
3 讨 论
AD是老年人常见的神经系统变性性疾病,目前药物治疗方面多年无突破性进展,而非药物治疗手段逐渐受到人们的关注。多项研究表明,包括体力活动在内的综合干预措施不仅能预防、延缓AD的发展,还可防止AD患者行为障碍、行动不便甚至跌倒等情况的发生[8],提高体力活动水平可使老年人在心肺功能、肌力和耐力、柔韧协调能力以及认知能力等多方面获益。

表4 两组治疗前后NPI得分比较
NPI: Neuropsychiatric Inventory. Compared with before treatment,*P<0.05; compared with control group,#P<0.05
体力活动可改善AD患者的日常生活能力。Garuffi等[9]将34名老年人随机分成运动组(抗阻练习)和社会活动组(静态活动,如书写、阅读等)进行为期16周的训练。结果表明运动组老年人在登楼梯、步行、从地上站起和穿袜子等测试上显著好于社会活动组。本研究通过对运动组患者进行为期16周的有氧运动(快步行走)发现,有氧运动组BI偏高,说明有氧运动(快步行走)可改善AD患者的日常生活能力,提高患者的生活质量。
体力活动能延缓AD患者认知功能的衰退。澳大利亚老龄化脑健康研究将170名记忆力减退或患有轻度认知功能障碍的研究对象分为运动组和对照组[10]。运动组受试者每次进行50 min的步行或其他中等强度有氧运动,3次/周、持续6个月;对照组保持原有的习惯生活。研究结果显示,运动组的认知评分略有提高,而对照组的认知功能按照正常速度老化下降,而且在干预结束12个月后,运动组的认知评分仍较高[10]。Colcombe等[11]报道,3次/周、1 h/次,持续6个月的有氧运动能增加脑容量。有研究对老年人进行3次/周步行或其他中等强度有氧运动能使大脑海马区体积增加,有利于延缓大脑功能的衰退[12]。本研究对轻、中度AD患者进行为期16周的有氧运动(快步行走),其MMSE评分较治疗前有所提高,而对照组患者MMSE评分较治疗前略有下降。这和其他研究的结果类似。说明有氧运动可作为一种有效的非药物治疗方式,对AD患者的认知功能衰退起到延缓作用。
Maci等[13]研究表明,体力活动能显著改善AD患者的冷漠、焦虑、抑郁等情绪。AD患者患病后由于各方面的限制,社会活动越来越少,参加集体锻炼可同时获得社交活动和体育锻炼所带来的双重好处。在本研究中,对患者进行运动干预采取小组形式进行,便于患者在运动的同时又可相互交流,有助于患者在回忆过去中锻炼记忆功能,提高自我认同感,改善负性情绪。在对患者进行16周的运动干预后,患者的NPI评分较前明显改善,尤其在抑郁、失眠、食欲等方面的改善较为明显。
综上所述,有氧运动对轻、中度AD患者的日常生活能力、认知及精神行为方面均有改善作用。运动有利于身体健康已得到人们的普遍认可,快步行走简单、易行,是一种比较适合老年人的运动方式,可作为一种可行的,有价值的干预措施进行推广。
【参考文献】
[1] Zhang ZX, Zahner GE, Román GC,etal. Dementia subtypes in China: prevalence in Beijing, Xi’an, Shanghai, and Chengdu[J]. Arch Neurol, 2005, 62(3): 447-453.
[2] Hebert LE, Weuve J, Scherr PA,etal. Alzheimer’s disease in the United States(2010-2050) estimated using the 2010 census[J]. Neurology, 2013, 80(19): 1778-1783.
[3] Galvin JE. Optimizing diagnosis and manangement in mild-to-moderate Alzheimer’s disease[J]. Neurodegener Dis Manag, 2012, 2(3): 291-304.
[4] Sofi F, Valecchi D, Bacci D,etal. Physical activity and risk of cognitive decline: a meta-analysis of prospective studies[J]. J Intern Med, 201l, 269(1): 107-117.
[5] Scarmeas N, Levy G, Tang MX,etal. Influence of leisure activity on the incidence of Alzheimer’s disease[J]. Neurology, 2001, 57(12): 2236-2242.
[6] Zhang MY. The Handbook of Psychiatric Rating Scale[M]. 2nd ed. Changsha: Hunan Science and Technology Press, 1993: 81-95.[张明园. 精神科评定量表手册[M]. 第2版. 长沙: 湖南科技出版社, 1993: 81-95.]
[7] APA Work Group on Alzheimer’s Disease and other Dementias, Rabins PV, Blacker D,etal. American Psychiatric Association practice guideline for the treatment of patients with Alzheimer’s disease and other dementias. Second edition[J]. Am J Psychiatry, 2007, 164(12 Suppl): 5-56.
[8] Mortimer JA, Ding D, Borenstein AR,etal. Changes in brain volume and cognition in a randomized trial of exercise and social interaction in a community-based sample of non-demented Chinese elders[J]. J Alzheimers Dis, 2012, 30(4): 757-766.
[9] Garuffi M, Costa JL, Hernández SS,etal. Effects of resistance training on the performance of activities of daily living in patients with Alzheimer’s disease[J]. Geriatr Gerontol Int, 2013,13(2): 322-328.
[10] Lautenschlager NT, Cox KL, Flicker L,etal. Effect of physical activity on cognitive function in older adults at risk for Alzheimer disease: a randomized trial[J]. JAMA, 2008, 300(9): 1027-1037.
[11] Colcombe SJ, Erickson KI, Scalf PE,etal. Aerobic exercise training increases brain volume in aging humans[J]. J Gerontol A Biol Sci Med Sci, 2006, 61(11): 1166-1170.
[12] Erickson KI, Voss MW, Prakash RS,etal. Exercise training increases size of hippocampus and improve memory[J]. Proc Natl Acad Sci USA, 2011, 108(7): 3017-3022.
[13] Maci T, Pira FL, Quattrocchi G,etal. Physical and cognitive stimulation in Alzheimer’s disease. The GAIA Project: a pilot study[J]. Am J Alzheimer’s Dis Other Demen, 2012, 27(2): 107-113.

