胎鼠海马神经元培养方法的改进及鉴定
王 越,王士博,于晓雯,杨 玲,拓西平
胎鼠海马神经元培养方法的改进及鉴定
王 越,王士博,于晓雯,杨 玲,拓西平*
(第二军医大学附属长海医院老年病科,上海 200433)
优化海马神经元原代培养方法。取孕17~18d胎鼠海马,经过剪碎、消化、离心和吹打过滤后种板,根据孵育后更换为无血清培养基的时间不同分为A组和B组。A组4h后更换,B组12h后更换。观察并记录第2、3、4、5天两组神经元生长状况,并于第7d用神经元特异性烯醇化酶荧光染色法鉴定神经元,计算其纯度。(1)4~6h后细胞已贴壁生长,2d后胞体增大,3d时突起长出,5d后突起变长变粗并有分支形成,相互连接呈网状。(2)7d后行免疫荧光染色,为阳性结果,证实为神经元,且A组神经元纯度显著高于B组(<0.05)。改进后的方法可培养出生长状况良好且纯度更高的神经元。
神经元;培养;胎鼠
医学科研工作离不开相关的疾病模型,用于探究神经元功能障碍和退化机制的模型主要有动物和细胞培养模型两种。动物模型可用于神经元发育[1]和退化方面[2]的研究,但由于神经系统内在的复杂性,无法从分子学、生物学和结构观察上进行详细的研究。原代神经元培养所形成的细胞模型可弥补这方面的缺陷,是进行深入研究的合适工具。本研究在传统培养方法的基础上,通过实验进一步改进完善,建立了一种简单可行的原代神经元培养方法,可进一步应用于制造神经系统疾病细胞模型。
1 材料与方法
1.1 材料
孕龄17~18d的SD大鼠,由第二军医大学实验动物中心提供。特级胎牛血清(BIOSUN公司),Dulbecco’s Modified Eagle Medium/Nutrient Mixture F-12(DMEM/F-12)、Neurobasal Medium、B27添加剂(均Gibco公司),胰蛋白酶和多聚−L−赖氨酸(均Sigma公司),青霉素−链霉素溶液(双抗;HyClone公司,4’,6−二脒基−2−苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)、神经元特异性烯醇化酶(neuron specific enolase,NSE)一抗和荧光二抗(均谷歌生物公司)。
1.2 原代培养
1.2.1 培养板的预处理 海马取材前将无菌盖玻片放入6孔板内,用0.1mg/ml的多聚赖氨酸包被6孔板,置于37℃,5%CO2孵箱内,2h后吸出多余多聚赖氨酸,无菌磷酸盐缓冲液(phosphate buffer saline,PBS)洗2次,超净台内晾干备用。
1.2.2 试剂配制 种植培养基:含10%胎牛血清的DMEM/F-12。维持培养基:含2% B27的Neurobasal Medium。两种培养基内均加有双抗,终浓度为1%。
1.2.3 海马取材和原代培养 高温消毒手术器械。紫外线灯消毒细胞培养室和超净台45min后,打开解剖显微镜,铺上无菌手术巾。孕鼠用10%水合氯醛腹腔麻醉后,打开腹腔,取出胎鼠,置于托盘中,用75%乙醇消毒后,断头处死。打开颅骨,取出全脑,置入加有PBS的60mm培养皿中(放于冰上)。解剖显微镜下剥离大脑皮质,取出海马,在解剖显微镜下仔细去除被膜及血管。用组织剪将其剪碎成1mm×1mm×1mm的组织块,然后加入等量的0.25%胰酶,置于37℃、5%CO2孵箱中消化20min。再加入种植培养基终止消化,用蓝枪头缓慢均匀吹打约20次后,以800转/min离心4min,弃上清液,再加入种植培养基,用100μm筛网过滤后,使用细胞计数器调整悬液密度为1×106/ml。然后将细胞接种在预先铺有多聚赖氨酸的6孔板上,将其置于孵箱中。根据孵育后更换培养基的时间不同分为两组。(1)A组:4h后去除种植培养基,换用维持培养基。(2)B组:12h后更换培养基,之后每2d更换半量培养基。使用倒置显微镜观察神经元生长状况并拍照。
1.2.4 神经元特异性烯醇化酶染色 将培养至第7天的神经元用PBS洗3次后,加入4%多聚甲醛固定20min,再用PBS洗3次,5min/次。爬片稍甩干后加破膜工作液,室温孵育10min后PBS洗3次。轻轻甩掉封闭液,加入一抗,4℃湿盒过夜。PBS洗3次后加入二抗,室温避光孵育50min。PBS洗3次后,加入DAPI染液,室温避光孵育10min。PBS洗3次,晾干后将有细胞的一面朝下,用抗荧光淬灭封片剂将玻片封固在载玻片上。在正置荧光显微镜下取5个视野,观察DAPI和NSE表达情况并采集图像,分别计算两组神经元的纯度。
2 结 果
2.1 神经元形态学变化
倒置显微镜下可见,两组细胞接种4~6h后已经贴壁生长,胞体呈小圆形。第2天胞体增大,有些胞体已有短突起长出。第3天胞体稍有增大,突起明显增长,约为胞体的2倍,相互连接,但尚未形成网状。第4天胞体折光性明显增强,呈锥体形或三角形,突起进一步增长,约为胞体的3倍。第5天胞体立体感增强,周围一圈光晕明显,可见突起变粗并有分支形成,呈单极、双极或多极,并相互连接呈网状。从细胞形态上看,除B组细胞碎片稍多外,两组神经元无明显差异(图1)。

图1 两组海马神经元形态学变化
Figure 1 Morphological changes of hippocampal neurons in two groups (×200)
2.2 免疫荧光染色结果
正置荧光显微镜下可见DAPI染色阳性的胞核呈蓝色,大且明显。NSE阳性表达的胞体和突起呈绿色,突起清晰可见,相互连接呈网状(图2)。计算NSE阳性细胞率,A组和B组分别为(94±3.2)%和(86±4.0)%。与A组比较,B组神经元纯度较低(<0.05)。
3 讨 论
本课题在选材上对神经元原代培养方法进行了改进,选用了胎鼠的海马组织进行神经元的原代培养。传统培养方法中,新生鼠和胎鼠均可培育出神经元。虽然胎鼠海马取材较新生鼠难度大,但培养出来的神经元更易存活。原因如下。(1)大鼠的神经系统发育较早,在出生前后就已基本完成发育,长出突起[3],取材时极易损伤突起。而神经突起是大脑传递、储存信息的重要媒介,其损伤会极大影响神经元的功能[4]。(2)大鼠在孕龄17~18d时,胎鼠的神经细胞尚未分化完全,有大量神经干细胞,离体后易于生长发育。神经元原代培养可取材的部位也较多,较为常见的是海马和大脑皮质。其中海马组织在大脑颞叶内侧,左右各一,是边缘系统的组成部分。海马在人类和动物的学习记忆中起重要作用[5],与阿尔茨海默病、帕金森病和亨廷顿病等中枢神经系统疾病密切相关。海马神经元原代培养所建立的细胞模型可广泛应用于神经退行性疾病、精神疾病和创伤性脑损伤等的体外研究[6−8]。Harrill等[9]通过观察突触增长长度和囊泡型谷氨酸转运体(vesicular glutamate transporter 1,vGLUT1)以及囊泡型γ−氨基丁酸转运体(vesicular aminobutyric acid transporter,vGAT)免疫阳性的数目发现,海马神经元较皮质神经元成熟更快。多数神经系统疾病细胞模型在原代培养7d后即开始进行造模和干预实验,相比于还未发育成熟的皮质神经元,海马神经元更适用。
本课题通过对更换维持培基时间的筛选,发现接种4h后更换培养基所获得的神经元纯度更高。我们分析可能的原因包括两方面。(1)尽早去除损伤的神经细胞。在获得海马细胞悬液时,多个步骤都会造成急性神经细胞损伤(如:海马取材时的机械吹打和胰酶消化时的化学反应),从而产生大量的细胞碎片和死细胞。坏死的神经元既可释放大量谷氨酸,产生兴奋性毒性作用,加重神经元损伤,又可激活小胶质细胞,产生大量炎性因子(IL-1β,TNF-α,IL-6和IL-12)和神经毒性物质(NO和活性氧物质),形成神经元损伤的恶性循环[10−12]。因此在活细胞贴壁后,应尽早去除细胞碎片和死细胞。这样既能减少细胞碎片和死细胞贴壁,防止其影响观察和拍照,又能降低其神经毒性作用,提高神经元的存活率。(2)抑制胶质细胞分裂增殖。种植培养基为含10%胎牛血清的DMEM/F-12,可辅助神经细胞贴壁,但时间过长后也会促进胶质细胞分裂增殖,影响神经元的纯度。维持培养基中含有Neurobasal/B27,为无血清培养基,且含有多种神经元生长发育所需要的营养因子和微量元素,在促进海马神经元和突起生长的同时还可抑制胶质细胞生长[13]。神经细胞贴壁后尽早更换为Neurobasal/B27培养基,将更有利于神经元的生长和纯化。
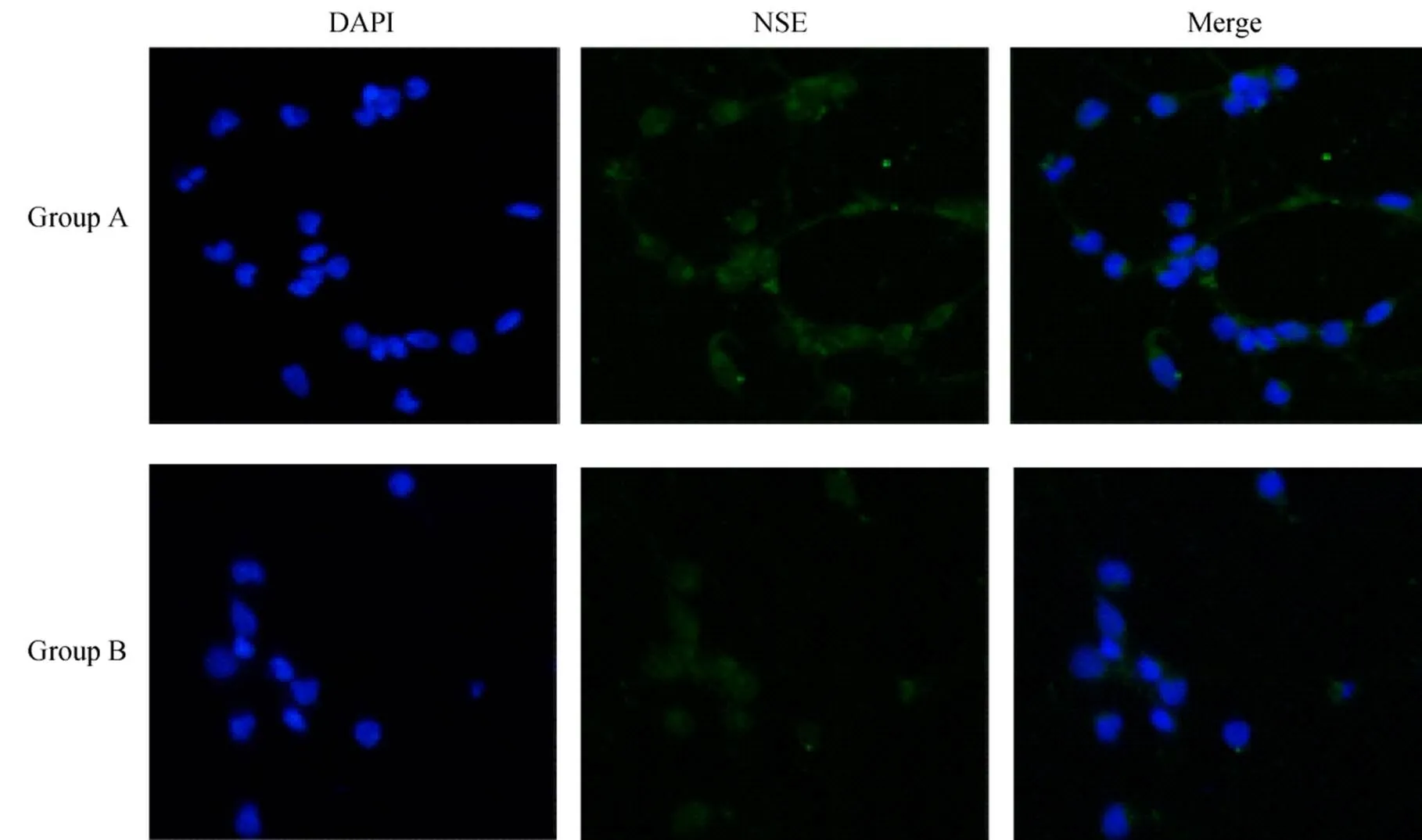
图2 两组海马神经元NSE免疫荧光染色
Figure 2 NSE immunofluorescent staining of hippocampal neurons in two groups (×200) DAPI: 4’,6-diamidino-2-phenylindole; NSE: neuron specific enolase
本实验通过改进的培养方法获得了NSE阳性表达且纯度较高的海马神经元,且突起间相互连接形成网络,可进一步应用于建立相关神经系统疾病细胞模型。
[1] Maraldi T, Bertoni L, Riccio M,. Human amniotic fluid stem cells: neural differentiationand[J]. Cell Tissue Res, 2014, 357(1): 1−13.
[2] Mazurová Y, Anderova M, Němečková I,. Transgenic rat model of Huntington’s disease: a histopathological study and correlations with neurodegenerative process in the brain of HD patients[J]. Biomed Res Int, 2014, 2014: 291531.
[3] Ohsawa F, Widmer HR, Knusel B,. Response of embryonic rat hippocampal neurons in culture to neurotrophin-3, brain-derived neurotrophic factor and basic fibroblast growth factor[J]. Neuroscience, 1993, 57(1): 67−77.
[4] Attardo A, Fitzgerald JE, Schnitzer MJ. Impermanence of dendritic spines in live adult CA1 hippocampus[J]. Nature, 2015, 523(7562): 592−596.
[5] van Spronsen M, van Battum EY, Kuijpers M,. Developmental and activity-dependent miRNA expression profiling in primary hippocampal neuron cultures[J]. PLoS One, 2013, 8(10): e74907.
[6] Sendrowski K, Sobaniec W, Stasiak-Barmuta A,. Study of the protective effects of nootropic agents against neuronal damage induced by amyloid-beta (fragment 25-35) in cultured hippocampal neurons[J]. Pharmacol Rep, 2015, 67(2): 326−331.
[7] Raynaud F, Moutin E, Schmidt S,. Rho-GTPase-activating protein interacting with Cdc-42-interacting protein 4 homolog 2 (Rich2): a new Ras-related C3 botulinum toxin substrate 1 (Rac1) GTPase-activating protein that controls dendritic spine morphogenesis[J]. J Biol Chem, 2014, 289(5): 2600−2609.
[8] Si D, Yang P, Jiang R,. Improved cognitive outcome after progesterone administration is associated with protecting hippocampal neurons from secondary damage studiedand[J]. Behav Brain Res, 2014, 264: 135−142.
[9] Harrill JA, Chen H, Streifel KM,. Ontogeny of biochemical, morphological and functional parameters of synaptogenesis in primary cultures of rat hippocampal and cortical neurons[J]. Mol Brain, 2015, 8: 10.
[10] Fujikawa DG. The role of excitotoxic programmed necrosis in acute brain injury[J]. Comput Struct Biotechnol J, 2015, 13: 212−221.
[11] Surace MJ, Block ML. Targeting microglia-mediated neurotoxicity: the potential of NOX2 inhibitors[J]. Cell Mol Life Sci, 2012, 69(14): 2409−2427.
[12] Sierra A, Beccari S, Diaz-Aparicio I,. Surveillance, phagocytosis, and inflammation: how never-resting microglia influence adult hippocampal neurogenesis[J]. Neural Plast, 2014, 2014: 610343.
[13] Brewer GJ, Boehler MD, Jones TT,. NbActiv4 medium improvement to Neurobasal/B27 increases neuron synapse densities and network spike rates on multielectrode arrays[J]. J Neurosci Methods, 2008, 170(2): 181−187.
(编辑: 吕青远)
Modified culture methods and identification of hippocampal neurons from fetal rats
WANG Yue, WANG Shi-Bo, YU Xiao-Wen, YANG Ling, TUO Xi-Ping*
(Department of Geriatrics, Changhai Hospital, the Second Military Medical University, Shanghai 200433, China)
To optimize the primary culture method for hippocampal neurons.Hippocampus was harvested from fetal rats. They were obtained by enzymatic digestion and divided into groups A and B according to different times for replacing serum-free medium (4h after seeding in group A and 12h in group B). The cell growth was recorded on the 2nd, 3rd, 4th, and 5th days. Fluorescence assay was used to identify the cells with neuron specific enolization and determine the purity on the 7th day.After 4−6h, the cells attached to the wall. The cell body was enlarged on 2nd day. The nervous process erupted on 3rd day and extended into reticulation on 5th day. The fluorescence assay identified the neurons and indicated that the purity of group A was obviously higher than group B (<0.05).The improved technique can cultivate well-growth hippocampal neurons with higher purity.
neurons; culture; fetal rats
(201440022)
R329.2; Q954.67
A
10.11915/j.issn.1671-5403.2016.01.012
2015−06−24;
2015−09−14
2014年度上海市卫生和计划生育委员会科研课题重点项目(201440022)
拓西平, E-mail: xptuo_01@126.com

