厄洛替尼治疗老年非小细胞肺癌的疗效和安全性
王汉萍,张 力,王孟昭
厄洛替尼治疗老年非小细胞肺癌的疗效和安全性
王汉萍,张 力*,王孟昭
(中国医学科学院中国协和医科大学北京协和医院呼吸内科,北京 100730)
评价厄洛替尼在中国老年晚期非小细胞肺癌(NSCLC)患者中的安全性、疗效以及临床因素与疗效之间的关系。回顾性分析2005年3月至2010年10月于北京协和医院呼吸内科服用厄洛替尼的非临床试验的43例老年NSCLC患者的临床资料,分析其生存情况及相关临床因素对生存的影响。43例患者中,部分缓解(PR)12例,病情稳定(SD)17例,疾病进展(PD)14例,客观有效率(ORR)为27.9%,疾病控制率(DCR)为67.4%。影响ORR的临床因素有性别(=0.001)、肿瘤分化程度(=0.022)和吸烟史(=0.001);影响DCR的因素有性别(=0.031)、美国东部肿瘤协作组(ECOG)评分(=0.004)、肿瘤分化程度(=0.018)、吸烟史(=0.005)和服药后皮疹(<0.001)。服药后中位无进展生存期(PFS)为27周(95%CI:8.32~45.7周),服药后总生存期(OS)为46周(95%CI:26.7~65.3周)。对PFS有显著影响的临床因素包括病理类型(=0.024)、肿瘤分化程度(=0.036)、ECOG评分(=0.001)、服药后皮疹(=0.006);而病理类型(=0.040)、肿瘤分化程度(=0.023)、ECOG评分(<0.001)、使用厄洛替尼后续治疗(=0.028)对OS有显著影响。EGFR19/21外因子突变阳性的患者ORR(=0.004)和DCR(=0.033)均显著高于阴性组,中位PFS也显著高于阴性组(46.112.8周,=0.004)。常见副反应为皮疹(51.2%)和腹泻(23.2%)。使用厄洛替尼治疗我国老年晚期NSCLC患者的疗效和安全性均较好,体能状态良好的患者尽早使用厄洛替尼可能获得更好的疗效。
非小细胞肺癌;厄洛替尼;老年人
肺癌是最常见的恶性肿瘤,也是肿瘤相关死亡的第一位原因[1]。其中80%~85%的肺癌为非小细胞肺癌(non-small cell lung cancer,NSCLC)。多数患者诊断时已经处于晚期,而其中>50%的晚期NSCLC发生于年龄>65岁的老年人。统计发现,近10年来<50岁的肺癌发病率和死亡率呈下降趋势,而>70岁的发病率呈上升趋势[2]。因此老年肺癌患者治疗已经是肿瘤专科医师必须面对的问题。然而,老年肺癌患者的治疗方案疗效与安全性往往缺少循证医学证据[3]。目前认为,所有>70岁的患者都应进行生理年龄评估,年龄本身不是术后辅助化疗的禁忌证。
局部进展的NSCLC应该考虑行联合放化疗;卡铂(carboplatin)和紫杉醇(paclitaxel)联合的方案与单药吉西他滨(gemcitabine)或长春瑞滨(vinorelbine)相比,虽毒性反应增加,却更有利于延长晚期NSCLC的生存;其他以卡铂或顺铂(cisplatin)为基础的铂二联方案也可用于合适的老年患者,但其生存获益尚未得到随机性临床试验的支持;三代化疗药物的单药化疗用于不适合双药方案的老年患者;而对于靶向药物,包括表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKI)或间变淋巴瘤激酶(anaplastic lymphoma kinase,ALK)抑制剂,不管患者年龄多大,只要患者存在相应的EGFR突变或ALK重排,都是优于化疗的首选治疗[4]。而鉴于EGFR-TKI的安全性和有效性,其对无其他治疗选择或体能状态(performance status,PS)差的老年患者被寄予了更大的期望。
本研究回顾性分析了北京协和医院呼吸内科2005年3月至2010年10月收治的43例应用厄洛替尼治疗的老年晚期NSCLC患者的临床资料,观察其疗效及安全性,寻找可预测中国老年患者使用厄洛替尼(erlotinib)后疗效的临床指标。
1 对象与方法
1.1 研究对象
研究对象为2005年3月至2010年10月在北京协和医院呼吸内科收治的确诊为晚期NSCLC并服用厄洛替尼的患者43例,中位年龄75岁,年龄跨度70~85岁。其中,腺癌34例,二线及以上的治疗24例(55.8%),服药后皮疹22例、腹泻10例。入选标准:年龄≥70岁;组织学或细胞学确诊为NSCLC;服药时TNM分期为ⅢB/Ⅳ期;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~3分;肝、肾功能,凝血功能大致正常。排除标准:不能口服片剂;明显的全身疾病(肝、肾功能不全等);曾用过EGFR-TKI;明显视功能异常(干眼症、干燥综合征等)。患者服用厄洛替尼治疗的原因包括:基于EGFR突变状态;患者就诊前在外院已经开始服用该药;患者无法耐受其他治疗,选择使用厄洛替尼姑息治疗或作为二线及以上治疗。13例检测了EGFR突变的患者中7例具有EGFR敏感性突变。
1.2 方法
厄洛替尼剂量为150mg/d,空腹(进食前1h或进食后2h)服用,持续用药直到肿瘤进展或因毒副作用不能耐受为止。治疗期间不同时使用其他抗肿瘤治疗。对于组织学标本足够的患者,治疗前行EGFR基因突变状态检测。EGFR突变检测采用蝎形探针扩增阻滞突变系统(amplification refractory mutation system,ARMS)法,于北京协和医院病理科进行。患者均于用药前获得知情同意并签署知情同意书。
1.3 疗效及毒性评价标准
服药后患者每2个月随诊1次。疗效参照WHO关于实体瘤反应评价标准(response evaluation criteria in solid tumors,RECIST)统一进行评定。服药后的毒副反应按常见不良事件评价标准(common terminology criteria for adverse events,CTCAE)3.0版本评定。无进展生存期(progression-free survival,PFS)指从服用厄洛替尼到疾病进展(progressive disease,PD)的时间,总生存期(overall survival,OS)指从服用厄洛替尼到死亡的时间。
1.4 统计学处理
应用SPSS18.0统计软件进行统计学分析。采用Pearson相关性分析评估各临床因素与客观有效率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)的相关性;采用Kaplan-Meier法分析各单因素对PFS及OS的影响;单因素组间生存率差异采用log-rank检验。<0.05为差异有统计学意义
2 结 果
2.1 一般资料及预后
43例患者中,部分缓解(partial remission,PR)12例,疾病稳定(stable disease,SD)17例,PD 14例,ORR为27.9%(12/43),DCR为67.4%(29/43)。影响ORR的临床因素有性别(=0.001)、吸烟(=0.001)和肿瘤分化程度(=0.022)。影响DCR的临床因素有性别(=0.031)、服药前ECOG评分(=0.004)、肿瘤分化程度(=0.018)、吸烟(=0.005)和服药后皮疹情况(<0.001)。EGFR突变阳性的患者其ORR和DCR均显著高于EGFR突变阴性者(<0.05;表1)。
2.2 服药后PFS分析
43例患者的中位PFS为27周(95%CI 8.32~45.7周),截至观察终点有6例(14.0%)未进展至PD(图1A)。对PFS有显著影响的单因素包括病理类型(=0.024)、肿瘤分化程度(=0.036)、ECOG评分(=0.001)、服药后出现皮疹(=0.006;图1B~E)。
2.3 服药后OS分析
43例患者的中位服药后OS为46周(95%CI 26.7~65.3周),平均57.6周,截至观察终点有8例(18.6%)仍存活。6个月生存率60.5%,1年生存率32.6%(图2A)。对OS有显著影响的单因素包括病理类型(=0.040)、肿瘤分化程度(=0.023)、服药前ECOG评分(<0.001)和服用厄洛替尼进展后的后续治疗(=0.028;图2B~E)。

表1 NSCLC患者一般情况及服药后客观疗效情况
NSCLC: non-small cell lung cancer; PR: partial remission; SD: stable disease; PD: progressive disease; ORR: objective response rate; DCR: disease control rate; ECOG: Eastern Cooperative Oncology Group; EGFR: epidermal growth factor receptor.*Compared between high differentiation and mid-low differentiation
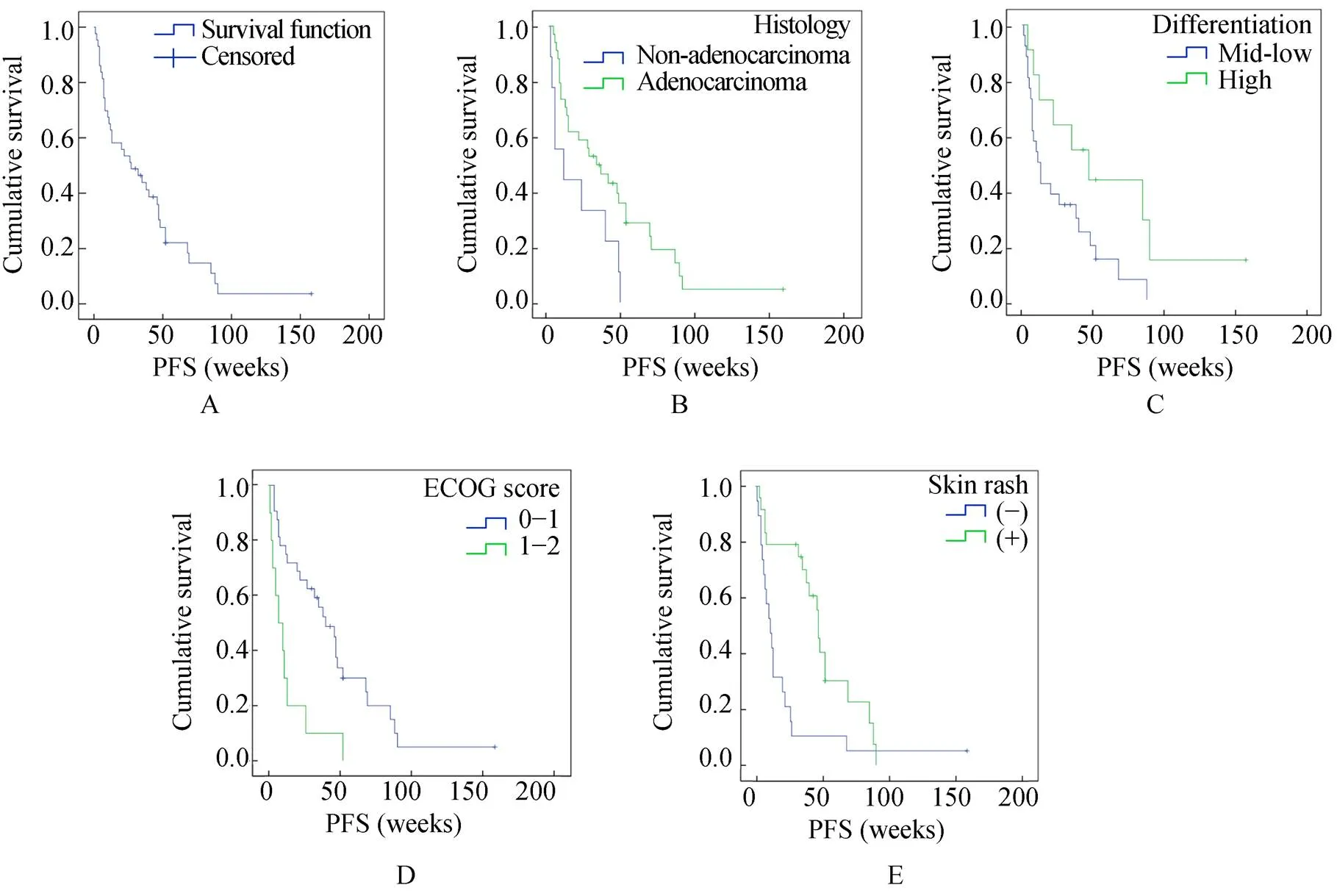
图1 PFS生存曲线及相关的临床因素分析
Figure 1 PFS survival function and related clinical factors in 43 patients PFS: progression-free survival
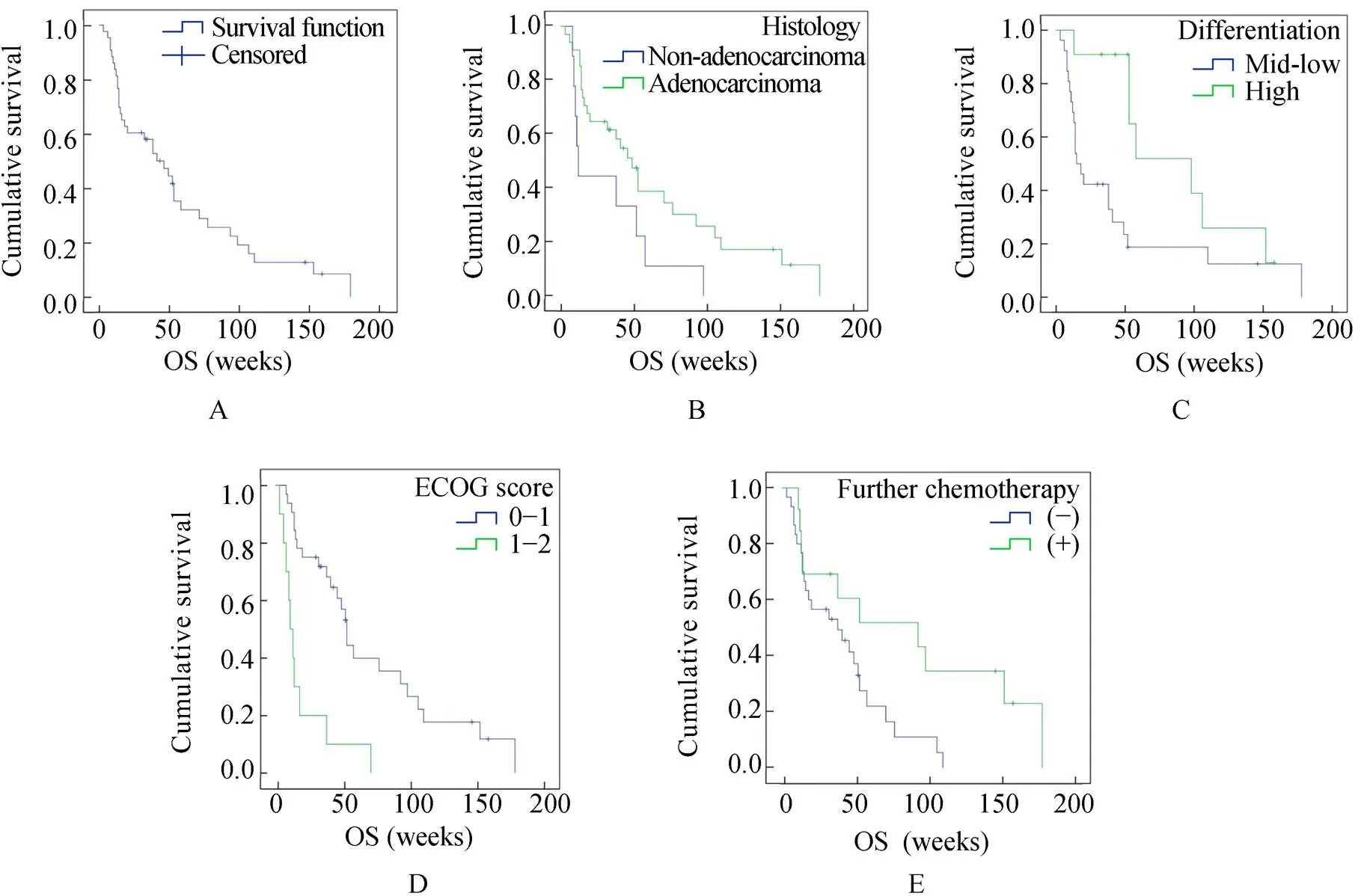
图2 43例患者OS生存曲线及相关临床因素分析
Figure 2 OS survival function and related clinical factors in 43 patients OS: overall survival
2.4 毒副反应
43例晚期NSCLC的老年患者服用厄洛替尼后最常见的副反应为皮疹(22例,51.2%),多为1~2级,未见因严重皮疹退出组。其次为腹泻(10例,23.2%),多为1~2度;仅有1例高血压史患者出现Ⅳ度腹泻后停药。其他副反应包括食欲下降、口腔溃疡、甲周炎、口干等。无毒副反应导致的死亡病例。
3 讨 论
2005年BR.21小组记录了新的生物药物—— EGFR-TKI厄洛替尼的抗癌活性[5]。他们通过在老年人中的回顾分析发现,老年NSCLC患者一线用药以后使用厄洛替尼的ORR为7.6%,DCR为77.6%,中位PFS为3.0个月,中位OS为7.6个月,且老年人在疗效、PFS或OS甚至毒副反应与年轻组患者都没有显著差异[6]。另外1项对化疗后NSCLC患者接受厄洛替尼治疗的回顾性分析发现,多因素分析结果显示年龄>65岁预示较低的ORR;但两组的DCR无显著差异[7]。在此基础上,Rossi等[8]进行的1项前瞻性的Ⅱ期临床研究,发现厄洛替尼在老年晚期NSCLC患者中的中位OS为9个月,中位PFS为3个月,由此证实了厄洛替尼在老年二三线治疗中的有效性;获益相关的临床因素包括女性、腺癌和皮疹。Xu等[9]回顾分析了35例老年晚期NSCLC患者一线使用厄洛替尼的临床疗效,ORR为48.6%,DCR为77.1%,中位进展时间(time to progression,TTP)为6.4个月,中位OS为12.7个月,女性、腺癌、非吸烟者疗效较好。
随着晚期NSCLC患者中EGFR基因突变检测的普遍进行,EGFR突变已经成为NSCLC患者一线使用EGFR-TKI的公认指征。很多研究都已经证实了EGFR-TKI[包括厄洛替尼、吉非替尼(gefitinib)以及阿法替尼(afatinib)等]在老年EGFR突变阳性的老年NSCLC患者中的良好疗效和安全性[10−12]。因此,包括意大利胸部肿瘤协会(IATO)的国际专家小组会议等组织的指南都推荐以EGFR或ALK等基因突变结果来指导老年NSCLC患者的靶向药物治疗[4,13]。而对于野生型患者,尤其是PS状态差者,在没有其他治疗选择的情况下,是否使用靶向药物一直有争议。小样本研究提示EGFR野生型老年患者对厄洛替尼的疗效不令人满意[14]。Khan等[15]最近报道了1项成本效益研究结果,研究对象为不适合化疗的老年晚期NSCLC患者,比较一线使用厄洛替尼和最佳支持治疗/安慰剂的生存获益、生活质量(quality of life,QOL)获益,并分析成本效益和QOL调整年等指标。结果发现,在所有的患者群中厄洛替尼并未显示良好的成本效益,而在厄洛替尼治疗的第一个周期(28d)内出现皮疹的亚组中,有80%的患者在成本效益阈值内,提示厄洛替尼在皮疹亚组患者中有潜在的成本效益。值得注意的是,这些英国NSCLC患者的EGFR突变率仅为5%,而厄洛替尼组服药后出现皮疹的比例达60%,这就明显扩大了可能从厄洛替尼治疗中获益的患者群体,有望为这些几乎没有其他治疗选择的患者带来新的希望。
本研究结果显示,老年非选择性晚期NSCLC患者服用厄洛替尼后ORR、DCR以及中位PFS、OS结果均显著优于欧美的结果,而与亚洲人的报道结果类似,其中厄洛替尼的高DCR仍值得注意。由于厄洛替尼本身作用机制的特殊性,有学者提出,对于厄洛替尼的疗效,DCR与患者的OS相关性更大。尤其对于老年人中PS状态差者,评价厄洛替尼的疗效更应考虑到患者临床症状的改善包括QOL等[16,17]。分析临床因素与疗效的相关性发现,在ORR或DCR方面,女性、不吸烟者、分化程度高的肿瘤仍占优势,对于PFS及OS的影响,性别、是否吸烟的差异并不明显,而病理类型、分化程度、治疗时患者的PS情况仍起重要作用。ECOG评分差的患者服用厄洛替尼的PFS和OS均较差,提示尽早使用EGFR-TKI对于改善生存更有意义[4]。
总之,使用厄洛替尼治疗中国的老年晚期NSCLC患者安全性和疗效均较好,且在PS状态良好的情况下使用疗效更加显著。EGFR突变检测应该成为老年晚期NSCLC诊治中的常规,而进一步结合临床等其他指标可能为没有更多治疗选择的老年患者带来新的机会。
[1] Parkin DM, Bray F, Ferlay J,. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005, 55(2): 74−108.
[2] Wingo PA, Cardinez CJ, Landis SH,. Long term trends in cancer mortality in the United States[J]. Cancer, 2003, 97(12 suppl): 3133−3275.
[3] Lewis JH, Kilgore ML, Goldman DP,. Participation of patients aged 65 years or older in cancer clinical trials[J]. J Clin Oncol, 2003, 21(7): 1383−1389.
[4] Gridelli C, Balducci L, Ciardiello F,. Treatment of elderly patients with non-small-cell lung cancer: results of an international expert panel meeting of the Italian Association of Thoracic Oncology[J]. Clin Lung Cancer, 2015, 16(5): 325−333.
[5] Shepherd FA, Pereira JR, Ciuleanu T,. Erlotinib in previously treated non-small cell lung cancer[J]. N Engl J Med, 2005, 353(2): 123−132.
[6] Wheatley-Price P, Ding K, Seymour L,. Erlotinib for advanced non-small cell lung cancer in the elderly: an analysis of the National Cancer Institute of Canada Clinical Trials Group Study Br. 21[J]. J Clin Oncol, 2008, 26(14): 2350−2357.
[7] Perng RP, Yang CH, Chang GC,. High efficacy of erlotinib in Taiwanese NSCLC patients in an expanded access program study previously treated with chemotherapy[J]. Lung Cancer, 2008, 62(1): 78−84.
[8] Rossi D, Dennetta D, Ugolini M,. Activity and safety of erlotinib as second- and third-line treatment in elderly patients with advanced non-small cell lung cancer: a phaseⅡ trial[J]. Target Oncol, 2010, 5(4): 231−235.
[9] Xu XH, Su J, Fu XY,. Clinical effect of erlotinib as first-line treatment for Asian elderly patients with advanced non-small-cell lung cancer[J]. Cancer Chemother Pharmacol, 2011, 67(2): 475−479.
[10] Inoue Y, Inui N, Asada K,. Phase Ⅱ study of erlotinib in elderly patients with non-small cell lung cancer harboring epidermal growth factor receptor mutations[J]. Cancer Chemother Pharmacol, 2015, 76(1): 155−161.
[11] Kuwako T, Imai H, Masuda T,. First-line gefitinib treatment in elderly patients (aged ≥75 years) with non-small cell lung cancer harboring EGFR mutations[J]. Cancer Chemother Pharmacol, 2015, 76(4): 761−769.
[12] Maemondo M, Minegishi Y, Inoue A,. First-line gefitinib in patients aged 75 or older with advanced non-small cell lung cancer harboring epidermal growth factor receptor mutations: NEJ 003 study[J]. J Thorac Oncol, 2012, 7(9): 1417−1422.
[13] Gridelli C, de Marinis F, Cappuzzo F,. Treatment of advanced non-small-cell lung cancer with epidermal growth factor receptor (EGFR) mutation or ALK gene rearrangement: results of an international expert panel meeting of the Italian Association of Thoracic Oncology[J]. Clin Lung Cancer, 2014, 15(3): 173−181.
[14] Minemura H, Yokouchi H, Azuma K,. A phase Ⅱ trial of erlotinib monotherapy for pretreated elderly patients with advanced EGFR wild-type non-small cell lung cancer[J]. BMC Res Notes, 2015, 8: 220.
[15] Khan I, Morris S, Hackshaw A,. Cost-effectiveness of first-line erlotinib in patients with advanced non-small-cell lung cancer unsuitable for chemotherapy[J]. BMJ Open, 2015, 5(7): e006733.
[16] Pantaleo MA, Nannini M, Lopci E,. Molecular imaging and targeted therapies in oncology: new concepts in treatment response assessment. A collection of cases[J]. Int J Oncol, 2008, 33(3): 443−452.
[17] Eisenhauer EA. Response evaluation: beyond RECIST[J]. Ann Oncol, 2007, 18(Suppl 9): ix29−ix32.
(编辑: 刘子琪)
Efficiency and safety of erlotinib for advanced non-small cell lung cancer in the elderly
WANG Han-Ping, ZHANG Li*, WANG Meng-Zhao
(Department of Respiratory Diseases, Peking Union Medical College Hospital, Peking Union Medical College, Chinese Academy of Medical Sciences, Beijing 100730, China)
To evaluate the safety and efficiency of erlotinib in the elderly with non-small cell lung cancer (NSCLC) and investigate the relationship of clinical characteristics with efficiency.Clinical data of 43 patients with stageⅢB/Ⅳ NSCLC who were older than 65 years and had not previously participated in erlotinib related clinical trials in our department from March 2005 to October 2010 were collected and retrospectively analyzed in this study. The correlation of survival with clinical factors was analyzed.Among the 43 patients,there were 12 cases of partial remission (PR), 17 of stable disease (SD), and 14 of progressive disease (PD), with an objective response rate (ORR) of 27.9%, and a disease control rate (DCR) of 67.4%. Gender (=0.001), tumordifferentiation (=0.022), and smoking history (=0.001) were significantly correlated with ORR, while gender (=0.031), score of Eastern Cooperative Oncology Group (ECOG,=0.004), tumor differentiation (=0.018), smoking history (=0.005), and skin rash from medication (<0.001) were significantly correlated with DCR. The progression-free survival (PFS) was 27 weeks (95%CI: 8.32−45.7 weeks) and the overall survival (OS) was 46 weeks (95%CI: 26.7−65.3 weeks). Pathological type (=0.024), differentiation (=0.036), ECOG score (=0.001), and skin rash from medication (=0.006) had significant effects on PFS in the cohort. And, pathological type (=0.040), differentiation(=0.023), ECOG score (<0.001), and further chemotherapy after erlotinib (=0.028) were significantly effective to OS. The patients with Exon 19/21 mutations of epidermal growth factor receptor (EGFR) had obviously higher ORR (=0.004), DCR (=0.033), and PFS (46.112.8 weeks,=0.004) than those without. The most common adverse effects were skin rash (51.2%) and diarrhea (23.2%).Erlotinib is safe and effective in the treatment of Chinese elderly patients with advanced NSCLC. As forpatients with good physical condition, the earlier erlotinib used, the better the prognosis will be.
non-small cell lung cancer; erlotinib; aged
R592; R743
A
10.11915/j.issn.1671-5403.2016.01.004
2015−09−01;
2015−10−01
张 力, E-mail: zhangli1026@sohu.com

