桑叶抗糖尿病活性成分研究
王 娅,李嘉盈
(天津医科大学第二医院药学部,天津 300211)
桑叶抗糖尿病活性成分研究
王娅,李嘉盈
(天津医科大学第二医院药学部,天津300211)
摘要:目的研究桑叶抗糖尿病的活性成分。方法桑叶用80%乙醇和水提取。利用硅胶、凝胶等柱色谱及制备液相色谱进行分离,并根据理化性质和有机波谱技术鉴定了化合物的结构,进一步通过测定生物碱类化合物和黄酮苷类化合物对胰岛素抵抗的HepG2细胞葡萄糖消耗量来评价其抗糖尿病活性。结果从桑叶中分离鉴定了8个化合物,分别为:1-脱氧野尻霉素(1),1,4-dideoxy-1,4-imino-D-arabinitol(2),山奈酚-3-O-β-D-吡喃葡萄糖苷(3),β-谷甾醇(4), 正三十四烷醇(5),oxyresveratrol(6),熊果酸(7),葡萄糖乙醇苷(8),此外化合物3能够显著提高胰岛素抵抗HepG2细胞葡萄糖消耗量。结论化合物3具有较强的抗糖尿病活性。
关键词:桑叶;黄酮苷;抗糖尿病活性
桑叶又名铁扇子,为桑科桑属(Morus)植物桑(Morusalba)的叶子,本属植物广泛分布于我国,约有11种,主要以浙江、江苏等南方养蚕地区为主[1]。据文献报道桑属植物具有降糖、降压、抗炎和抗病毒等多种生物活性。现代药理研究证明桑叶可明显抑制血糖升高,具有预防和治疗糖尿病的作用[2-3]。本文综合利用凝胶色谱、硅胶柱色谱等方法从桑叶乙醇和水提取物中分别提取分离鉴定了8个化合物,其中包括生物碱类化合物,黄酮苷类化合物和甾体类化合物,此外,我们对从中分离得到的黄酮苷类和生物碱类化合物进行了抗糖尿病活性的初步筛选,结果显示化合物3具有较强的降糖作用。
1仪器与材料
Bruker AV 400 核磁共振仪 (TMS内标);氘代试剂 (Aldrich 公司);全自动酶标板分析仪(美国伯乐公司);A sahipak GS- 20G H200142,H200143 色谱柱 (25 mm × 500 mm,5 μm);硅胶 (青岛海洋化工厂);CO2细胞培养箱(热力公司);YMC- Pack ODS-A SH-343-5 色谱柱 (20 mm × 250 mm,5 μm);超净工作台(广州嘉凡);倒置显微镜 (日本Olympus公司);所用试剂均为分析纯;含酚红的DMEM培养基(以色列BI公司);不含酚红的DMEM培养液 (Hyclone公司);特级胎牛血清(杭州天杭生物),青链霉素(以色列BI公司);磷酸盐缓冲液 (以色列BI公司);葡萄糖试剂盒(南京建成);0.25%(含EDTA)胰蛋白酶(以色列BI公司);二甲基亚砜(Sigma公司);胰岛素(以色列BI公司);HepG2细胞购自中科院昆明细胞库。
桑叶采自浙江杭州(2010年10月),由中南民族大学生命科学院万定荣教授鉴定,标本 (D20101019) 存放于天津医科大学第二附属医院药剂科中药房。
2实验方法
2.1提取分离取自然晾干的桑叶10.0 kg,捣碎后用80%的乙醇加热回流提取4次,每次5 h,减压浓缩提取液,获得浸膏800 g,用水混悬,依次用正丁醇、水饱和的石油醚和乙酸乙酯进行萃取,最后得到正丁醇提取物56 g,石油醚提取物80 g,乙酸乙酯提取物65 g。桑叶石油醚提取物和醋酸乙酯提取物分别以硅胶柱层析(350 g,100~200目)分离,用石油醚∶乙酸乙酯[10∶1,8∶1,6∶1,4∶1,2∶1,1∶1,1∶2,1∶3,100% 乙酸乙酯,乙酸乙酯 (5% 甲醇),乙酸乙酯 (10% 甲醇),乙酸乙酯 (30% 甲醇)]和甲醇梯度洗脱,分离得到10个化学组分(A-J),其中醋酸乙酯层得到3个组分,石油醚层获得5个组分。
组分D通过凝胶柱层析分离,氯仿∶甲醇(3∶1)洗脱,得到Fr.1,Fr.2和Fr.3,Fr.1通过高效液相色谱的分离纯化,从而得到化合物5(5.6 mg),化合物6(3.7 mg)和化合物7(4.8 mg);组分E通过凝胶渗透柱层析分离,三氯甲烷∶甲醇(3∶1)洗脱,得到了Fr.1,Fr.2,Fr.3和Fr.4,Fr.4再通过高效制备液相色谱及薄层色谱法分离纯化,得到化合物8(4.5 mg)。组分J经过凝胶渗透柱层析分离,三氯甲烷∶甲醇(3∶1)洗脱,得到了Fr.1,Fr.2和Fr.3,Fr.3再反复经过高效制备液相色谱法及萃取分离纯化,分别得到化合物3(20.9 mg),化合物4(11.7 mg)。
桑叶水提取物用水溶解后,过滤后经离子交换树脂分离,分别得到了酸性部分,碱性部分和两性部分。由于桑叶水提取物中含有大量的色素,我们对富含生物碱的碱性部分,最开始采用凝胶离子树脂分离除去色素,从而得到了生物碱类化合物,再经离子交换树脂分离得到化合物1(11.0 mg)和化合物2(9.6 mg)。
2.2MTT法筛选化合物低细胞毒剂量用含10%胎牛血清的培养液配成单个细胞悬液,以每孔10 000个细胞接种到96孔板中,每孔体积200 μL,待细胞贴壁后,每孔加入相应浓度的化合物,作用48 h后,每孔加MTT溶液(5 g·L-1)20 μL,继续孵育4 h,终止培养,弃去培养上清液,然后每孔加入150 μL DMSO,振荡10 min,继而用酶标仪在490 nm波长下测量吸光度。
抑制率=(1-加药组OD值/空白组OD值)× 100%。
2.3胰岛素抵抗HepG2细胞葡萄糖消耗实验通过查阅相关文献[4-5],我们建立了胰岛素抵抗的HepG2细胞模型,将处于对数生长期的细胞消化后,细胞接种的密度为每毫升 105个,铺在48孔板中。待细胞贴壁后,加入新鲜配制的含有100 nmol·L-1胰岛素的DMEM培养基,并设空白对照组,在CO2培养箱中孵育36 h后弃去旧培养液,然后先用pH3.5的不含血清的DMEM培养基洗4次,再用PBS洗2次,换上无血清不含酚红的培养基37℃孵育24 h后,最后用葡萄糖检测试剂盒检测培养基中剩余的葡萄糖含量。以没有细胞的空白孔为空白对照,计算24 h后各组细胞的葡萄糖消耗量。
3结果
3.1结构鉴定
3.1.1化合物1白色固体,茚三酮反应显橙黄色,ESI-MS m/z:187[M+H]+。1H-NMR(400 MHz,D2O)δ:3.72 (1H,dd,J=11.7,3.0 Hz,H-6a),3.53 (1H,dd,J=11.7,6.3 Hz,H-6b),3.39 (1H,ddd,J=10.8,9.3,5.2 Hz,H-2) ,3.24 (1H,t,J=9.3 Hz,H-3),3.13(1H,t,J=9.3 Hz,H-4),3.02 (1H,dd,J=12.3,5.2 Hz,H-1eq),2.44 (1H,ddd,J=9.3,6.3,3.0 Hz,H-5),2.36 (1H,dd,J=12.3,10.8 Hz,H-1)。13C-NMR (100 MHz,D2O) δ:78.5(C-3),71.6(C-4),70.9(C-2),61.5(C-6),60.4(C-5),48.7(C-1)。以上光谱数据与文献[6]报道基本一致,因此鉴定化合物 1 为1-脱氧野尻霉素。
3.1.2化合物2无色油状,茚三酮显紫色,ESI-MSm/z:134[M+H]+。1H-NMR(400 MHz,D2O)δ:2.81 (1H,dd,J=12.2,3.9 Hz,H-1a),2.96 (1H,m,H-4),3.09 (1H,dd,J=5.8 Hz,12.2Hz,H-1b),3.61(1H,dd,J=6.3 Hz,11.7 Hz,H-5a),3.70(1H,dd,J=4.8 Hz,11.7 Hz,H-5b),3.79(1H,dd,J=3.7 Hz,5.5 Hz,H-3),4.10(1H,m,H-2)。13C-NMR (100 MHz,D2O) δ:53.4(C-4),64.8(C-5),68.1(C-1),80.2(C-2),81.8(C-3)。以上数据与文献[7]报道基本一致,因此鉴定化合物 2 为1,4-dideoxy-1,4-imino-D-arabinitol。
3.1.3化合物3亮黄色粉末,盐酸—镁粉反应呈红色,三氯化铝反应在紫外 254 nm下黄色荧光加强,ESI-MS m/z:449.1[M+H]+。1H-NMR(270 MHz,DMSO-d6)δ:12.62(5-OH),6.19(1H,d,J=2.7 Hz,H-6),6.42(1H,d,J=2.7 Hz,H-8),8.03(2H,dd,J=8.1Hz,2.7 Hz,H-2',6'),6.88 (2H,dd,J=8.1 Hz,2.7Hz,H-3',5'),5.39 (1H,J=7.1 Hz,H-1'')。13C-NMR (67 MHz,DMSO-d6) δ:156.2(C-2),133.2(C-3),176.8(C-4),161.2(C-5),98.7(C-6),164.0(C-7),93.5(C-8),156.1(C-9),103.7(C-10),120.7(C-1'),130.8(C-2'),115.1 (C-3'),159.9 (C-4'),115.1 (C-5'),130.8 (C-6'),100.6 (C-1''),74.1(C-2''),76.5(C-3''),69.8(C-4''),77.3(C-5''),61.2(C-6'')。以上数据与文献[8]报道一致,因此鉴定化合物3为山奈酚-3-O-β-D-吡喃葡萄糖苷。
3.1.4化合物4无色方晶(乙酸乙酯),mp:137~138℃,其中IR光谱与β-谷甾醇一致,与β-谷甾醇标准品共TLC,Rf值相同,混合熔点不下降,通过参考文献[9],因此该化合物鉴定为β-谷甾醇。
3.1.5化合物5白色粉末,mp:79~81℃。IR (KBr):3418 cm-1,2919 cm-1,2850 cm-1,1467 cm-1,1176 cm-1,724 cm-1,1H-NMR (CDCl3,400 MHz) δ:0.87 (3H,t,H-34),1.49 (1H,s,OH),3.63(2H,t,H-1),其他质子1.00~1.70,以上数据与文献[10]报道一致,因此确定化合物5的结构为正三十四烷醇。
3.1.6化合物6白色结晶,mp:199~200℃,ESI-MS m/z:245[M+H]+。IR (KBr):3359 cm-1,1614 cm-1,1521 cm-1。1H-NMR (CD3COCD3,300 MHz) δ:7.38(1H,d,J=8.5Hz,H-6),7.32 (1H,d,J=16.5 Hz,H-β),6.87 (1H,d,J=16.5 Hz,H-α),6.50 (2H,d,J=2.5 Hz,H-2',6'),6.42(1H,d,J=2.5 Hz,H-3),6.36(1H,dd,J=8.5,2.5 Hz,H-5),6.22 (1H,t,J=2.5 Hz,H-4')。13C-NMR (75 MHz,CD3COCD3) δ:158.7 (C-3',5'),158.4(C-4),156.1 (C-2),140.9 (C-1'),127.6 (C-β),125.7 (C-α),122.9 (C-6),116.5 (C-1),107.8 (C-5),104.8(C-2',6'),101.9(C-4'),101.5(C-3)。以上数据与文献[11]报道一致,因此确定化合物为oxyresveratrol。
3.1.7化合物7白色粉末(CHCl3),mp:272~273℃,Liebermann-Burehard反应呈阳性。1H-NMR (CDCl3,300 MHz) δ:5.47(IH,t,J=7.5 Hz,H-12),1.20,1.12,1.02,1.00,0.98,0.87和0.83为7个甲基信号。13C-NMR (CDCl3,75 MHz) δ:39.3(C-1),28.4(C-2),78.0(C-3),39.7(C-4),56.5(C-5),33.5(C-6),19.1(C-7),39.7(C-8),48.3(C-9),37.7(C-10),23.9(C-11),125.7(C-12),139.3(C-13),42.8(C-14),29.2(C-15),24.2(C-16),48.1(C-17),53.5(C-18),40.2(C-19),39.5(C-20),30.2(C-21),37.2(C-22),29.0(C-23),16.0(C-25),16.9(C-25),17.7(C-26),25.1(C-27),179.8(C-28),17.9(C-29),21.7(C-30)。以上数据与文献[12]报道一致,故鉴定化合物7为熊果酸。
3.1.8化合物8白色粉末,mp:140~142℃。1H-NMR (CD3OD,500 MHz) δ:4.5 (1H,d,J=8.0Hz)为糖端基质子信号,此糖为 β 构型。4.04(1H,m),3.94 (1H,dd,J=12.2,1.8 Hz),3.65(2H,m),3.49(2H,m),3.42(1H,t,J=9.4 Hz),3.31(1H,t,J=9.3 Hz)为糖上6个H和连糖乙基2个H。1.25(3H,t,J=7.2 Hz)为和亚甲基相连的甲基信号。13C-NMR(CD3OD,500 MHz)δ:104.2(Glc-C-1),78.3(Glc-C-5),78.2(Glc-C-3),75.5(Glc-C-4),72.0(Glc-C-2),68.5(-CH2CH3),63.2(Glc-C-6),16.6(-CH2CH3)。以上数据与文献[13-14]报道一致,因此鉴定化合物 8 为葡萄糖乙醇苷。
3.2MTT实验结果本文测定了化合物1~3对人肝癌细胞HepG2的细胞毒性,结果如表1所示,化合物1~3在10 μmol·L-1和50 μmol·L-1浓度下对人肝癌细胞HepG2的增殖均无显著性的影响。

表1 化合物1~3对HepG2细胞的生长抑制率(n= 3)
注:*与对照组相比,P<0.05;**对照组相比,P<0.01。
3.3化合物对胰岛素抵抗HepG2细胞葡萄糖消耗的影响本文对分离得到的生物碱类和黄酮苷类化合物在非细胞毒剂量下进行了抗糖尿病活性的初步筛选,以胰岛素抵抗的HepG2细胞为体外模型测定了化合物1~3在非细胞毒剂量下对该细胞葡萄糖消耗的影响,从表2可以看出,化合物1~3都能够明显增加胰岛素抵抗HepG2细胞的葡萄糖消耗量,且存在一定的剂量依存性。
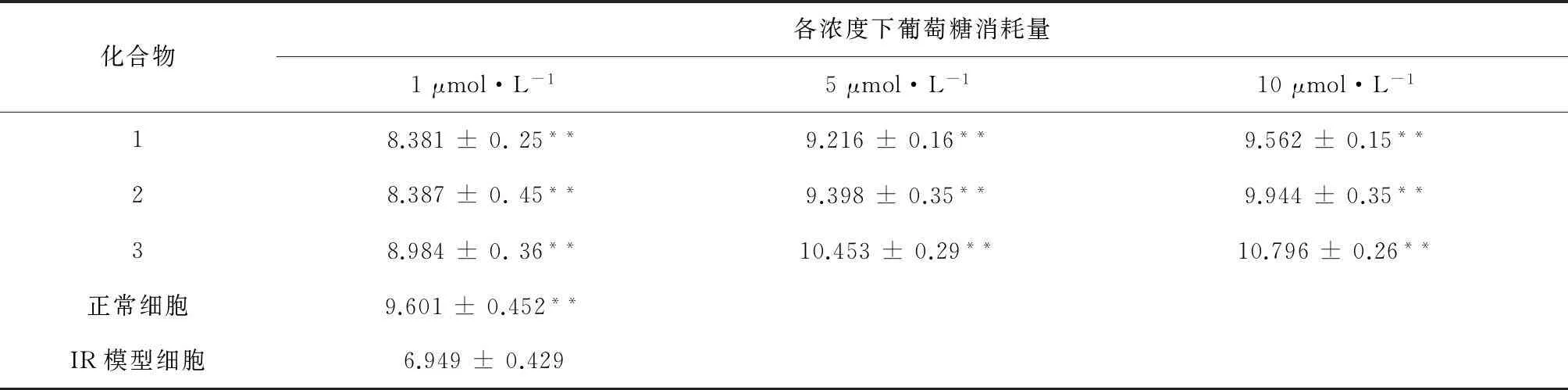
表2 化合物1~3对胰岛素抵抗HepG2细胞葡萄糖消耗量的影响(n= 3)
注:**与IR模型组相比,P<0.01。
根据前面初步筛选的结果,从而确定了测定EC50的浓度范围,进一步对化合物1~3进行了EC50浓度测定,结果见表3。

表3 化合物1~3对胰岛素抵抗HepG2细胞
4讨论
本文从桑叶石油醚和乙酸乙酯部位分别提取分离得到了6个化合物,从水提取物中分离得到了2个化合物。以胰岛素抵抗的HepG2细胞为模型,对化合物1~3进行了抗糖尿病活性的初步筛选,初步筛选结果表明,黄酮苷类化合物3能够显著提高HepG2细胞的葡萄糖消耗量,能够改善HepG2细胞胰岛素抵抗症状,加强细胞对葡萄糖的摄取利用,显示了明确的体外抗糖尿病活性。以上研究为中药桑叶的现代应用提供了实验依据,为抗糖尿病新型药物的发现提供了基础。
参考文献:
[1]江苏新医学院.中药大辞典(下册)[M].上海:上海人民出版社,1997:133.
[2]中国医学科学院药物研究所.中药志[M].北京:人民卫生出版社,1960:287.
[3]张玥,王兴华.肥胖型2型糖尿病的中医药研究进展[J].安徽医药,2015,19(6):1029-1033.
[4]Meshkani GF.SH2 domain-containing inositol 5-phosphatase (SHIP2) inhibition ameliorates high glucose-induced de-novo lipogenesis and VLDL production through regulating AMPK/mTOR/SREBP1 pathway and ROS production in HepG2 cells[J].Free Radic Biol Med,2015,89:679-689.
[5]Park JY,Kim Y,Im JA,et al.Oligonol suppresses lipid accumulation and improves insulin resistance in a palmitate-induced in HepG2 hepatocytes as a cellular steatosis model[J].BMC Complement Altern Med,2015,15:185.
[6]陈仕云,何勇,杨贤龙,等.桑白皮水溶性化学成分研究[J].山东化工,2014,43(12):64-65.
[7]Kim JY,Ok HM,Kim J,et al.Mulberry leaf extract improves postprandial glucose response in prediabetic subjects:a randomized,double-blind placebo-controlled trial[J].J Med Food,2015,18(3):306-313.
[8]倪付勇,陈重,许琼明,等.高山红景天化学成分研究[J].中草药,2013,44(7):798-802.
[9]郑聪聪,苏艳芳,陈磊,等.白花碎米荠的化学成分研究[J].中草药,2013,44(19):2657-2660.
[10] 刘旭阳,谢郁峰,张慧,等.多枝雾水葛化学成分(I)[J].中国实验方剂学杂志,2014,20(6):43-47.
[11] 刘爱红,胡志成,任刚,等.南川木波罗根皮的化学成分[J].中国实验方剂学杂志,2014,20(22):91-94.
[12] 祝晨蔯,高丽,赵钟祥,等.全缘叶紫珠三萜类成分研究[J].药学学报,2012,47(1):77-83.
[13] 张艳丽,冯志毅,郑晓珂,等.地黄叶的化学成分研究[J].中国药学杂志,2014,49(1):15-21.
[14] 吴培培,闫明,霍仕霞.苯乙醇苷类化合物的研究进展[J].药学进展,2011,30(10):1316-1319.
Anti-diabetic constituents of mulberry leaf
WANG Ya,LI Jia-ying
(DepartmentofPharmacy,SecondHospitalAffiliatedtoTianjinMedicalUniversity,Tianjin300211,China)
Abstract:Objective To study the chemical constituents and their anti-diabetic activity from the mulberry leaf.Methods Extracted with 80% ethyl alcohol and water,the constituents were isolated by chromatography of silica gel,ODS and p-HPLC,whose structures were identified on the basis of the physical properties and spectral analysis. Furthermore,glucose consumption assays in insulin-resistance HepG2 cells were used to assay the anti-diabetic activity of flavonoid glycosides and alkaloids.Results Eight compounds were isolated from mulberry leaf and identified as 1-deoxynojirimycin(1),1,4-dideoxy-1,4-imino-D-arabinitol(2),Kaemperol -3-O- β-D- glucopyranoside(3),β-stigmasterol (4),n-tetratriacontanol (5),oxyresveratrol (6),ursolic acid (7),ethyl-β-D-glucopyranoside(8) and compound 3 significantly stimulated glucose consumption and phosphorylation of Akt in insulin resistance HepG2 cells.Conclusions Compound 3 exhibits excellent anti-diabetic activity.
Key words:mulberry leaf;flavonoid glycoside;anti-diabetic activity
(收稿日期:2015-10-18,修回日期:2015-11-23)
doi:10.3969/j.issn.1009-6469.2016.03.005

