血必净对重症急性胰腺炎大鼠肝损伤的保护作用及其机制
袁伟燕,黄中伟,陈卫昌,沈雁波( 苏州大学附属第一医院,江苏苏州5006; 南通大学附属医院)
血必净对重症急性胰腺炎大鼠肝损伤的保护作用及其机制
袁伟燕1,2,黄中伟2,陈卫昌1,沈雁波2(1 苏州大学附属第一医院,江苏苏州215006;2 南通大学附属医院)
摘要:目的探讨血必净对重症急性胰腺炎(SAP)大鼠肝损伤的保护作用及其对肝脏信号转导与转录激活因子(p-STAT3)表达的影响。方法选择雄性SD大鼠72只,随机分为假手术组、模型组、血必净组,每组24只。模型组、血必净组采用5%牛磺胆酸钠逆行胰胆管注射制备重症SAP大鼠模型,血必净组制模后腹腔内一次性注射血必净4 mL/kg。假手术组打开腹腔,模拟上述操作,但不注射药物。模型组、血必净组于制模3、6、12 h随机取大鼠8只,假手术组同时间各取大鼠8只,心脏穿刺取血,检测血清ALT、AST。取血后处死,取肝组织行HE染色,观察肝组织病理改变;免疫组化染色及Western blotting法检测肝脏p-STAT3蛋白表达。结果模型组、血必净组制模后各时间点血清ALT、AST水平均高于假手术组同期,且制模12 h明显高于制模3、6 h(P均<0.05);血必净组制模后各时间点血清ALT、AST水平均低于模型组同期(P均<0.05)。肝组织病理观察显示,模型组、血必净组肝损伤程度重于假手术组,但轻于模型组。与模型组比较,血必净组肝脏p-STAT3蛋白表达明显降低(P均<0.05)。结论血必净对重症SAP大鼠肝损伤具有一定保护作用,其机制可能与抑制p-STAT3表达有关。
关键词:重症急性胰腺炎;肝损伤;血必净;肝脏信号转导与转录激活因子;大鼠
重症急性胰腺炎(SAP)是临床常见的急危重症,早期即可引起肺、肾、肝等多器官功能衰竭(MODS),病死率高达40%[1]。肝脏是重症SAP最常累及的胰外器官之一。血必净以血府逐瘀汤为底方,主要成分为红花、川穹、丹参、赤芍等,具有活血凉血、解毒止痛之功效。现代药理学研究表明,血必净可抑制炎症介质或细胞因子的释放,减轻炎症反应损伤[2,3],对SAP本身及其累及的肝损伤可能具有保护作用,但其作用机制尚未明确。2011年11月~2015年1月,我们观察了血必净对重症SAP大鼠肝损伤的保护作用,现分析结果,并探讨其可能的作用机制。
1材料与方法
1.1材料健康雄性SD大鼠72只,清洁级,鼠龄8~10周,体质量250~300 g,由南通大学医学院动物实验中心提供,许可证号:SCXK(苏)2008-0010。所有大鼠分笼喂养,自由进食和摄水,明暗周期12 h。全自动生化分析仪,德国西门子公司;JY92-2D超声波细胞粉碎机,宁波新芝科器研究所;蛋白电泳仪、图像分析系统,美国Bio-Rad公司。血必净注射液(规格:10 mL/支),天津红日药业股份有限公司;牛磺胆酸钠,美国Sigma公司;兔抗大鼠p-STAT3一抗,美国Bioworld公司;PVDF膜,美国Millipore公司;兔抗大鼠β-actin抗体、山羊抗鼠IgG二抗,美国Santa Cruz公司。
1.2动物分组及模型制备随机将SD大鼠分为假手术组、模型组及血必净组,每组24只。模型组、血必净组参照Lankisch等[4]的方法,术前禁食12 h、不禁水,用10%水合氯醛(300 mg/kg)腹腔注射麻醉,以0.1 mL/min速率向胆胰管内注入5%牛磺胆酸钠(0.1 mL/100 g)制备重症SAP模型。血必净组制模后腹腔内一次性注射血必净注射液(4 mL/kg)。假手术组打开腹腔后模拟上述操作,但不注射药物。
1.3相关指标观察
1.3.1肝功能指标各组分别于制模3、6、12 h随机取8只,乙醚麻醉,心脏穿刺取血3~5 mL,4 ℃ 3 000 r/min离心15 min,取血清,-20 ℃冰箱冻存。应用全自动生化分析仪检测血清ALT、AST。
1.3.2肝组织病理变化各组取血后处死,取新鲜肝左叶,4%甲醛溶液固定24 h,组织经脱水、透明、浸蜡,包埋制成蜡块,4 μm厚切片,烤片后二甲苯脱蜡、梯度酒精水化、HE染色。光镜下观察肝组织病理形态学变化。
1.3.3肝组织p-STAT3表达①免疫组化法。切片烘烤脱蜡,抗原修复,每张切片加50 μL 3% H2O2,室温下孵育10 min,PBS冲洗;每张切片加50 μL兔抗大鼠单克隆抗体p-STAT3,4 ℃过夜,PBS冲洗;每张切片加50 μL聚合物增强剂,室温下孵育20 min,PBS冲洗;每张切片加50 μL抗鼠/兔聚合物,室温下孵育30 min,PBS冲洗;每张切片加50 μL新鲜配制的DAB,室温下显色5 min,蒸馏水冲洗。一抗的工作浓度为1∶100,以PBS作为阴性对照。p-STAT3阳性染色定位于细胞质及细胞核,呈淡黄色至棕褐色。②Western blotting法。取新鲜肝组织200 mg,RIPA裂解液裂解后冰浴下超声匀浆,4 ℃ 10 000 r/min离心15 min,取上清液,-80 ℃冰箱冻存。Bradford法蛋白定量,每孔加样量30 μg,SDS-PAGE电泳;蛋白转移至PVDF膜,新鲜配制的含5% BSA TBST液室温下封闭2 h,加入兔抗大鼠p-STAT3多克隆抗体(1∶500)和兔抗大鼠β-actin抗体(1∶500),4 ℃过夜;将膜取出,TBST液冲洗5 min×3次,加入HRP标记的山羊抗鼠IgG二抗孵育2 h;ECL显影,BandScan5.0凝胶电泳图像分析软件行条带灰度扫描,以β-actin为内参对p-STAT3灰度值行半定量分析。以上实验重复3次,取平均值。
2结果
2.1各组血清ALT、AST水平比较见表1。
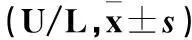
表1 各组ALT、AST水平比较
注:与假手术组同期比较,*P<0.05;与模型组同期比较,#P<0.05;与同组3、6 h比较,△P<0.05。
2.2各组肝组织病理变化光镜下,假手术组各时间点肝组织结构基本正常,无坏死、出血及中性粒细胞、淋巴细胞浸润;模型组制模3 h开始可见肝窦充血,肝细胞明显肿胀,肝索扭曲,细胞质空泡形成,肝细胞坏死,汇管区有大量中性粒细胞、淋巴细胞浸润,肝脏毛细血管充血、出血明显,以制模12 h最严重;血必净组各时点肝窦充血、肝细胞坏死以及汇管区中性粒细胞、淋巴细胞浸润等均较模型组明显减轻。
2.3各组肝组织p-STAT3表达比较免疫组化染色结果显示,假手术组肝组织p-STAT3不表达或弱阳性表达。模型组制模3 h可见少量p-STAT3阳性细胞,主要定位于细胞质;制模6 h肝组织p-STAT3表达开始增强,着色逐渐加深;制模12 h肝组织p-STAT3表达达高峰,胞质和胞核均可见阳性表达,以胞核为主。血必净组各时间肝组织p-STAT3表达较SAP组显著降低,阳性细胞减少,着色减弱。各组p-STAT3蛋白表达见表2。
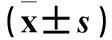
表2 各组肝组织p-STAT3蛋白表达比较
注:与假手术组同期比较,*P<0.05;与模型组同期比较,#P<0.05;与同组3、6 h比较,△P<0.05。
3讨论
SAP可产生大量炎症介质和细胞因子,如TNF-α、IL-6等。这些炎症介质和细胞因子可产生级联效应,引起全身炎性反应综合征(SIRS)或MODS。肝脏作为胰腺血液回流的第一站,又是多种细胞因子的灭活场所,因而成为SAP累及的主要胰外脏器。肝损害程度可反映SAP的严重程度[5],二者呈正相关[6]。一方面严重的肝功能损伤可发展为肝功能衰竭,增加SAP的病死率;另一方面肝功能损伤后,肝脏的解毒作用明显下降,致病因子容易侵入体循环,从而对全身其他器官造成损伤。酪氨酸蛋白激酶/信号转导与转录激活因子(JAK/STAT)通路是多种炎症细胞因子信号转导的共同通路之一[7],由一系列蛋白激酶瀑布组成。JAK2和STAT3是该家族中的重要成员,多种细胞因子包括NF-κB、TNF-α、IL-6等,可诱导JAK2活化,导致下游STAT3酪氨酸磷酸化为p-STAT3,最终引起一系列生化反应。p-STAT3表达水平能反映STAT3活化程度[8]。有研究表明,SAP肺损伤与STAT3活化密切相关[9~11]。亦有研究发现,STAT3可能在SAP早期即参与胰腺和肝组织的炎症反应,抑制STAT3途径可保护胰腺、肝组织损伤,其机制与调控JAK/STAT信号转导途径有关[12]。
血必净以血府逐瘀汤为底方,主要成分为红花、川穹、丹参、赤芍等,具有行气活血、清热凉血、解毒止痛之功效,可抑制炎症因子的释放,减轻炎症反应,常用于治疗脓毒血症、SIRS及MODS等。创伤性脓毒症发生时,细菌感染导致机体出现严重的SIRS,炎症细胞因子级联爆发,导致包括肝脏在内的各脏器继发性损伤。早期给予血必净可明显减轻炎症反应程度,增加肝脏蛋白合成能力,减少肝脏损伤[13,14]。临床研究发现,血必净对SAP并发的肝损伤有明显治疗作用[15,16],但目前其作用机制尚未完全清楚。
本研究结果显示,SAP组肝组织病理损伤明显,各时间点血清ALT、AST水平明显高于假手术组,制模12 h达高峰;经血必净治疗后,血清ALT、AST水平均明显下降,肝组织病理改善明显,提示血必净对SAP合并的肝损伤有一定治疗作用。本研究结果显示,SAP组早期肝组织中p-STAT3表达明显上调,随作用时间延长,其表达逐渐升高,至12 h达高峰;血必净组各时间点肝组织p-STAT3表达均较SAP组相应时间点明显降低,提示p-STAT3活化可能参与了SAP肝损伤的病理过程,血必净可能通过下调肝组织p-STAT3表达对SAP肝损伤发挥一定保护作用,但其具体机制尚需进一步研究。
参考文献:
[1] Lu CW, Liu LC, Hsieh YC, et al. Increased admission serum estradiol level is correlated with high mortality in patients with severe acute pancreatitis[J]. J Gastroenterol, 2013,48(3):374-381.
[2] 邵建伟,周伟君,盛慧球,等.血必净注射液对重症急性胰腺炎治疗中炎症因子的影响[J].中国新药与临床杂志,2013,32(5):379-382.
[3] 张彩娣,史建平.血必净注射液对支气管哮喘患者血清IgE、TNF-α的影响[J].江苏医药,2011,37(14):1706-1707.
[4] Lankisch PG, Ihse I. Bile-induced acute experimental pancreatitis[J]. Scand J Gastroenterol, 1987,22(3):257-260.
[5] 周琳,欧阳资武,付祖姣,等.急性胰腺炎伴肝损伤的临床分析[J].国际检验医学杂志,2013,34(4):412-414.
[6] Armbruster C, Kriwanek S. Multicentre audit of death from acute pancreatitis[J]. Br J Surg, 1994,81(11):1697-1703.
[7] Nobori K, Munehisa Y. Intracellular signaling pathwaysfor cardiac hypertrophy: ERK, JAK-STAT, S6 kinase[J]. Nihon Rinsho, 2007,65(Suppl 4):196-200.
[8] 钟敦璟,郭红,郝嘉,等.STAT3对大鼠重症急性胰腺炎血清体外作用AT-Ⅱ SP-C的影响[J].第三军医大学学报,2008,30(19):1807-1809.
[9] Chao KC, Chao KF, Chuang CC, et al. Blockade of interleukin 6 accelerates acinar cell apoptosis and attenuates experimental acute pancreatitis in vivo[J]. Br J Surg, 2006,93(3):332-338.
[10] 李敏利,朱人敏,张晓华,等.JAK2/STAT3信号通路在重症急性胰腺炎大鼠肺损伤中的作用[J].解放军医学杂志,2011,36(6):611-613.
[11] 徐志红,白永愉,黄新策,等.垂盆草提取物经JAK2/STAT3信号通路途径改善大鼠重症急性胰腺炎肺损伤的研究[J].肝胆胰外科杂志,2014,26(5):398-402.
[12] 梁志海,王珺平,唐国都.外源性IL-10对急性坏死性胰腺炎大鼠胰腺及肝组织STAT3表达的影响[J].世界华人消化杂志,2011,19(14):1457-1462.
[13] 高风江,任何菊,张玮曾,等.血必净注射液对创伤性脓毒症患者血清炎性反应、肝酶及蛋白合成的影响[J].临床合理用药,2015,8(2A):93-94.
[14] 田小溪,黄长形,曹义战,等.血必净联合异甘草酸美治疗药物性肝损伤30例[J].解放军医药杂志,2014,26(1):61-63.
[15] 尹岸民.血必净治疗对急性胰腺炎患者血浆炎性反应细胞因子的影响[J].吉林医学,2011,32(24):5047-5048.
[16] 方雪红,曹钏宏,管来顺.芒硝外敷联合血必净治疗急性胰腺炎临床疗效观察[J].陕西中医,2015,36(8):1039-1041.
(收稿日期:2015-10-12)
中图分类号:R657.5
文献标志码:A
文章编号:1002-266X(2016)08-0030-03
doi:10.3969/j.issn.1002-266X.2016.08.011
通信作者:陈卫昌(E-mail: weichangchen@126.com)
基金项目:南通市社会发展指导性计划(S11950)。

