SUMO特异性蛋白酶1在胰腺癌组织中的表达及其临床意义
曹维,张海峰,周国雄(南通大学附属医院,江苏南通226001)
·论著·
SUMO特异性蛋白酶1在胰腺癌组织中的表达及其临床意义
曹维,张海峰,周国雄(南通大学附属医院,江苏南通226001)
摘要:目的探讨SUMO特异性蛋白酶1(SENP1)在胰腺癌发生、发展中的作用。方法收集胰腺癌组织及其配对癌旁正常组织各44份,采用免疫组化法、Western blotting法和RT-PCR法检测SENP1蛋白和mRNA表达,并分析其表达与患者临床病理参数的关系。结果胰腺癌组织中SENP1蛋白的相对表达量、阳性表达率分别为1.18±0.11、90.9%(40/44),其配对癌旁正常组织分别为0.57±0.04、13.6%(6/44),二者比较P均<0.01。胰腺癌组织中SENP1 mRNA的相对表达量、阳性表达率分别为79.33±2.33、93.2%(41/44),其配对癌旁正常组织分别为16.67±1.20、13.6%(6/44),二者比较P均<0.01。胰腺癌组织中SENP1阳性表达与患者病理分期、血管侵犯有关(P均<0.05),与患者性别、年龄、肿瘤部位、肿瘤直径、分化程度和淋巴结转移无关(P均>0.05)。结论SENP1在胰腺癌组织中过表达,其过表达可促进胰腺癌的发生、发展。
关键词:胰腺癌;SUMO特异性蛋白酶1;免疫组化
胰腺癌恶性程度高,近年来其发病率和病死率呈逐年上升趋势。手术切除是治疗胰腺癌惟一有效的方法,但其完全切除率为20%左右,手术后患者中位生存时间仅20个月。胰腺癌的发病机制目前尚未完全阐明,故探索胰腺癌的发病机制对其早期诊断和靶向治疗具有重要意义。SUMO特异性蛋白酶是SUMO从靶蛋白上去除的特异性酶,广泛表达于各种肿瘤组织中,并参与其病理生理过程[1~3]。SUMO特异性蛋白酶共有6种类型,SUMO特异性蛋白酶1(SENP1)是其中一种。有研究发现,SENP1在前列腺癌、肝癌、结肠癌等组织中高表达,但其在胰腺癌中的表达情况鲜见报道。2007年1月~2014年1月,我们观察了SENP1在胰腺癌组织中的表达,并分析其表达与患者临床病理参数的关系,旨在探讨SENP1在胰腺癌发生、发展中的作用。
1资料与方法
1.1临床资料选择同期我院手术切除的胰腺癌组织及其配对癌旁正常组织各44份,均经术后组织病理学检查明确诊断。患者男21例、女23例,年龄40~78(66.8±9.2)岁;肿瘤部位:胰头29例,胰体尾15例;肿瘤直径:>2 cm 32例,≤2 cm 12例;组织分化程度:高分化12例,中分化14例,低分化18例;病理分期:Ⅰ期13例,Ⅱ期31例;有淋巴结转移17例,有血管侵犯32例。
1.2SENP1蛋白表达检测①定性检测:采用免疫组化法。取手术切除的胰腺组织,10%甲醛固定,石蜡包埋,5 μm厚连续切片,常规免疫组化染色。SENP1一抗及二抗工作浓度按1∶200稀释,DAB显色、苏木精复染,盐酸酒精分化;脱水、透明、封片、镜检。阴性对照采用PBS液体替代一抗,其他步骤同前。结果参照许良中等[4]采用的方法进行判断。②定量检测:采用Western blotting法。取新鲜胰腺癌组织及其配对癌旁组织,制备组织匀浆。蛋白定量后,取50 μg行Western blotting检测,以甘油醛-3-磷酸脱氢酶为内参。最后加ECL显色液发光,曝光、显影。以目的条带与内参条带的灰度比值表示蛋白的相对表达量。
1.3SENP1 mRNA表达检测采用TRIzol法提取胰腺癌组织及其配对癌旁组织总RNA,根据GenBank中基因序列自行设计引物。PCR引物采用Premier 5.0软件设计,由Invitrogen(上海)公司合成。SENP1引物序列:上游引物5′-AGTGAACCACAACTCCGTATTC-3′,下游引物5′-CAAATGTCCTTGCCTGGAAGATA-3′,产物长度112 bp;内参GAPDH引物序列:上游引物5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物5′-TGGTGAAGACGCCAGTGGA-3′,产物长度137 bp。PCR反应条件:94 ℃ 3 min,94 ℃ 30 s,55 ℃ 40 s,72 ℃ 40 s,共30个循环,最后72 ℃ 延伸10 min。PCR产物经电泳分离,用图像扫描仪测定吸光度,以目的条带与GAPDH条带的吸光度比值作为mRNA的相对表达量。过显影即为阳性表达。
2结果
2.1胰腺癌组织及配对癌旁正常组织SENP1蛋白表达比较SENP1蛋白阳性染色主要定位于胰腺癌细胞中,癌旁正常组织细胞中无明显表达。胰腺癌组织SENP1蛋白阳性表达率为90.9%(40/44),其配对癌旁正常组织为13.6%(6/44),二者比较P<0.01。胰腺癌组织SENP1蛋白的相对表达量为1.18±0.11,其配对癌旁正常组织为0.57±0.04,二者比较P<0.01。
2.2胰腺癌及其配对癌旁正常组织SENP1 mRNA表达比较胰腺癌组织SENP1 mRNA阳性表达率为93.2%(41/44),其配对癌旁正常组织为13.6%(6/44),二者比较P<0.01。胰腺癌组织SENP1 mRNA的相对表达量为79.33±2.33,其配对癌旁正常组织为16.67±1.20,二者比较P<0.01。
2.3胰腺癌组织SENP1蛋白阳性表达与患者临床病理参数的关系见表1。胰腺癌组织SENP1蛋白阳性表达与患者病理分期、血管侵犯有关(P均<0.05),与患者性别、年龄、肿瘤部位、肿瘤大小、分化程度和淋巴结转移无关(P均>0.05)。
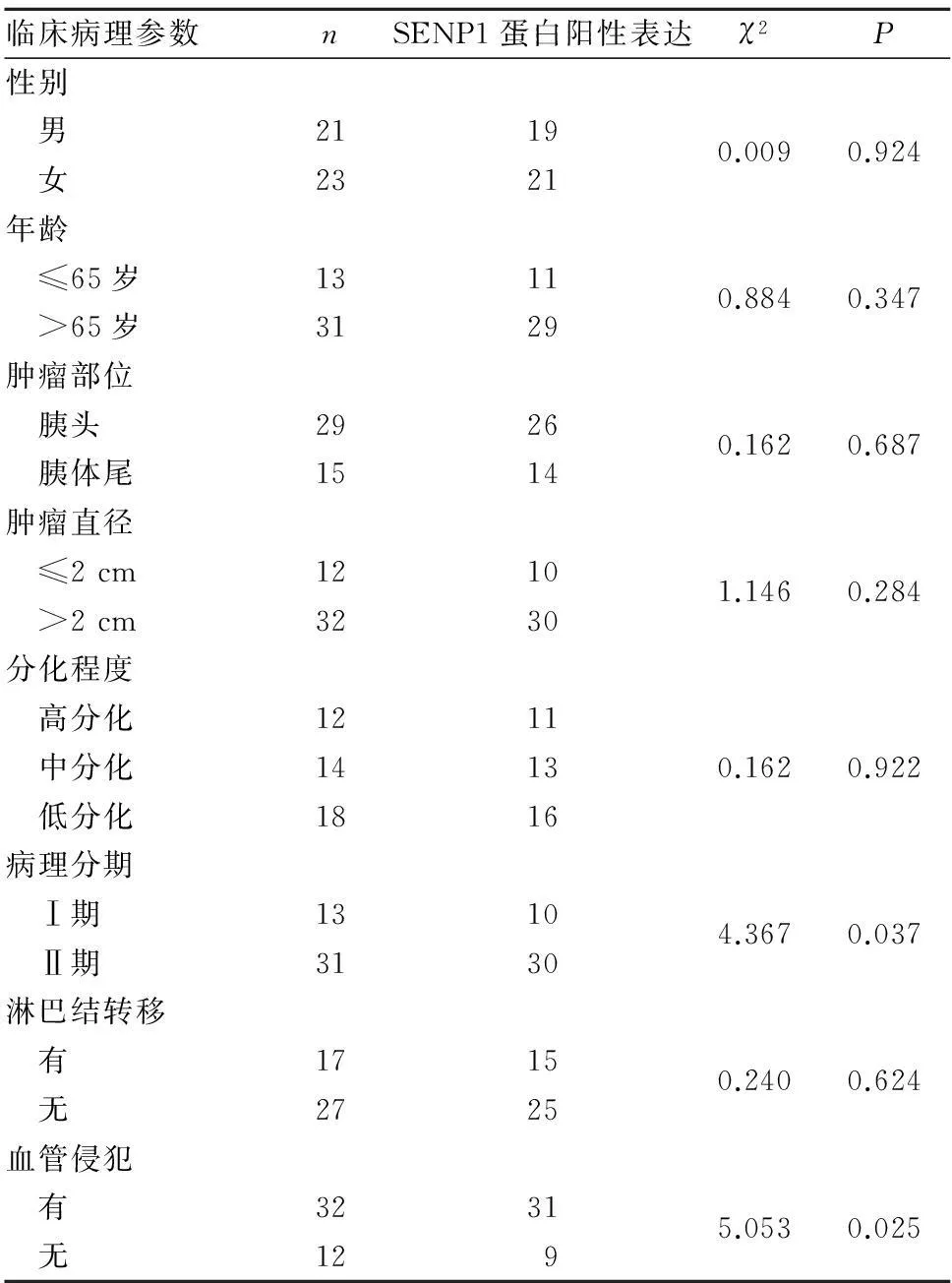
表1 胰腺癌组织SENP1蛋白阳性表达
3讨论
胰腺癌,尤其是导管腺癌具有很强的侵袭能力,易转移、复发,患者病死率极高[5],故探寻其靶向治疗的方法成为近年来研究热点。
SUMO是一种类泛素蛋白,在脊椎动物中有三种,分别是SUMO1、SUMO2和SUMO3。SUMO成员参与调控多种细胞靶蛋白的稳定性以及蛋白与蛋白的相互作用[6]。近年研究发现,SUMO化修饰还参与多种转录因子和辅助转录因子的调控[7,8]。因此,推测其与肿瘤的发生、发展密切相关。SUMO化修饰是一个可逆的动态过程,其SUMO特异性蛋白酶是将SUMO从靶蛋白上去除的特异性酶,目前在哺乳动物中已发现6种SENPs,其中SENP1是细胞核蛋白,能对多种SUMO化修饰的蛋白去SUMO化修饰。研究发现,SENP1在前列腺癌、肝癌、结肠癌等组织中高表达[9~11];SENP1可通过维持STAT5的SUMO化修饰平衡调节T细胞和B细胞生长[12];敲除SENP1基因会增强缺氧诱导因子-1α(HIF-1α)的SUMO化,进而导致HIF-1α降解,最终因新血管无法形成导致SENP1基因敲除的小鼠死亡[13]。说明SENP1在肿瘤发生过程中发挥重要作用。肖利云等[14]研究表明,SENP1是雄激素受体和c-Jun的强辅激活因子,在前列腺癌的发生、发展过程中具有重要作用。SENP1高表达与前列腺癌侵袭性和复发直接相关[11,15]。但目前SENP1在胰腺癌中的表达报道较少。2014年Ma等[16]研究发现,与相邻的正常组织比较,SENP1在胰腺导管腺癌组织中的表达上调;相关分析发现,SENP1过表达与肿瘤淋巴结转移和TNM分期有关。此外,基因敲除SENP1后,胰腺癌细胞的增殖、迁移和侵袭均受抑制。因此认为,SENP1在胰腺导管腺癌的进展和转移中起关键作用。本研究结果显示,癌旁正常组织SENP1蛋白阳性表达率低于胰腺癌组织,且表达位于胰腺癌细胞中,与Ma等[16]研究结果相似,提示SENP1可能参与胰腺癌的发生。SENP1阳性表达与胰腺癌患者性别、年龄、肿瘤部位、肿瘤大小等无关,提示胰腺癌早期即可能出现SENP1表达异常,及早检测SENP1阳性表达可能有助于胰腺癌的早期诊断。SENP1阳性表达与胰腺癌患者的病理分期和血管侵犯具有相关性,提示SENP1的阳性表达与胰腺癌的转移密切相关。
综上所述,胰腺癌组织中SENP1过表达,其过表达与肿瘤分期和血管侵犯有关。SENP1有可能成为治疗胰腺癌的一个潜在靶点。
参考文献:
[1] Burdelski C, Menan D, Tsourlakis MC, et al. The prognostic value of SUMO1/Sentrin specific peptidase 1 (SENP1) in prostate cancer is limited to ERG-fusion positive tumors lacking PTEN deletion[J]. BMC Cancer, 2015(15):538.
[2] Bawa-Khalfe T, Cheng J, Wang Z, et al. Induction of the SUMO-specific protease 1 transcription by the androgen receptor in prostate cancer cells[J]. J Biol Chem, 2007,282(52):37341-37349.
[3] Cheng J, Wang D, Wang Z, et al. SENP1 enhances androgen receptor dependent transcription through desumoylation of histone deacetylase 1[J]. Mol Cell Biol, 2004,24(13):6021-6028.
[4] 许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
[5] Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014,64(1):9-29.
[6] Gill G. SUMO and ubiquitin in the nucleus: different functions, similar mechanisms[J]. Genes Dev, 2004,18(17):2046-2059.
[7] Girdwood D, Bumpass D, Vaughan OA, et al. P300 transcriptional repression is mediated by SUMO modification[J]. Mol Cell, 2003,11(4):1043-1054.
[8] Wu HJ, Sun L, Zhang Y, et al. Coordinated regulation of AIB1 transcriptional activity by sumoylation and phosphorylation[J]. J Biol Chem, 2006,281(31):21848-21856.
[9] 黄弦,吴际,程金科.SUMO特异性蛋白酶1在动脉粥样硬化发病机制中的作用[J].上海交通大学学报(医学版),2012,32(8):1056-1059.
[10] 程金科,徐颖,左勇,等.SUMO特异性蛋白酶1在结肠癌肿瘤血管中的作用及机制研究[J].中国病理生理杂志,2010,26(10):2008.
[11] Wang Q, Xia N, Li T, et al. SUMO-specific protease 1 promotes prostate cancer progression and metastasis[J]. Oncogene, 2013,32(19):2493-2498.
[12] Van Nguyen T, Angkasekwinai P, Dou H, et al. SUMO-specific protease 1 is critical for early lymphoid development through regulation of STAT5 activation[J]. Mol Cell, 2012,45(2):210-221.
[13] Cheng J, Kang X, Zhang S, et al. SUMO-specific protease 1 is essential for stabilization of HIF1alpha during hypoxia[J]. Cell, 2007,131(3):584-595.
[14] 肖利云,杨春华,邢欣荣,等.SENP1与前列腺癌[J].中国生物化学与分子生物学报,2008,24(3):209-213.
[15] 程金科.SUMO蛋白酶1与肿瘤[J].癌症,2008,27(7):771-774.
[16] Ma C, Wu B, Huang X, et al. SUMO-specific protease 1 regulates pancreatic cancer cell proliferation and invasion by targeting MMP-9[J]. Tumour Biol, 2014,35(12):12729-12735.
Expression of SUMO specific protease 1 in pancrestic cancer and its clinical significance
CAOWei,ZHANGHaifeng,ZHOUGuoxiong
(AffiliatedHospitalofNantongUniversity,Nantong226001,China)
Abstract:ObjectiveTo investigate the function of SUMO specific protease 1 (SENP1) in the occurrence and development of pancreatic cancer. MethodsForty-four cases of pancreatic cancer tissues and paired adjacent tissues were collected. The protein and mRNA expression of SENP1 was detected by immunohistochemistry, Western blotting and RT-PCR, and we analyzed its relationship with the clinicopathological parameters. ResultsThe SENP1 protein expression in the pancreatic cancer tissues was higher than that in the adjacent tissues (1.18±0.11 vs. 0.57±0.04), and the positive rate of SENP1 protein expression in the pancreatic cancer tissues was higher than that in the adjacent tissues [90.9%(40/44) vs. 13.6%(6/44)] (all P<0.01). The SENP1 mRNA expression in the pancreatic cancer tissues was higher than that in the adjacent tissues (79.33±2.33 vs. 16.67±1.20), and the positive rate of SENP1 mRNA expression in the pancreatic cancer tissues was higher than that of the adjacent tissues [93.2%(41/44) vs. 13.6%(6/44)] (all P<0.01). The positive protein expression of SENP1 was associated with pathological stage and vascular invasion in the pancreatic cancer tissues (all P<0.05). But it was not associated with gender, age, tumor location, tumor size, differentiation and lymph node metastasis (all P>0.05). ConclusionSENP1 is over-expressed in the pancreatic cancer tissues and the overexpression of SENP1 promotes the occurrence and development of pancreatic cancer.
Key words:pancreatic carcinoma; SUMO specific protease 1; immunohistochemistry
(收稿日期:2015-00-00)
中图分类号:R735.9
文献标志码:A
文章编号:1002-266X(2016)08-0001-03
doi:10.3969/j.issn.1002-266X.2016.08.001
通信作者简介:周国雄(1964-),男,主任医师,博士生导师,研究方向为胰腺肿瘤,曾获江苏省医学科技奖三等奖1项。E-mail: zhouguoxiong@medmail.com.cn
作者简介:第一曹维(1982-),男,主治医师,研究方向为胰腺肿瘤,曾获南通市科技进步二等奖1项。E-mail: 110414992@qq.com
基金项目:国家自然科学基金资助项目(81072028);江苏省医学创新团队与领军人才项目(LJ201135)。

