米非司酮服用后不同时点早孕妇女绒毛组织形态及雌、孕激素受体表达观察
韩华,赵红伟,李洁,闫萍
(河北省人民医院,石家庄050051)
米非司酮服用后不同时点早孕妇女绒毛组织形态及雌、孕激素受体表达观察
韩华,赵红伟,李洁,闫萍
(河北省人民医院,石家庄050051)
摘要:目的观察米非司酮服用后不同时点人早孕绒毛组织形态及雌激素受体(ER)、孕激素受体(PR)表达变化。方法自愿要求终止早期妊娠的女性80例,随机分为对照组、12 h组、24 h组、48 h组各20例。12 h组、24 h组、48 h组口服米非司酮150 mg,分别于服药12、24、48 h后施行负压吸引术,留取各组吸宫术后的绒毛组织。对照组未服用任何药物,直接采用常规负压吸引术终止妊娠。光镜、透射电镜下观察四组绒毛组织形态学及超微结构改变,采用免疫组化法检测各组绒毛组织中的ER、PR。结果12 h组、24 h组、48 h组绒毛滋养层细胞变性、坏死甚至脱落,炎症细胞浸润,绒毛间质水肿,细胞超微结构破坏。对照组、12 h组、24 h组、48 h组绒毛组织中ER相对表达量分别为0.182 4±0.007 2、0.119 1±0.005 9、0.120 8±0.011 0、0.121 2±0.007 3,各组绒毛组织中PR相对表达量分别为0.179 0±0.008 2、0.132 7±0.007 0、0.128 5±0.006 5、0.126 2±0.010 9,12 h组、24 h组、48 h组ER、PR相对表达量与对照组相比,P均<0.05。结论 米非司酮作用后12 h绒毛组织发生变性坏死,ER、PR表达受到抑制。
关键词:米非司酮;雌激素受体;孕激素受体;绒毛组织
目前比较成熟的药物流产方案主要为米非司酮口服并48 h后米索前列醇口服,完全流产率90%以上[1,2]。但这种方法所需时间较长,若能将两药间隔时间缩短,可大大方便患者。米非司酮通过与孕激素受体(PR)结合阻断孕激素作用,引起蜕膜绒毛组织变性坏死,诱发流产。米非司酮的作用机制涉及到多个方面[3],其中包括对绒毛组织中雌激素受体(ER)和PR表达的调节。我们观察了米非司酮服用后不同时点早孕绒毛组织形态及ER、PR表达变化,探讨缩短米非司酮与米索前列醇用药间隔的可行性。
1资料与方法
1.1临床资料河北省人民医院妇产科门诊自愿要求终止早期妊娠的孕妇80例,年龄18~40岁;停经<49 d;经妇科检查、尿妊娠试验及B超证实为宫内早孕;平时月经规律,经量正常;半年内未服用激素类药物,无生殖系统炎症及肿瘤。将80例研究对象随机分为对照组、12 h组、24 h组、48 h组,每组20例。本研究已获得患者及家属知情同意。
1.2米非司酮用法及绒毛组织的获取12 h组、24 h组、48 h组均口服米非司酮(25 mg/片,浙江仙居制药股份有限公司)150 mg,分别于服药12、24、48 h后进行负压吸引术。对照组未服用任何药物,直接采用常规负压吸引术终止妊娠。吸宫术后分别留取各组新鲜绒毛组织。
1.3绒毛组织形态观察取新鲜绒毛组织,4%多聚甲醛固定,24 h后常规梯度酒精脱水,二甲苯透明,石蜡浸透、包埋,制成蜡块,6 μm厚切片,取4片蜡带分别裱于涂有蛋白甘油的载玻片上,HE染色,光镜下观察绒毛组织形态。将收集的绒毛组织切成约1 mm3的小块放入4%戊二醛中前固定,PBS清洗,加入1%锇酸中后固定,乙醇梯度脱水,丙酮脱水,先后用丙酮与树脂配比分别为3∶1、1∶1、1∶3的混合液浸透,纯树脂浸透,包埋、聚合,制作50 nm厚的超薄切片,醋酸铀、柠檬酸铅室温染色,日立H-7500型透射电子显微镜观察、照相。
1.4绒毛组织中ER、PR检测采用免疫组化法检测ER、PR,每次染色均同步设有阳性对照和阴性对照,按试剂盒说明书操作。ER、PR阳性染色为细胞内出现棕黄色颗粒。每张切片在光镜(400×)下随机选取5个不同的视野,图像输入电子计算机后,经Motic Med6.0数码医学图像分析系统处理,在相同放大倍数下,以阳性目标平均光密度值(OD值)代表蛋白相对表达量。
2结果
2.1各组绒毛组织形态学改变对照组绒毛滋养层细胞结构清晰,外层为合体滋养细胞,内层为细胞滋养细胞;为单层立方形细胞,细胞界限清晰,胞质透明,核圆、浅染;绒毛间质疏松,可见毛细血管及梭形结缔组织细胞。12 h组绒毛滋养层细胞变性、坏死甚至脱落,并见炎症细胞浸润,绒毛间质水肿,内有血液淤积和纤维素沉积。24 h组、48 h组变化基本同12 h组(见图1)。

注:A为对照组;B为12 h组;C为24 h组;D为48 h组。
图1各组绒毛组织形态学变化
2.2各组绒毛组织超微结构改变对照组绒毛组织合体滋养细胞表面有大量微绒毛,细胞核形不规则,常染色质丰富,核仁明显,胞质内含有丰富的粗面内质网、线粒体和游离核糖体,可见少量脂滴;细胞滋养细胞位于基膜之上,呈椭圆形,胞质内细胞器较少;合体滋养细胞与细胞滋养细胞之间呈桥粒连接。12 h组合体滋养细胞表面微绒毛数量减少,细胞质高度水肿,胞质内粗面内质网轻度扩张,线粒体部分嵴融合、消失,游离核糖体减少,可见脂滴;细胞滋养细胞变扁、变小,细胞轮廓不清,粗面内质网高度不规则扩张,腔内有分泌物,有轻度脱颗粒现象;合体滋养细胞与细胞滋养细胞之间的连接结构松弛,细胞间隙增宽。24 h组、48 h组超微结构改变与12 h组相近(见图2)。
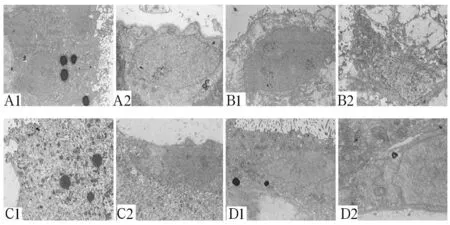
注:A1、A2为对照组;B1、B2为12 h组;C1、C2为24 h组;D1、D2为48 h组。
图2各组绒毛组织超微结构改变
2.3各组绒毛组织中ER、PR表达比较对照组绒毛组织中ER相对表达量为0.182 4±0.007 2,12 h组、24 h组、48 h组分别为0.119 1±0.005 9、0.120 8±0.011 0、0.121 2±0.007 3,12 h组、24 h组、48 h组与对照组相比,P均<0.05。对照组绒毛组织中PR相对表达量为0.179 0±0.008 2,12 h组、24 h组、48 h组分别为0.132 7±0.007 0、0.128 5±0.006 5、0.126 2±0.010 9,12 h组、24 h组、48 h组与对照组相比,P均<0.05。
3讨论
药物流产作为一种非手术终止早期妊娠的途径,简便、安全、高效,在临床得到广泛应用。其中,以米非司酮配伍米索前列醇方案应用最多[4,5]。
既往文献报道,米非司酮能明显增强妊娠子宫对外源性前列腺素的敏感性,尤其在服用米非司酮后36~48 h最敏感,且临床研究发现当米非司酮与米索前列醇用药间隔为48 h时流产效果最好[6],因而国内外药物流产方案中米非司酮与米索前列醇的用药间隔一般为48 h。但从米非司酮的代谢特点来看,其半衰期在24~48 h,提示将米非司酮与米索前列醇的用药间隔缩短至24~48 h也可能达到相同的流产效果。研究[7]表明,米非司酮(100 mg)用药后24 h阴道放置米索前列醇对终止<63 d的妊娠是可行的。有学者[8]比较了口服米非司酮(200 mg)后6~8 h阴道放置米索前列醇与服药后24 h放置米索前列醇的效果,发现两种方案效果近似,且前者恶心、呕吐、阴道大量出血等不良反应发生率更低。目前国内外已进行多项有关缩短用药间隔的临床研究[9],但尚缺乏充足的理论依据。
我们通过光镜观察发现,正常早孕绒毛组织结构发育良好,外层为合体滋养细胞,内层为细胞滋养细胞,细胞界限清楚,间质疏松。服用米非司酮后,绒毛滋养层细胞有广泛变性、坏死甚至脱落,绒毛间质水肿。本研究中三个用药组均具备上述特征。这表明在米非司酮作用后12 h绒毛组织就已发生形态改变,细胞变性、坏死。进一步通过透射电镜观察绒毛组织超微结构,我们发现正常早孕绒毛组织表面有大量微绒毛,而米非司酮作用后12 h微绒毛减少、脱落,细胞内粗面内质网扩张,有脱颗粒现象,这说明米非司酮作用后12 h体内PR生物活性便受到抑制,绒毛组织细胞脱落,引发流产。
米非司酮可拮抗PR的生物学效应,对胚胎及其支持组织的代谢和形态结构产生多方面影响[10~12],其中对ER、PR的影响最为重要[13]。早期研究认为米非司酮不能直接作用于绒毛组织,其可通过引起蜕膜组织坏死、出血、脱落,使绒毛血供不足,发生退行性变;近年研究发现,米非司酮可直接作用于绒毛组织,改变ER/PR正常生理平衡,抑制滋养细胞增殖,诱导并促进其凋亡,导致绒毛蜕膜组织不同程度变性、坏死[14~16]。我们发现,正常早孕绒毛组织中存在中等强度表达的ER、PR,经米非司酮作用后ER、PR虽仍有表达,但表达水平较对照组明显下降,提示米非司酮可抑制绒毛组织中ER、PR的表达。三个用药组之间,ER、PR相对表达量差异无统计学意义,提示服用米非司酮后12 h对绒毛组织即有抑制作用,绒毛滋养细胞变性、坏死,从而达到流产的目的。
综上所述,米非司酮作用后12 h就可对早孕绒毛组织产生影响,将米非司酮与米索前列醇用药间隔缩短至12 h的方案理论上是可行的。若能经过大量临床试验证实并推广应用,有望简化服药流程。
参考文献:
[1] Kulier R, Kapp N, Gulmezoqlu AM, et al. Medical methods for first trimester abortion[J]. Cochrane Database Syst Rev, 2011,9(11):CD002855.
[2] Li CL, Chen DJ, Deng YF, et al. Feasibility and effectiveness of unintended pregnancy prevention with low-dose mifepristone combined with misoprostol before expected menstruation[J]. Hum Reprod, 2015,30(12):2794-2801.
[3] Mei-Ling L, Xin-Quan S, Meng-Chun J. Differentially expressed genes in early gestational chorionic villi after administration of mifepristone[J]. Gynecol Endocrinol, 2011,27(6):371-378.
[4] 梅顺利,范湘玲,刘燕,等.米非司酮药物流产不同服用方法的探讨[J].北京医学,2012,34(11):1009-1010.
[5] 温永红.米非司酮配伍米索前列醇终止10-18周妊娠效果观察[J].中国计划生育学杂志,2012,20(1):49-50.
[6] 王丽君,张洪然,白俊香,等.不同给药间隔对含珠停终止早孕的观察研究[J].河北医药,2008,30(7):1058.
[7] 顾向应,李丽,范庆春,等.早孕药物流产时米非司酮剂量和不同作用时间对蜕膜类固醇受体表达的影响[J].生殖与避孕,2008,28(8):467-470.
[8] Creinin MD, Fox MC, Teal S, et al. A randomized comparison of misoprostol 6 to 8 hours versus 24 hours after mifepristone for abortion[J]. Obstet Gynecol, 2004,10(3):851-859.
[9] Raymond EG, Shannon C, Weaver MA, et al. First-trimester medical abortion with mifepristone 200mg and misoprostol a systematic review[J]. Contraception, 2013,87(1):26-37.
[10] Powell SA, Smith BB, Timm KL, et al. Expression of estrogen receptors in the corpus luteum and uterus from non-pregnant and pregnant llamas[J]. Mol Reprod Dev, 2007,74(8):1043-1052.
[11] 谢小英.影响米非司酮配伍米索前列醇终止早孕效果的相关因素分析[J].中国医药指南,2013,11(11):602-603.
[12] Pei K, Yu C, Shi X, et al. The effects of mifepristone on the expressions of osteopontin, interleukin-6 and leukemia inhibitory factor in the villi of early pregnant women[J]. Contraception, 2010,82(4):379-384.
[13] Pinto NB, Morais TC, Carvalho KM. Topical anti-inflammatory potential of Physalin E from Physalis angulata on experimental dermatitis in mice[J]. Phytomedicine, 2010,17(10):740.
[14] 孟春霞,孙晓溪,张慧娟,等.米非司酮对早孕绒毛、蜕膜的影响[J].生殖与避孕,2006,26(9):566-572.
[15] 杨倩,王健,孙兆贵.米非司酮终止妊娠作用机制的研究进展[J].生殖与避孕,2015,35(8):561-565.
[16] 邱惠芳,李金花,杨文君.米非司酮对早孕绒毛蜕膜组织细胞增殖及凋亡的影响[J].中国现代医学杂志,2015,25(2):76-78.
Changes in morphology of chorion tissue and expression of estrogen receptor and progesterone receptor in early pregnant women at different time points after taking mifepristone
HANHua,ZHAOHongwei,LIJie,YANPing
(HebeiGeneralHospital,Shijiazhuang050051,China)
Abstract:ObjectiveTo observe the changes in morphology of chorion tissue and expression of estrogen receptor (ER) and progesterone receptor (PR) in early pregnant women at different time points after taking mifepristone. MethodsEighty women who desire to terminate the early pregnancy were randomly divided into the control group, 12-hour group, 24-hour group and 48-hour group, and each group contained 20 cases. Women in the 12-hour group, 24-hour group and 48-hour group took 150 mg mifepristone. Negative pressure suction were performed after 12, 24 and 48 hours respectively in the three groups. The chorion tissue were collected after suction. We observe the morphological change of chorion tissue by light microscope and transmission electron microscope. Detecting the expression of ER and PR in the chorion tissue by immunohistochemistry. ResultsThree medication groups showed the cell degenerated, some were necrotic, even fell off, the inflammatory cell infiltrated, the chorion interstitial had edema and the ultrastructure was damaged. The relative expression levels of ER in the control group, 12-hour group, 24-hour group and 48-hour group were 0.182 4±0.007 2, 0.119 1±0.005 9, 0.120 8±0.011 0 and 0.121 2±0.007 3. The relative expression levels of PR were 0.179 0±0.008 2, 0.132 7±0.007 0, 0.128 5±0.006 5 and 0.126 2±0.010 9. Significant differences were found in the ER and PR between the three medication groups and control group (all P<0.05). ConclusionThe chorion tissue degenerates and shows necrosis and the expression of ER and PR is inhibited after taking mifepristone twelve hours.
Key words:mifepristone; estrogen receptor; progesterone receptor; chorion tissues
(收稿日期:2015-11-17)
中图分类号:R715.2
文献标志码:A
文章编号:1002-266X(2016)07-0007-03
doi:10.3969/j.issn.1002-266X.2016.07.003
作者简介:第一韩华(1982-),女,硕士,主治医师,主要研究方向为妇产科计划生育。E-mail: 323242844@qq.com

