AKT基因沉默对人卵巢癌细胞增殖及Fas、Fas L、Caspase-3蛋白表达的影响
刘曼,胡明英,王晓莉,李敏
(1潍坊医学院,山东潍坊261041;2潍坊市人民医院;3嘉祥县人民医院)
AKT基因沉默对人卵巢癌细胞增殖及Fas、Fas L、Caspase-3蛋白表达的影响
刘曼1,胡明英2,王晓莉1,李敏3
(1潍坊医学院,山东潍坊261041;2潍坊市人民医院;3嘉祥县人民医院)
摘要:目的观察丝氨酸/苏氨酸蛋白激酶(AKT)基因沉默对人卵巢癌细胞株SKOV3增殖及细胞中Fas、FasL、半胱氨酸天冬氨酸蛋白酶3(Caspase-3)表达的影响。方法 体外培养SKOV3细胞,随机分为对照组、空白载体组与实验组。空白载体组加入脂质体、不转染AKT siRNA,实验组转染AKT siRNA,对照组不给予任何干预措施。转染24 h后观察各组细胞增殖情况,采用免疫荧光双重标记法检测各组细胞中的Fas、FasL、Caspase-3蛋白。结果实验组细胞密度低于对照组、空白载体组,且细胞突起减少,胞体折光性减弱,细胞变圆离壁。实验组细胞密度为27.31%±1.22%,空白载体组、对照组分别为89.56%±2.17%、92.01%±3.22%,实验组与空白载体组、对照组相比,P均<0.05;实验组细胞增殖率为31.17%±1.38%,空白载体组、对照组增殖率分别为183.77%±4.22%、181.56%±3.77%,实验组与空白载体组、对照组相比,P均<0.01。实验组Fas、FasL、Caspase-3蛋白阳性表达率分别为18.62%±0.78%、85.69%±1.34%、74.22%±2.11%,空白载体组分别为14.01%±0.12%、58.67%±1.33%、43.24%±1.02%,对照组分别为16.06%±0.03%、32.77%±1.07%、38.01%±0.92%,实验组细胞中Caspase-3、FasL蛋白阳性表达率与空白载体组、对照组相比,P均<0.05。结论 AKT基因沉默后,SKOV3细胞增殖受到抑制,且细胞中FasL、Caspase-3蛋白表达上调。
关键词:卵巢癌;SKOV3细胞;丝氨酸/苏氨酸蛋白激酶基因;半胱氨酸天冬氨酸蛋白酶3;Fas蛋白;FasL蛋白;RNA干扰技术
目前卵巢癌的治疗以手术、化疗、放疗为主,但疗效不理想,5年生存率在25%~30%[1]。RNA干扰(RNAi)技术通过短双链RNA(dsRNA)特异降解靶基因从而阻断靶基因表达,在肿瘤治疗方面有很好的应用前景[2]。丝氨酸/苏氨酸蛋白激酶(AKT)信号通路是参与细胞生长、增殖、分化调节的重要信号转导通路,与卵巢癌的发生发展密切相关[3,4]。2013年10月~2014年9月,我们设计并合成AKT基因的靶向siRNA,观察AKT基因沉默对卵巢癌细胞中PI3K/AKT信号通路相关蛋白Fas、FasL、半胱氨酸天冬氨酸蛋白酶3(Caspase-3)表达的影响,为卵巢癌的基因治疗提供理论依据。
1材料与方法
1.1实验材料人卵巢浆液性乳头状囊腺癌细胞株SKOV3(上海中国科学院细胞库),McCoy5A培养基(北京博润莱特公司),胎牛血清(美国Gibco公司),0.25%胰蛋白酶(Trypsin,江苏碧云天生物技术研究所),二甲基亚砜(DMSO,美国Sigma公司),正常山羊血清工作液(北京中杉金桥公司),TritonX-100(江苏碧云天生物技术研究所),兔抗小鼠Fas单克隆抗体(武汉博士德生物公司),小鼠抗山羊FasL单克隆抗体(武汉博士德生物公司),小鼠抗山羊Caspase-3单克隆抗体(武汉博士德生物公司),FITC标记的山羊抗小鼠IgG、FITC标记的山羊抗兔IgG(北京中杉金桥公司)。
1.2细胞培养与分组SKOV3细胞体外培养于含10%胎牛血清、90%的Mc-coy5A、青霉素100 μL/mL、链霉素100 μL/mL的培养基中,37 ℃、5%CO2培养。将细胞悬液以5×104/孔的密度接种于24孔板,培养24 h,当细胞融合80%~90%时进行转染。将细胞分为对照组、空白载体组、实验组。
1.3AKT siRNA的制备及转染化学合成靶向AKT的siRNA序列,由上海吉玛制药技术有限公司设计与合成。AKT siRNA按说明书稀释配置。实验组加入AKT siRNA 与Lipofectamin2000混合液500 μL;对照组加入Mc-coy5A培养液500 μL;空白载体组加入只含Lipofectamin2000的Mc-coy5A培养液500 μL。各组转染6 h后更换完全培养液,继续培养24 h,然后进行检测。
1.4细胞增殖观察取各组已爬好片的24孔板,通过去培养基,PBS冲洗3次,4%多聚甲醛固定20 min,激光共聚显微镜拍照。每个标本随机取10个视野,激光共聚显微镜下计数每个视野的细胞数,取平均值。用公式计算细胞密度及细胞增殖率:细胞密度=单位面积平均细胞数;细胞增殖率=单位面积平均细胞数/单位面积接种细胞数×100%。
1.5SKOV3细胞中Fas、FasL、Caspase-3蛋白检测取爬好片的24孔板,去培养基,PBS冲洗3次,4%多聚甲醛固定20 min,含0.1%TritonX-100的PBS透膜30 min,PBS冲洗3次,进口山羊血清封闭液37 ℃下封闭30 min;弃封闭液,添加一抗(分别为兔抗Fas的一抗、小鼠抗FasL的一抗、小鼠抗活性Caspase-3的一抗),4 ℃冰箱过夜;次日取出,37 ℃孵育30 min,PBS冲洗3次,分别避光滴加FITC标记的山羊抗小鼠及FITC标记的山羊抗兔荧光二抗,37 ℃孵育60 min,PBS洗3次;DAPI封片,正置荧光显微镜拍照。计算阳性细胞百分比,0为阴性(-)、<25%为弱阳性(+)、25%~75%为中阳性(++)、>75%为强阳性(+++)。
2结果
2.1各组细胞增殖情况比较对照组、空白载体组细胞轮廓清晰,细胞突起明显,胞体折光度好。实验组细胞突起减少,胞体折光性减弱,细胞变圆离壁。见图1。实验组细胞密度为27.31%±1.22%,空白载体组、对照组分别为89.56%±2.17%、92.01%±3.22%,实验组与空白载体组、对照组相比,P均<0.05;实验组细胞增殖率为31.17%±1.38%,空白载体组、对照组增殖率分别为183.77%±4.22%、181.56%±3.77%,实验组与空白载体组、对照组相比,P均<0.01。
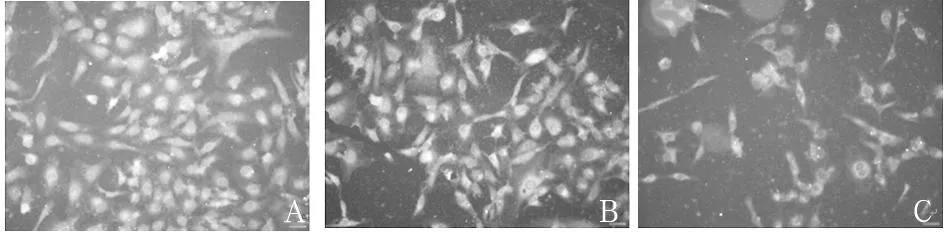
注:A为对照组;B为空白载体组;C为实验组。
图1各组细胞增殖情况
2.2各组细胞中Caspase-3、Fas、FasL蛋白表达比较实验组Fas、FasL、Caspase-3蛋白阳性表达率分别为18.62%±0.78%、85.69%±1.34%、74.22%±2.11%,空白载体组分别为14.01%±0.12%、58.67%±1.33%、43.24%±1.02%,对照组分别为16.06%±0.03%、32.77%±1.07%、38.01%±0.92%,实验组细胞中Caspase-3、FasL蛋白阳性表达率与空白载体组、对照组相比,P均<0.05。
3讨论
PI3K/AKT信号通路在肿瘤发生发展中发挥重要作用。在正常组织中PI3K/AKT信号通路处于活化状态,但如果被过度激活则可刺激蛋白质合成,抑制细胞凋亡,导致细胞无限增殖,进而引发肿瘤[5]。虽然关于PI3K/AKT信号通路的研究较多,但该通路在肿瘤发生及侵袭转移中的作用机制尚不明确[6]。近年来,基因治疗得到很大发展,即把正常基因或重组后的具有治疗作用的基因导入到异常细胞的DNA中,抑制致病、致癌基因的表达并修复缺陷及损伤基因[7]。目前,阻断PI3K/AKT信号通路已成为多种肿瘤治疗研究中的热点[8]。
RNAi技术可导致目的基因表达下调,选择性地沉默目的基因[9,10]。我们课题组通过RNAi技术沉默AKT基因表达[11],观察干扰后卵巢癌细胞增殖及凋亡蛋白表达情况,分析卵巢癌基因治疗的机制[12]。Fas蛋白属于TNF受体家族,其配基为FasL[13]。Fas/FasL凋亡通路是细胞毒性T淋巴细胞(CTL)识别和杀死肿瘤细胞、病毒感染细胞、衰老细胞的主要途径之一[14]。研究[15]表明,卵巢癌中Fas蛋白阳性表达率低于良性卵巢肿瘤,该蛋白表达增加可启动凋亡受体途径[16]。Caspase-3蛋白是Caspase家族中最重要的细胞凋亡相关蛋白,在细胞凋亡早期被激活。
本研究结果显示,实验组转染AKT siRNA后,细胞增殖受到抑制,FasL、Caspase-3蛋白阳性表达率增高,提示抑制AKT基因表达后,PI3K/AKT信号通路作用受到影响,激活细胞凋亡程序,抑制细胞增殖,这些作用可能与调节FasL、Caspase-3蛋白表达有关。关于沉默AKT基因表达后调控Fas蛋白表达、激活凋亡受体途径的具体机制,尚有待进一步研究。
参考文献:
[1] 祝颖,王旭.RNAi技术应用于妇科肿瘤治疗的研究进展[J].临床医学工程,2009,16(5):100-102.
[2] 梁玉林,胡明英,王小莉,等.RNA沉默PI3K、AKT基因对人卵巢SKOV3细胞增殖和凋亡研究的比较[J].青岛医药卫生,2013,4(1):1-3.
[3] 曾慧敏.PI3K/AKT通路与肿瘤治疗[J].中国肿瘤生物治疗杂志,2008,15(1):82-85.
[4] Liu X, Sempere LF, Galimberti F, et al. Uncovering growth-suppressive MicroRNAs in lung cancer[J]. Clin Cancer Res, 2009,15(4):1177-1183.
[5] 胡明英,毕学辉,刘晓文,等.RNA干扰沉默AKT基因对卵巢癌SKOV3细胞增值与凋亡影响研究[J].中华肿瘤防治杂志,2013,20(24):1869-1873.
[6] 刘颖,吴金如,高元勋.Fas、FasL在非小细胞肺癌中的表达及其与肿瘤免疫和细胞凋亡的关系[J].西安交通大学学报,2011,32(1):86-91.
[7] Nakata W, Hayakawa Y, Nakagawa H, et al. Anti-tumor activity of the proteasom inhibitor bortezomib in gastric cancer[J]. Int J Oncol, 2011,39(6):1526-1529.
[8] 李震东,马清涌,罗羽宏.Fas/FasL介导的Caspase-3活化与急性胰腺炎腺泡细胞凋亡的关系[J].中国病理生理杂志,2009,25(6):1197-1201.
[9] 王晓天.P38MAPK介导的Fas/Fasl凋亡信号通路在大鼠抗GBM肾炎中的作用[J].中国免疫学杂志,2012,28(12):979-985.
[10] 张小芳,李守霞.RNA干扰技术的研究及进展[J].医学综述,2012,18(18):3040-3043.
[11] Ramachandran PV, Ignacimuthu S. RNA interferences as aplausi-bleanticancer the rapeutic tool[J]. Asian Pac T Cancer Prev, 2012,13(6):2445-2452.
[12] 鲁艳明,银铎,孟丽荣,等.siRNA干扰XIAP基因对卵巢癌SKOV3细胞生物学功能影响的研究[J].中华肿瘤防治杂志,2011,18(7):506-508, 520.
[13] Frias C, Pampalona J, Genesca A, et al. Telomere dysfunction and genome instability[J]. Front Biosci, 2012,17(11):2181-2196.
[14] 张兴民,蒋明,郑德先,等.类风湿关节炎病人滑膜细胞增生与fas和Bcl-2基因的表达[J].中华医学杂志,1998,78(3):175-179.
[15] 张媛媛,苏海燕,秦苏萍,等.Fas/FasL诱导细胞凋亡在大鼠抗肾炎中的作用[J].中国现代医学杂志,2010,20(14):2122-2127.
[16] 臧颖,陈秋英,李玉莹,等.NF- KappaB、p38MAPK和JNK通路在运动神经损伤引起的大鼠病理性疼痛中的作用及机制[J].中山大学学报,2009,30(6):645-651.
(收稿日期:2015-10-07)
中图分类号:R737.31
文献标志码:A
文章编号:1002-266X(2016)07-0029-03
doi:10.3969/j.issn.1002-266X.2016.07.010
通信作者:胡明英(E-mail: humying001@sina.com)

