腺病毒Smad 7转染对阿霉素肾病大鼠蛋白尿的影响
冯笑琪,林娜娜,谢燕媚,纪泽泉(广州医科大学附属第二医院,广东广州510260)
腺病毒Smad 7转染对阿霉素肾病大鼠蛋白尿的影响
冯笑琪,林娜娜,谢燕媚,纪泽泉
(广州医科大学附属第二医院,广东广州510260)
摘要:目的在阿霉素(ADR)肾病大鼠模型中,探讨过表达Smad 7对肾病蛋白尿及其病理的影响。方法本实验用单次尾静脉注射建立阿霉素肾病模型,通过构建重组腺病毒介导外源性Smad 7基因,单侧肾动脉灌注转染Smad 7至靶肾脏。用荧光显微镜检测Smad 7重组腺病毒的转染效果,用邻苯三酚红比色法测定大鼠24 h尿蛋白,HE染色检测各组肾脏病理改变。结果①用6.5 mg/kg ADR一次性尾静脉注射SD大鼠可成功构建肾病模型;4周末似微小病变型肾病。②单侧肾动脉灌注能有效将介导Smad 7的重组腺病毒转染至大鼠靶肾脏。③4周末肾病重组腺病毒(Ad-Smad7)组尿蛋白(38.4±6.0)较ADR组(69.58±10.63)减少(P<0.05)。④荧光显微镜显示肾病Ad-smad7组大鼠靶肾中,Ad-Smad7主要在肾小管表达,肾小球表达少。⑤肾病Ad-Smad7组肾脏病理改变轻微,肾病Ad-GFP组、ADR组病理较严重,出现类似局灶节段性肾小球硬化的慢性肾脏病病理表现。结论单侧肾动脉灌注有效地使重组腺病毒介导的Smad 7转染至大鼠靶肾脏,使Smad 7在该肾过表达,可减轻肾病大鼠蛋白尿,并改善阿霉素肾病病理。
关键词:重组腺病毒;Smad 7;肾病;蛋白尿
肾纤维化包括肾小球硬化和肾小管间质纤维化,是各种慢性肾脏病的共同病理过程。TGF-β/Smads信号通路是目前公认的主要通路之一,其下游的Smad 7起负反馈调节作用。在动物实验中,应用通用的大鼠模型,大鼠阿霉素肾病各阶段病理与人的微小病变型肾病、局灶节段性肾小球硬化相似[1],有助于进一步研究TGF-β/Smads通路的机制。肾小球上皮细胞及肾小管细胞对蛋白有选择性滤过作用,所以阿霉素肾病的蛋白尿不仅反映肾病病程发展,也提示其病理情况。前期细胞实验表明,系膜细胞中过表达Smad 7可抑制AngII诱导的系膜细胞增殖及炎症反应[2]。本实验用大鼠阿霉素肾病模型,构建重组腺病毒(adenovirus)介导外源性Smad 7基因,通过从腹主动脉向单侧肾动脉灌注,阻断远心端、近心端血流,肾动脉灌注将外源性Smad 7转染至靶肾脏[3],验证靶肾过表达Smad 7对抑制大鼠蛋白尿,改善肾病病理变化的影响。
1 材料与方法
1.1实验动物与材料
采用Spragoe-Dawleg(SD)系雄性大鼠,SPF级,购买于广东省医学实验动物中心。动物实验在广州医科大学实验动物中心进行,注册编号为SYXK(粤)2010-0104。盐酸阿霉素(adriamycin,ADR),为深圳万乐药业有限公司产品,批号H44024359。重组腺病毒(Ad-Smad7、Ad-GFP)购买于汉恒生物科技有限公司。大鼠手术器械一套、10%水合氯醛、40单位胰岛素针(美国BD公司)等。
1.2模型的建立及分组
随机取40只大鼠,体重150~180 g。ADR肾病模型一次性尾静脉注射ADR 6.5 mg/kg,注射后1、4 及10周末检测24 h尿蛋白,模型组尿蛋白与正常对照组之间差异有统计学意义,出现病理学改变证明模型构建成功。实验分正常对照组(Con组)、ADR肾病组(ADR组)、ADR肾病+Ad-Smad7组(肾病Ad-Smad7组)、肾病+Ad-GFP组(肾病Ad-GFP组)和ADR肾病+假手术组(肾病sham 组),每组8只。ADR注射1周末,肾病Ad-Smad7组通过夹闭腹主动脉近心端、远心端,由腹主动脉向单侧肾动脉灌注Ad-Smad7;同法建立肾病Ad-GFP组;肾病sham组开腹后相同时间内单纯夹闭腹主动脉;Con组尾静脉注射等容积的生理盐水。
1.3观察指标及检测方法
1.3.1肾病模型的尿生化检测ADR注射后1、4 及10周末用代谢笼分别收集24 h尿液,记录24 h尿量,3 000 r/min离心5 min后暂存于4℃冰箱,用邻苯三酚红比色法检测24 h尿蛋白。
1.3.2构建肾病Ad-Smad7组、肾病Ad-GFP组及肾病sham组在ADR注射1周末,每组随机选取8只模型鼠,术前1天禁食不禁饮。按4 ml/kg水合氯醛麻醉,作倒T字开口,逐层开腹,找左肾部位,分离左肾静脉,显露术野后,找到下腔静脉与腹主动脉,分别游离出下腔静脉和腹主动脉。细丝线分别游离腹主动脉近心、远心端。备好重组腺病毒,胰岛素针。分别用动脉夹夹闭游离好的腹主动脉近心端及远心端,将5×109pfu/ml重组腺病毒(Ad-Smad7/Ad-GFP)均速地从腹主动脉灌注入左肾动脉,灌注完立即退针,按压约5min。按压同时稍提起左肾静脉丝线,短暂阻断左肾血流,延长腺病毒与该肾的接触时间。阻断血流注射病毒总时间控制在10 min以内。确认清理干净后关腹,肌肉层连续缝合,皮肤间断缝合。连续肌注10万u青霉素3 d,放回笼里保暖。
1.3.3肾脏标本采集Con组和ADR组分别于ADR注射后4周末及10周末取肾,肾病Ad-Smad7组、肾病Ad-GFP组、肾病sham组于4周末取肾。切取肾脏后剥离肾包膜,部分肾组织置于4%多聚甲醛做冷冻切片荧光检测,部分肾皮质置于10%甲醛做病理检查,HE染色;其余肾组织置于液氮保存。
1.3.4冷冻切片荧光显微镜检测Ad-Smad7 4%多聚甲醛固定的肾组织过夜,蔗糖溶液脱水,直至肾组织沉降到容器底部。预冷冷冻切片机,温度调至-22℃,切片厚度为45μm。按需要切取适量肾组织,加PBS泡于6孔板中。病理级玻片预先过明胶,以防脱片。每张玻片用抗荧光淬灭封片剂封片,荧光显微镜观察拍照。
1.3.5HE染色切片在二甲苯中脱蜡;依次放入100%、95%、85%、70%酒精,各级为2~5 min。最后经蒸馏水转入染液;苏木精染液染色10 min;水洗玻片上多余染液,0.5%~1.0%盐酸酒精(70%酒精配制)分色片刻。镜检控制,直至细胞核及核内染色质清晰为止;流水冲洗,或在碳酸锂饱和液中短时间碱化,蒸馏水短洗;0.1%~0.5%伊红染液染色1~5 min;依次经70%、85%、95%、100%酒精脱水;二甲苯透明(2次),共约10 min;迅速滴加适量中性树胶,加盖玻片封固。
1.4统计学方法
采用SPSS 17.0统计软件进行数据分析。计量资料用均数±标准差(±s)表示,组间两两比较采用LSD法检验,P<0.05为差异有统计学意义。
2 结果
2.1阿霉素肾病模型24 h尿蛋白检测
分别取Con组、ADR组1周末、4周末、10周末24 h尿,ADR组1周末24 h尿蛋白升高,4周末升至较高水平,与同时间点Con组比较显著升高,模型构建成功;4周末ADR组与1周末ADR组比较显著升高。10周末稍降低,但仍较同时间点Con组高。Con组各时间点尿蛋白差异无统计学意义,见图1。
2.2正常对照组与模型组病理检测
Con组肾小球内皮、毛细血管清晰,血管球与肾球囊无黏连(见图2A);ADR组肾小球系膜基质增多,毛细血管腔狭窄或破坏,毛细血管丛与囊壁黏连(见图2B)。
2.34周末各组大鼠尿蛋白比较
ADR注射4周末,与Con组比较,ADR组24 h尿蛋白显著升高。与ADR组比较,Ad-Smad7转染后大鼠24 h尿蛋白减少,差异有统计学意义;与肾病Ad-GFP组、肾病sham组比较,肾病Ad-Smad7组大鼠24 h尿蛋白也减少,差异有统计学意义。ADR组、肾病Ad-GFP组、肾病sham 3组尿蛋白比较差异无统计学意义。见图3。
2.4各组肾组织冷冻切片荧光镜检
肾病Ad-GFP组的荧光镜检可见肾小管上皮细胞有绿色荧光,表明腺病毒已转染至小管上皮细胞。与Con组、ADR组比较,Ad-Smad7在5×109pfu/ml时转染效果明显,而肾病sham组与ADR组相似,仅有轻微均匀的自发荧光。见图4。
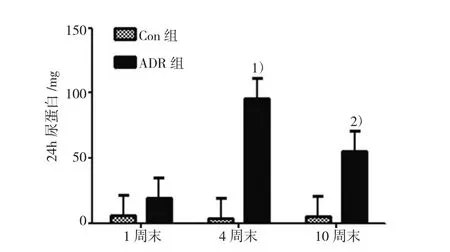
图1 Con组、ADR组各时间点24 h尿蛋白
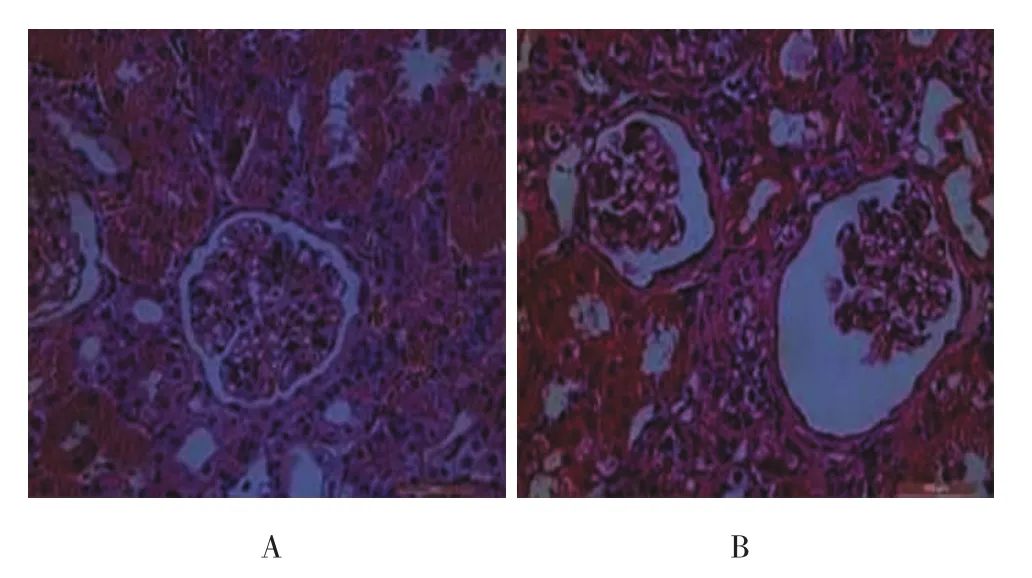
图2 Con组、ADR组4周HE染色病理图(×400)
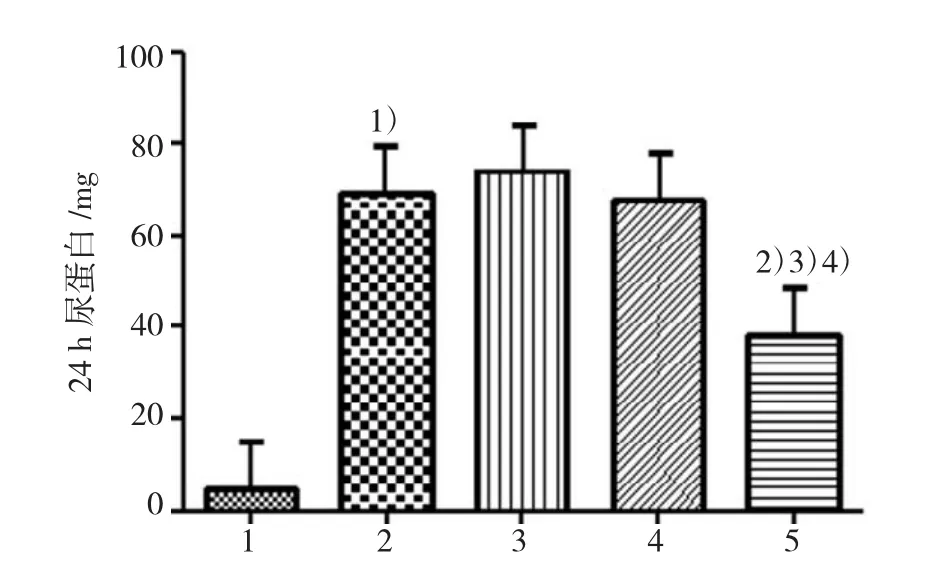
图3 4周末各组大鼠24 h尿蛋白比较

图4 肾脏冷冻切片荧光镜检Ad-Smad7(×400)
2.5各组大鼠肾脏病理改变
Con组见肾小球系膜细胞、毛细血管清晰,血管球与肾球囊无黏连;与Con组比较,ADR组肾小球系膜基质增多,毛细血管腔狭窄或破坏,毛细血管丛与囊壁黏连,部分肾小球有新月体形成;肾病Ad-GFP组肾小球球囊变形,毛细血管球萎缩,部分血管腔闭塞,肾小管上皮细胞肿胀,排列紊乱,部分脱失;肾病sham组肾小球毛细血管成分叶状,系膜细胞增殖,与ADR组相似;肾病Ad-Smad7组血管球和肾球囊结构分明,内皮细胞、系膜细胞均匀分布,较ADR组病理改变减轻。见图5。
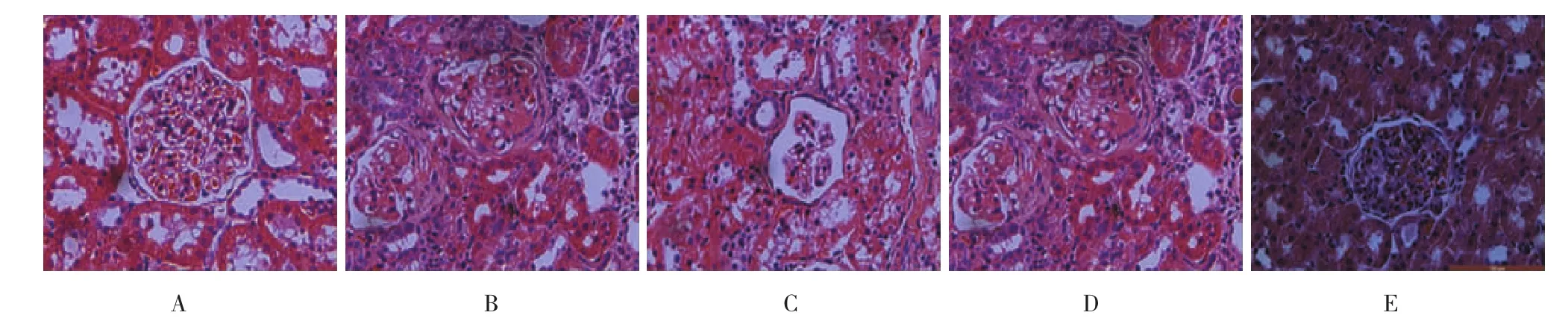
图5 各组肾脏病理HE染色(×400)
3 讨论
肾组织纤维化和炎症是慢性肾脏病病理过程,可发展为肾小球硬化。各种致病因素长期持续刺激肾小球,使内皮细胞受损,血管塌陷,系膜细胞增殖,细胞外基质(ECM)堆积,导致肾小球硬化。多条信号通路参与肾小球硬化过程,包括TGF-β/Smad信号通路,MAPK通路,Wnt通路等。其中Smad2、3、4、7 为TGF-β1的下游效应蛋白,Smad7为负反馈调节蛋白。有研究显示细胞内Smad7的水平是决定TGF-β1反应性的主要因素,它通过干扰TβRⅠ型受体对Smad2、Smad3蛋白的磷酸化,或招募E3泛素连接酶(如Smurf1/2)导致活化的TβRⅠ型受体泛素化标记,对TGF-β1/Smad通路起负反馈调节作用[4-5]。
本研究前期在AngII刺激肾小球系膜细胞(glomerular mesangial cell,GMC)增殖的研究表明,Smad 7通过抑制活性氧(reactive oxygen species,ROS)的产生,抑制AngII对NF-κB的激活,增加IκBα的蛋白表达并使核内表达增多,促进GMC凋亡,缓解其增殖。梗阻性肾病大鼠及细胞实验均发现,过表达Smad 7后miR29b重新表达,Smad 7能抑制糖化终产物和AngII引起的microRNAs的表达,阻断肾硬化的发展[6]。Chung等[7]的研究表明,过表达Smad 7可抑制糖化终产物诱导的Smad 3磷酸化,提示过表达Smad 7可作为糖尿病肾病治疗的靶点。本实验通过腺病毒介导Smad 7基因转染肾病大鼠,观察Smad 7干预后对模型大鼠蛋白尿及肾病病理的影响。
阿霉素作为一种蒽环类抗肿瘤抗生素,具有强烈的细胞毒作用,直接损伤肾脏细胞。它的醌式结构,在肾内代谢还原成半醌式自由基,后者与氧结合产生ROS,促使肾小管上皮细胞脂质过氧化,滤过膜结构、功能受损,产生蛋白尿。此外阿霉素还有心脏毒性、胃肠道反应等副作用,剂量过大会造成动物死亡,存活率降低[8-9]。因此,经过预实验,本研究采用一次性尾静脉注射6.5 mg/kg ADR的给药方式,减少药物血管外渗的机会,也减轻胃肠道反应。24 h蛋白尿检测结果显示,ADR组大鼠于阿霉素注射1周末即出现蛋白尿。研究显示基因表达在大鼠肾脏可持续约3周[10],所以本实验从ADR注射1周末开始转染Smad 7重组腺病毒,4周末检测转染效果。
腺病毒介导外源性基因转染至大鼠肾脏定向表达的研究表明,腺病毒的感染效率高,用包装细胞进行扩增,一次包装所得的滴度较高(纯化后为1011pfu/ml),纯化后的腺病毒可直接进行动物活体注射[11],因此,本实验用腺病毒为载体介导Smad 7基因对阿霉素肾病大鼠进行干预。关于腺病毒活体注射的研究显示,不同的注射方式感染率有明显差异。单纯静脉注射通过血循环可使腺病毒经过肾脏,但病毒会同时感染多个器官,到达肾脏的腺病毒减少。为了使病毒感染大鼠并具有肾脏靶向性,实验人员通过直接将重组腺病毒由腹主动脉向左侧肾动脉灌注,暂时阻断腹主动脉远心端、近心端血流(近心端至右肾动脉下方,远心端至左肾动脉下方),在两者间进针即可使腺病毒灌注至左肾,并适当延长灌注时间[3,12]。
各组大鼠肾脏冰冻切片的荧光显微镜检结果显示,Con组、ADR组仅有轻微均匀的自发荧光,与前两者比较,肾病Ad-Smad7和肾病Ad-GFP均见阳性表达区,Ad-Smad7组位于肾小管上皮细胞及小管间质,Ad-GFP主要位于肾小管上皮细胞。实验表明5×109pfu/ml时转染效果最明显,且不引起大鼠过早死亡。肾病sham组与ADR组相似,仅有轻微均一的自发荧光。由此可见介导Smad 7的腺病毒已成功转染至大鼠靶肾脏。
腺病毒介导基因转染至大鼠的研究显示,基因表达在大鼠肾脏内可持续约3周。灌注重组腺病毒Smad7后,即实验4周末,肾病Ad-Smad7组24 h尿蛋白与ADR组、肾病Ad-GFP组、肾病sham组比较明显减少,提示过表达Smad 7基因可抑制肾病蛋白尿。Liu等[13]研究表明,小鼠高血压肾病模型通过非侵入的超声微泡技术,强力霉素诱导Smad 7表达的质粒注入到肾脏后显示,Smad 7提前干预能防止AngII引起的进行性肾损伤,抑制蛋白尿和血肌酐的增高。Wang[14]等研究显示通过下调Smad7蛋白,过表达的miR21能促进糖尿病肾病中TGF-β1诱导的肾硬化。有肾病模型研究发现小管间质损伤和肾小球病变一样决定着慢性肾脏病的进展,但其机制仍未十分清楚,如肾大部分切除模型、Heymann肾炎,他们实验表明持续的蛋白尿与肾小管损伤密切相关[15]。而本实验中Smad 7也正是在肾小管上皮细胞表达,可能Smad 7通过小管上皮细胞抑制TGF-β/Smad通路,从而抑制阿霉素肾病的进展,减轻肾病蛋白尿。
实验检测各组肾病大鼠肾脏病理改变,Con组见肾小球系膜细胞、毛细血管清晰,血管球与肾球囊无黏连;与Con组比较,ADR组肾小球系膜基质增多,毛细血管腔狭窄或破坏,毛细血管丛与囊壁黏连,个别肾小球有新月体形成;肾病Ad-GFP组与ADR组相似,毛细血管球萎缩,肾小管上皮细胞肿胀,排列紊乱,球囊黏连;肾病sham组肾小球毛细血管成分叶状,系膜细胞增殖;肾病Ad-Smad7组血管球和肾球囊结构较分明,内皮细胞、系膜细胞分布较均匀,与ADR组比较有明显减轻。可见,过表达Smad 7可缓解阿霉素肾病病理损害。
本实验显示Smad 7重组腺病毒通过腹主动脉定向灌注大鼠肾脏,使Smad 7在靶肾过表达,可减轻阿霉素肾病大鼠蛋白尿及改善肾脏病理情况,表明Smad 7可作为干预靶点,为肾硬化的防治提供新的实验依据。
参考文献:
[1]张伟,王莉,何轶,等.幼年大鼠阿霉素肾病模型的复制[J].中国中西医结合杂志,2012,13(12):1068-1071.
[2]林娜娜,冯笑琪,李敏,等.过表达Smad7对AngII诱导的GMC增殖的影响[J].实用医学杂志,2015,31(13):2119-2122.
[3] Ghayur A,Liu L,Kolb M,et al.Adenovirus-mediated gene transfer of TGF-β1 to the renal glomeruli leads to proteinuria[J].The American Journal of Pathology,2012,180(3):940-951.
[4] Liu Z,Huang X,Chen H,et al.Loss of angiotensin-converting enzyme 2 enhances TGF-β/Smad-mediated renal fibrosis and NF-kB-driven renal inflammation in a mouse model of obstructive nephropathy[J].Laboratory Investigation,2012,92(5):650-661.
[5] Liu GX,Li YQ,Huang XR,et al.Disruption of Smad7 promotes ANG II-mediated renal inflammation and fibrosis via Sp1-TGF-beta/S mad3-NF.kappaB-dependent mechanisms in mice[J].PLoS One,2013,8(1):e53573.
[6] Chung CK,Yuan D,Yang W,et al.Smad7 suppresses renal fibrosis via altering expression of TGF-beta/Smad3-regulated microRNAs[J].The American Society of Gene & Cell Therapy,2013.21(2):388-398.
[7] Chung CK,Zhang H,Kong Y.Advanced glycation end-products induce tubular CTGF via TGF-beta-independent Smad3 signaling[J].Journal of the American Society of Nephrology,2010,21 (2):249-260.
[8]杜宇,魏红,李海涛.阿霉素大鼠肾病模型的概述[J].中国医药指南,2013,11(9):78-79.
[9]张勇,张蓓,宁华英,等.单次尾静脉注射法阿霉素大鼠肾病模型的建立[J].中国实验动物学报,2013,21(1):104-107.
[10] Corridon PR,Rhodes GJ,Leonard EC,et al.A method to facilitate and monitor expression of exogenous genes in the rat kidney using plasmid and viral vectors[J].American Journal of Physiology-Renal Physiology,2013,304(9):F1217-1229.
[11] Guadalupe OM,Be觡at M,Oscar L,et al.Renal delivery of adenovirus and antisense oligonucleotides in rats by retrograde renal vein injection[J].Methods in Molecular Biology,2012(886):321-329.
[12] Tang WX,Wu WH,ZENG XX,et al.Early protective effect of mitofusion 2 overexpression in STZ-induced diabetic rat kidney[J].Endocrine,2012,41(2):236-247.
[13] Liu GX,Li YQ,Huang XR,et al.Smad7 inhibits AngII-mediated hypertensive nephropathy in a mouse model of hypertension[J].Clinical Science,2014,127(3):195-208.
[14] Wang JY,Gao YB,Zhang N,et al.MiR-21 overexpression enhances TGF-β1-induced epithelial-to-mesenchymal transition by target smad7 and aggravates renal damage in diabetic nephropathy[J].Moleculat and Cellular Endocrinology,2014,1-2 (392):163-172.
[15]刘俊,陈香美.蛋白尿加速肾小管损伤的作用机制[J].中华肾病研究电子杂志,2014,3(2):99-103.
(张蕾编辑)
Effect of adenovirus-mediated Smad7 gene transfer on proteinuria of Adriamycin-induced nephropathy rat model
Xiao-qi Feng,Na-na Lin,Yan-mei Xie,Ze-quan Ji
(The Second Affiliated Hospital,Guangzhou Medical University,Guangzhou,Guangdong 510260,China)
Abstract:Ojective To investigate the effect of overexpression of Smad7 on proteinuria and renal pathology in the Adriamycin-induced nephropathy (ADN) rat model.Methods ADN model was established by single tail intravenous injection of Adriamycin (ADR).Smad7 gene was transferred by means of infusing a recombinant adenovirus into the left renal artery.Recombinant adenovirus-Smad7 (Ad-Smad7) was detected under fluorescence microscope.HE staining was used to examine renal pathological changes of each group.Pyrogallol red colorimetry was used to detect 24-h urinary protein.Results SD rats received a single intravenous injection of ADR (6.5 mg/kg),which constructed the ADN model.The pathology was similar to minimal change nephropathy at the fourth weekend.Unilateral renal artery infusion was efficient to transfer Ad-Smad7 to the target kidney.Urinary protein of the Ad-Smad7 group (38.4± 6.0) decreased compared to the ADR group (69.58±10.63) at the fourth weekend (P < 0.05).Smad7 was mainly expressed in renal tubular epithelia in the Ad-Smad7 group,scarcely seen in glomeruli.The pathological changes of the Ad-Smad7 group were mild,while the changes of the Ad-GFP and ADR groups were similar to focal segmental glomerulosclerosis.Conclusions Ad-Smad7 can be transferred to the target kidney through unilateral renal artery infusion,and overexpression of Smad7 can ameliorate proteinuria and pathological changes of Adriamycin-induced nephropathy.
Keywords:recombinant adenovirus; Smad7; nephropathy; proteinuria
收稿日期:2015-10-28
文章编号:1005-8982(2016)06-0001-05
DOI:10.3969/j.issn.1005-8982.2016.06.001
中图分类号:R725.7
文献标识码:A

