I型钠氢交换蛋白调节细胞内酸碱平衡对胃癌细胞迁移、侵袭的影响*
谢睿,王海波,牟海军,徐靖宇
(遵义医学院附属医院消化内科,贵州遵义563099)
I型钠氢交换蛋白调节细胞内酸碱平衡对胃癌细胞迁移、侵袭的影响*
谢睿,王海波,牟海军,徐靖宇
(遵义医学院附属医院消化内科,贵州遵义563099)
摘要:目的观察I型钠氢交换蛋白(NHE1)通过调控胃癌细胞SGC-7901内酸碱值(pH)对其迁移、侵袭的影响。方法采用共聚焦显微镜观察比较用特异性阻断剂5-(N-乙基-N-异丙基)阿米洛利(EIPA)阻断胃癌细胞SGC-7901的NHE1功能前后胞内pH值的变化,划痕实验观察细胞迁移能力的改变,transwell侵袭实验观察细胞侵袭能力的改变。结果共聚焦实验发现对照组细胞内pHi为(7.2±0.12),EIPA阻断剂组(5μm)为(7.01±0.23),EIPA阻断剂组细胞内的pH值明显降低(P<0.05);进一步划痕和侵袭实验证明加入不同浓度的EIPA(5、10和20μmol)后均能有效地抑制胃癌细胞SGC-7901的迁移和侵袭能力(P<0.05,P< 0.01),并且抑制的程度与EIPA的浓度呈剂量依赖性。结论阻断NHE1可以降低胃癌细胞pH值,进而抑制胃癌细胞的迁移和侵袭能力。
关键词:NHE1;胃癌;细胞迁移;pH;细胞侵袭
胃癌是世界上最为常见的恶性肿瘤之一,其死亡率位居癌症死因第2位,我国属于胃癌高发大国[1]。随着近代医疗技术的发展,胃癌的预后虽已有改善,但5年生存率依然没有明显提高,究其原因与胃癌高转移率、高复发率的特性密切相关。既往研究已证实,肿瘤酸性微环境(即外酸内碱)参与了肿瘤的生存迁移等异常细胞生物学行为的调控过程[2-3],失调的细胞内、外酸碱值(potential of hydrogen,pH)是促使肿瘤发生、发展的一个重要诱因,因此,近年来研究者们开始重视pH调控及其相关靶分子在肿瘤领域中的重要作用。钠氢交换蛋白家族(Na+/H-exchangers,NHE)中的I型钠氢交换蛋白(NHE1),是存在于哺乳动物细胞上调节细胞内外正常pH值的重要膜蛋白,其通过细胞内的一个H+与细胞外的一个Na+离子进行电中性跨膜转运达到调控PH的作用[4],虽然已有文献报道NHE1可能参与了乳腺癌、前列腺癌等肿瘤的发生发展[5-6],但就NHE1与消化系统肿瘤特别是胃癌的相关性,目前主要集中在对其表达量变化(蛋白或转录水平)的研究,而对于通过调控NHE的蛋白活性(即功能)来揭示对胃癌细胞异常生物学行为影响的相关研究却鲜见报道。鉴于NHE1亚型广泛存在于多种组织细胞中,同时,本次前期研究已发现NHE1在胃癌具有蛋白表达量的变化,本实验拟通过应用NHE1特异性阻断剂5-(N-乙基-N-异丙基)阿米洛利[5-(N-ethyl-N-isopropyl)amiloride(EIPA)]作用于胃癌细胞后,观察其胃癌细胞内pH(intracellular pH,pHi)的变化,以及该变化对胃癌细胞迁移、侵袭行为的影响,旨在从NHE1功能调控角度,为以NHE1为靶点治疗胃癌提供依据。
1 材料与方法
1.1材料
胃癌SGC-7901细胞株购于中科院上海细胞库,实验用BCECF/AM、Nigericin购于Intergone公司,EIPA(美国Sigma公司),1640培养基、小牛血清、胰酶购于美国GIBCO公司,二氧化碳CO2培养箱(型号3131,美国Thermo公司),倒置相差显微镜和激光扫描共聚焦显微镜均购于德国Leica公司。
1.2方法
1.2.1细胞培养SGC-7901细胞置于含有10%胎牛血清、100 u/L青霉素、100μg/L链霉素的RPMI 1640培养基,5%的二氧化碳CO2、37℃培养箱中培养。每2~3 d用含0.02% EDTA的0.25%胰蛋白酶溶液消化并传代。
1.2.2细胞内pH测定预先将特殊的Glass Coverslip载玻片酒精浸泡并在紫外灯下照射15 min后置于6孔板内接种细胞并培养48 h,实验时用PSS液漂洗3次后,加入终浓度为5μmol/L的BCECF/AM(pH荧光探针),室温避光孵育30 min,孵育结束,将BCECF-AM负载好的SGC-7901细胞转移到一个特制的灌注室中,再用PSS液漂洗10 min,激光共聚焦显微镜下观察,记录细胞内荧光值的变化,数据采集间隔时间为30 s,扫描时间为20 min。比较EIPA(5μmol)处理前后胃癌细胞SGC-7901细胞内pH值的变化。用含有尼日利亚菌素(Nigericin)的高钾溶液催化细胞外K+和胞内H+的跨膜交换,最终使得细胞内外pH值相等,即通过高钾溶液的pH值即换算出肿瘤细胞的pHi。
1.2.3细胞划痕实验取对数生长期SGC-7901细胞,常规消化细胞后计数,用无血清培养基1640稀释细胞使其密度为2×105/ml,接种于48孔板内,每孔500μl细胞悬液,放入37℃、5%二氧化碳CO2恒温培养箱中培养24 h,待细胞贴壁并单层平铺长满整个孔底部。划痕给药处理:取出48孔板,先用PBS清洗1次,用10μl枪头稍微过火,呈“一”划痕,再用PBS洗3次,彻底洗净漂浮起来的细胞,用无血清的培养基配制不同浓度的EIPA刺激液加入孔板中,实验分组:正常对照组(加入500μl无血清培养基)、EIPA不同浓度处理组(5、10和20μmol/L),每孔均加入总体积500μl的刺激液,继续培养24 h,每组设3个复孔,找出给药前拍照的原位置进行拍照,实验结果用Image-plus软件测量,药物刺激前后划痕两侧细胞间距离的变化,每张图片测量5个距离点,细胞迁移距离=药物刺激前两边细胞的距离-药物刺激后两边细胞的距离。每孔取5个视野拍照,每次实验至少重复3次。
1.2.4细胞侵袭实验将人工基底膜(Matrigel)(40μl/孔)均匀地铺在Transwell小室膜上,37℃放置6 h,待吸尽基质胶表面液体,下室加600μl 1640培养基,含30%胎牛血清,上室分别加入不同浓度EIPA处理液重悬的细胞悬液(细胞密度为5×105个/ml细胞)400μl/室,无血清1640培养基培养。将小室置于12空板中于37℃培养箱孵育24 h。后用1% PBS漂洗3次;用4%甲醛溶液固定30 min,苏木精染色,梯度乙醇溶液逐级脱水,邻苯二甲醛透明后,置于载玻片上封固。在光学显微镜下随机挑选5个视野(×200)下的穿膜细胞数,计算平均细胞侵袭数量,以穿过滤膜的细胞数表示细胞的侵袭力,实验分为正常对照组(加入600μl无血清培养基)、EIPA不同浓度处理组(5、10和20μmol/L),每次实验至少重复3次。
1.3统计学方法
应用SPSS11.0软件对数据进行统计学分析,数据以均数±标准差(±s)表示,用t检验做差异的显著性分析,P<0.05为差异有统计学意义。
2 结果
2.1EIPA抑制NHE1功能对胞内pH的影响
首先测量静息状态对照组胃癌细胞SGC-7901 的pHi值,结果显示对照组胃癌细胞pHi为(7.20± 0.12),而加入NHE1特异性抑制剂EIPA(5μmol)阻断NHE1的功能后,pHi变为(7.01±0.23),相对于对照组pHi值显著降低(P<0.05,见图1)。表明胃癌细胞的NHE1具有调控细胞内pH的功能,并且通过EIPA抑制NHE1活性后会导致SGC-7901细胞内的pH值明显降低,细胞明显酸化,胞外微环境偏碱。
2.2EIPA抑制NHE1功能对胃癌细胞迁移能力的影响
与对照组迁移的距离(45.0±2.4)μm比较,加入不同浓度(5、10和20μmol)的阻断剂EIPA作用24 h后能够明显抑制胃癌细胞SGC-7901的迁移能力[5μmol组:(38.0±4.5)μm;10μmol组:(30.0± 4.3)μm;20μmol组:(26.0±2.6)μm],并且SGC-7901细胞迁移能力的抑制程度与EIPA的浓度呈剂量依赖性,结果见图2、附表。
2.3EIPA抑制NHE1功能对胃癌细胞侵袭的能力影响
与对照组侵袭的细胞数量(100.75±9.42)个比较,加入不同浓度(5、10和20μmol)的阻断剂EIPA 24 h作用后能够明显抑制胃癌细胞SGC-7901的侵袭能力(P <0.05)[5μmol组:(75.75±7.87)个;10μmol组:(46.5±4.35)个;20μmol组:(34.5±6.60)个],并且SGC-7901细胞侵袭能力的抑制程度与EIPA的浓度呈剂量依赖性。结果见图3、图4。
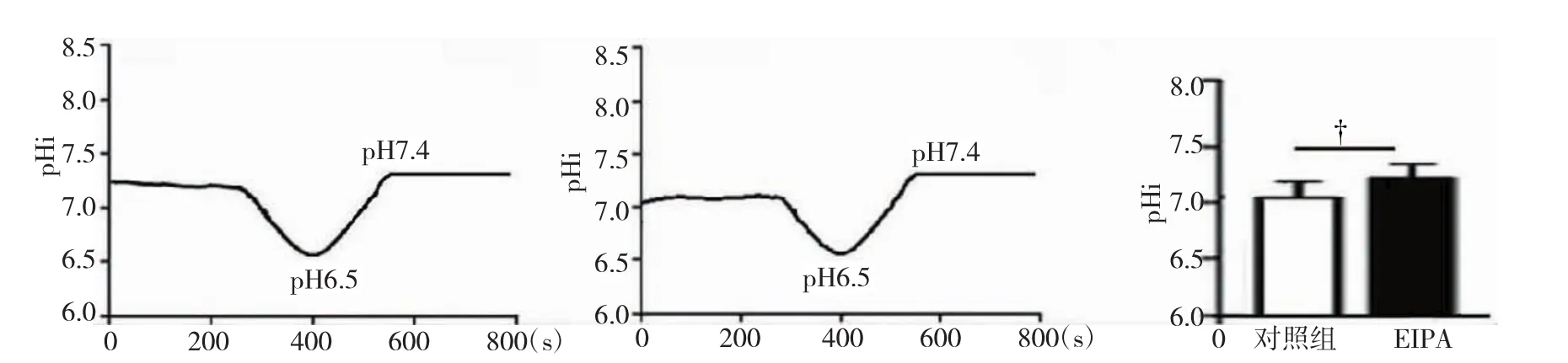
图1 对照组及EIPA组胃癌细胞的pHi曲线及统计图

图2 对照组及不同浓度的EIPA刺激24h后胃癌细胞的迁移距离
附表 对照组及不同浓度的EIPA刺激后胃癌细胞迁移距离统计表(n=4,μm,±s)

附表 对照组及不同浓度的EIPA刺激后胃癌细胞迁移距离统计表(n=4,μm,±s)
注:与对照组比较,1)P<0.05;2)P<0.01
分组 对照组 5μmol组 10μmol组 20μmol组迁移距离 45.0±2.4 38.0±4.51) 30.0±4.32) 26.0±2.62)
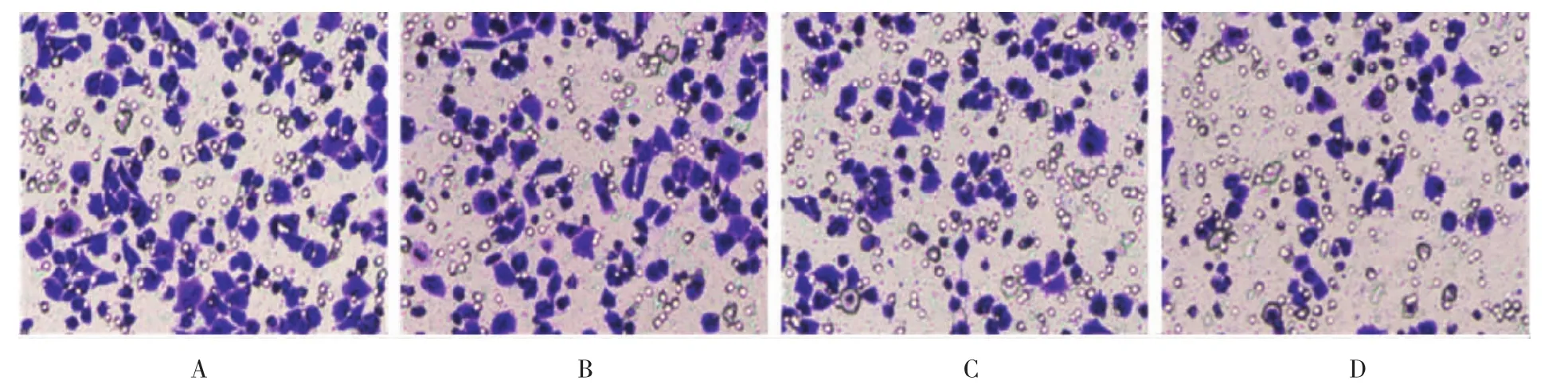
图3 不同浓度的EIPA刺激对胃癌细胞侵袭能力的影响
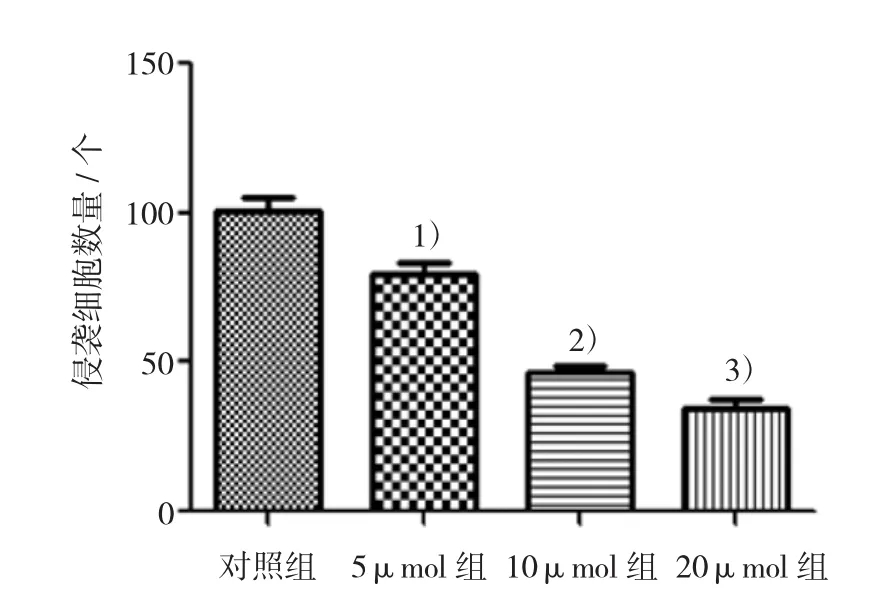
图4 对照组及不同浓度的EIPA刺激后胃癌细胞侵袭细胞数统计图
3 讨论
多年来研究者们一直致力于胃癌发生发展的机制研究,以期为根治胃癌及改善胃癌预后寻找到新的治疗途径。但是胃癌的发生、发展是多基因、多步骤的过程,常规的化疗、放疗、免疫方法只能杀死原位的肿瘤细胞,却无法完全控制肿瘤细胞的侵袭转移过程,而肿瘤细胞的侵袭转移往往又是肿瘤复发的根本原因,因此,针对肿瘤细胞侵袭转移的相关机制研究刻不容缓。近年来的研究表明,肿瘤发生、转移和侵润均涉及复杂的细胞行为变化,而这些变化与细胞自身所处的肿瘤微环境特别是微环境的酸碱度密切相关。
既往研究发现癌细胞胞内碱性环境会促进细胞更加频繁的新陈代谢,而外部酸性环境却能增强肿瘤细胞迁移、侵润转移能力。究其原因一方面肿瘤细胞侵袭、转移在很大程度上主要依赖于一系列蛋白酶,如金属蛋白酶、巯基蛋白酶、丝氨酸蛋白酶及酸性蛋白酶等,他们可以去降解一系列组织屏障,在酸性环境下这些酶的活性可被增强,从而为癌细胞的侵袭创造条件[7-8]。另一方面,肿瘤细胞的迁移和侵袭主要的驱动力是板状伪足,而板状伪足主要是由肌动蛋白构成,它能够突入细胞外基质,进而组装成微丝网格,构成细胞骨架形成的驱动力。但在前述过程中,cofilin肌动蛋白和凝溶胶gelsolin蛋白的参与都是微丝组装和解离过程中的关键物质,而这两种蛋白在细胞迁移中均对pH敏感,cofilin在碱性pH中的活性高于酸性,而高浓度的质子可以激活gelsolin[9]。由此可见细胞内外的pH变化的确是调控细胞侵袭、迁移能力的重要因素,所以肿瘤酸性微环境(即外酸内碱)更有利于肿瘤细胞的侵袭、迁移。那么pH的平衡的调控机制是什么呢?进一步的研究表明胞外酸环境的形成主要依赖于胞内过量氢离子的外排行为,而NHE家族中的NHE1亚型作为胞膜上重要的氢离子交换器已被证实在细胞内外pH的调控机制中扮演重要角色。
自1989年首次克隆出人类NHE1cDNA以来[10],到目前已知NHE基因家族中有9个亚型,它们具有相似的拓扑结构,NHE1是NHE家族中表达最为广泛的亚型,几乎所有的组织质膜上均有表达,被认为是一个“管家基因”。人类NHE1包含12个外显子和11个内含子,整个cDNA全长5Kb。既往的报道证实NHE1是调控细胞外酸碱微环境的重要因子,其通过调控细胞内的一个H+与细胞外的一个Na+离子进行电中性跨膜转运来影响细胞内外的pH平衡。在NHE1与疾病相关性的研究中,已发现NHE1抑制剂处理后的人类白血病细胞,其细胞内pH明显降低,进而诱导肿瘤细胞发生凋亡[11]。同时,Lagana 等[12]发现用MSV转化犬肾上皮连续细胞系,采用乙基异丙基氯毗咪处理后,细胞中NHE1的活性被明显抑制,导致细胞内肌动蛋白应力纤维解聚合细胞骨架肌动阮重新分布,细胞伪足缩会,细胞运动被抑制。由此可见NHE1的确具有影响细胞迁移、侵袭的能力,近年来的研究还证实NHE1与前列腺癌、乳腺癌、大肠癌等肿瘤的进展、转移均有着密切的关系[5-6]。那么,在胃癌细胞中NHE1是否也能影响细胞pH,进而影响胃癌细胞的生物学行为呢?本实验结果发现对照组胃癌细胞SGC-7901胞内的pHi为7.20,采用NHE1特异性的阻断剂EIPA阻断NHE1的功能后,细胞内pH下降到7.01(P <0.05),提示NHE1在胃癌细胞的确具有调控细胞内pH的功能,阻断了NHE1后的活性后细胞内的H+会因为无法外泵而导致胞内pH降低,形成一种外碱内酸,不利于癌细胞迁移、侵袭的微环境。本研究想证实细胞内的pH改变是否的确对胃癌细胞的迁移、侵袭能力具有影响,结果发现经NHE1阻断剂EIPA处理,胃癌细胞SGC-7901细胞的迁移、侵袭能力较对照组(PBS)均明显降低,这表明NHE1受体的确通过调控胃癌细胞内pHi变化影响进而肿瘤细胞的生物学行为,抑制NHE1的活性能够明显抑制胃癌细胞的侵袭、转移能力。本实验发现,至少在细胞水平,胃癌细胞NHE1很可能是胃癌发生、发展中重要的调控机制,开发一种新的NHE临床抑制剂有可能为许多疾病的治疗提供新思路和新途径。
参考文献:
[1] Siegel R,Naishadham D,Jemal A.Cancer statistics[J].CA Cancer J Clin,2013,63:11-30.
[2] Zhunussova A,Sen B,Friedman L.Tumor microenvironment promotes dicarboxylic acid carrier-mediated transport of succinate to fuel prostate cancer mitochondria[J].Am J Cancer Res,2015,5 (5):1665-1679.
[3] Justus CR,Dong L,Yang LV.Acidic tumor microenvironment and pH-sensing G protein-coupled receptors[J].Front Physiol,2013,4:354.
[4] Reshkin SJ,Cardone RA,Harguindey S.Na+-H+exchanger,pH regulation and cancer[J].Recent Pat Anticancer Drug Discov,2013,8(1):85-99.
[5] Amith SR,Fliegel L.Regulation of the Na+/H+exchanger (NHE1) in breast cancer metastasis[J].Cancer Res,2013,73(4):1259-1264.
[6] Chatterjee S,Schmidt S,Pouli S.Membrane androgen receptor sensitive Na+/H+exchanger activity in prostate cancer cells[J].FEBS Lett,2014,588(9):1571-1579.
[7] Li Y,Tang ZY,Ye SL,et al.Establishment of cell clones with different metastatic potential from the metastatic hepatocellular carcinoma cell line MHCC97[J].World J Gastroenterol,2001,7 (5):630-636.
[8] Venkataraman K,Futerman AH.Do longevity assurance genes containing Hox domains regulate cell development via ceramide synthesis[J].FEBS Lett,2002,528(1-3):3-4.
[9]安彩艳,包良,阿拉坦高勒.胞外酸性与肿瘤的浸润转移[J].中国生物化学与分子生物学报,2013,29(4):926-931.
[10] Spasov AA,Gurova NA,Kharitonova MV.Structure and physiological role of NHE1 and pharmacological regulation of its activity[J].Eksp Klin Farmakol,2013,76(1):43-48.
[11]常城,孔佩艳,陈幸华.NHE-1特异性抑制剂DMA逆转HL-60/ADM细胞多药耐药的实验研究[J].第三军医大学学报,2007,29(4):328-330.
[12] Lagana A,Vadnais J,Le PU,et al.Regulation of the formation of tumor cell pseudopodia by the Na+/H+exchanger NHE1[J].J Cell Sci,2000,113(20):3649-3662.
(张蕾编辑)
Effect of NHE1-regulated intracellular pH on invasion and migration of gastric cancer cells*
Rui Xie,Hai-bo Wang,Hai-jun Mu,Jing-yu Xu
(Department of Gastroenterology,the Affiliated Hospital,Zunyi Medical College,Zunyi,Guizhou 563099,China)
Abstract:objective To observe the effect of Na+/H+exchanger 1 (NHE1)-regulated intracellular pH on the invasion and migration of gastric cancer cell line SGC-7901.Methods The gastric cancer cell line SGC -7901 was treated with the NHE1 specific inhibitor 5-(N-ethyl-N-isopropyl) Amiloride (EIPA),the intracellular pH of SGC-7901 was measured using confocal fluorescence microscope.The migration of SGC-7901 cells was examined by scratch test.The invasion of SGC -7901 cells was examined by transwell chamber invasive test.Results The intracellular pH in the control group was (7.2±0.12),it significantly reduced to (7.01±0.23) in the 5-μmol EIPA group.EIPA of different concentrations (5 μmol,10 μmol and 20 μmol) could inhibit the invasion and migration of SGC-7901 cells in a dose-dependent manner.Conclusions NHE1 plays an important role in the regulation of intracellular pH.Blockage of NHE1 could restrain the invasion and migration of gastric cancer cells.
Keywords:NHE1; gastric cancer; cell migration; pH; cell invasion
[通信作者]徐靖宇,E-mail:xujingyu-gzzy@126.com
*基金项目:贵州省卫生计生委科学技术基金项目(No:gzwjkj2014-2-165)
收稿日期:2015-10-07
文章编号:1005-8982(2016)06-0006-05
DOI:10.3969/j.issn.1005-8982.2016.06.002
中图分类号:R975.6
文献标志码:A

