蛋白酶体REGγ对雄性小鼠生精功能的影响
李宁,李磊,赵登攀,李晓涛,张晓峰*
(1.上海市中医医院实验中心,上海 200071;2. 华东师范大学生命科学学院 上海 200241)
·实验研究·
蛋白酶体REGγ对雄性小鼠生精功能的影响
李宁1,李磊2,赵登攀2,李晓涛2,张晓峰1*
(1.上海市中医医院实验中心,上海200071;2. 华东师范大学生命科学学院 上海200241)
【摘要】目的研究蛋白酶体REGγ对雄性小鼠生精功能的影响。方法利用免疫蛋白印迹检测小鼠睾丸中REGγ的表达;通过组合酶消化法分离精原干细胞,流式细胞仪检测精原干细胞中c-kit及α6-integrin的表达;通过小鼠精子分析仪检测REGγ基因敲除雄鼠的精子浓度和精子活力;进行小鼠合笼实验检测正常雌鼠和REGγ基因敲除雄鼠合笼后的生育力。结果REGγ在小鼠睾丸中高表达;应用组合酶消化法得到了纯度70%的精原干细胞;REGγ基因敲除雄鼠精原干细胞的c-kit及α6-integrin表达量均显著低于野生型组(P<0.05);REGγ基因敲除型雄鼠的平均精子浓度(37.1×106/ml)和精子活力(54%)均显著低于野生型雄鼠(75.4×106/ml、74%)(P<0.05);REGγ基因敲除型雄鼠与野生型雌鼠合笼后的产仔数均低于野生型雄鼠(P<0.05)。结论蛋白酶体REGγ参与调节雄鼠的生精功能。
【关键词】REGγ;生精;精原干细胞
(JReprodMed2016,25(3):242-247)
11S蛋白酶体激活因子γ(REGγ)系蛋白酶体激活因子REG家族成员蛋白,通过非泛素和ATP依赖途径催化蛋白酶体20S的蛋白水解活性[1-2]。过去认为,REGγ只能促进蛋白酶体降解一些细胞内的短肽,但是不能降解细胞内完整的蛋白分子[3],此观念一度影响了科学家对REGγ的重视程度。2006年,Li等[3]首次发现了REGγ-20S蛋白酶体的第一个细胞内完整的蛋白分子底物SRC-3,随后,又相继发现了另外一些细胞内完整的蛋白分子底物,如细胞周期抑制蛋白p21、p16和p14等[4-5],促进了对REGγ功能的认识。越来越多的证据显示REGγ可能在许多生理以及病理过程中发挥重要的生物学功能。REGγ通过不同机制调控p53的稳定性及活性,进而发挥特定的生物学功能[6-7];在有丝分裂过程中,REGγ可以维持染色体稳定的功能,REGγ在核斑点的形成过程中发挥重要的功能[8]。近期发现,REGγ通过降解B细胞活化诱导激活胞嘧啶核苷脱氨酶影响B细胞抗体多样化的产生[8];一些研究也表明,REGγ与许多癌症的发生发展也密切相关[9-11]。本文研究了REGγ对雄性小鼠生殖功能的影响。
材料与方法
一、试剂和仪器
主要试剂:胶原酶VI、透明脂酸酶、胰酶(Sigma,美国,20140913、20140822、20140911);优质胎牛血清(NBS)、DMEM培养基(Gibco,美国,批号140820);羊抗鼠REGγ单克隆抗体抗体、羊抗鼠PLZF单克隆抗体(Santa Cruz,美国,批号20140911、20141119);BCIP/NBT碱性磷酸酯酶显色试剂盒(上海碧云天)。
仪器:CytoFLEX流式细胞仪(BECKMAN COULTER,美国);Odessey双色激光扫描成像系统(Li-Cor Bioscience,美国);FlexStation3酶标分析仪(MolecularDevices,美国);Tanon-6600凝胶成像系统(上海天能科技);GNP型二氧化碳培养箱(上海精宏实验设备);HTM-IVOS精子活力测定仪(徐州信达医疗)。
二、实验方法
1. 实验动物:野生型及REGγ基因敲除型C57BL6小黑鼠购自John Monaco教授实验室,在华东师范大学SPF级动物房饲养[12]。合笼实验按照以下方式进行:首先用REGγ杂合子雄鼠和REGγ杂合子雌鼠进行合笼,得到同窝的野生型雄鼠和REGγ基因敲除型雄鼠,然后用得到的同窝型野生型雄鼠(野生型组)及REGγ基因敲除雄鼠(基因敲除型组)分别和野生型雌鼠合笼。
2. 精原干细胞的分离与纯化:参照Pramod的方法[13],取7~8 d龄雄性小鼠12~15只,颈椎脱臼法处死。无菌收集两侧睾丸,置于盛有磷酸盐缓冲液(PBS)的小皿中。整个睾丸收集过程在30 min内完成。用尖镊子仔细去除每个睾丸的脂肪垫、附睾及睾丸白膜,加入适量PBS(2~3 ml),吸管用力吹打,将曲细精管吹散。加入相当于组织体积10倍的含1 g/L胶原酶的PBS后入温箱,在37 ℃、5% CO2条件下作用15 min (期间晃动数次)。之后移入5 ml的离心管,轻缓吹打1~2次,静置待曲细精管段沉降后轻轻吸除上清,再重复上述过程1次。加入含1.5 g/L透明质酸酶和0.25%胰蛋白酶的PBS后入温箱,同样条件下作用5~10 min,倒置显微镜下见曲细精管段软散,有的已消散成单细胞或小的细胞团即可。加入含10% NBS、1%青、链霉素的新鲜DMEM培养液终止消化,移入离心管中,1 000 r/min离心3 min或静置5 min,待软散的曲细精管及已解离的精原干细胞沉降后,轻轻吸去上清。重新加入1.5 ml新鲜培养基(DMEM+10% FBS+1% 青、链霉素),吹打8~10次,吹打数次制成单细胞悬液。在7~8 d龄小鼠的睾丸曲细精管上皮上,只存在2种类型的细胞,即A型精原干细胞和支持细胞。将制备的单细胞悬液接种置CO2培养箱中培养,根据支持细胞与精原干细胞贴壁速度快慢的差异,利用选择性贴壁法,待支持细胞开始贴壁极化而精原干细胞仍然悬浮时(体外培养约6~7 h),将未贴壁的精原干细胞随培养基离心收集,准备进行流式细胞检测。
3. 碱性磷酸酶染色鉴定精原干细胞:按照试剂盒进行操作。
4. 流式细胞仪测定c-kit与α6-interin:将收集到的精原干细胞分别添加c-kit与α6-interin抗体,37 ℃孵育1 h,加入到流式细胞仪中进行分析。
5. 小鼠精子浓度及活力鉴定:取8~10周性成熟雄鼠,剖腹取出两侧附睾,剪刀剪开附睾并置于事先准备好的凹形玻璃皿内,37 ℃放置5 min,使精子充分释放出来。5 min后,去除组织碎片,用细的玻璃虹吸管依靠虹吸作用吸取含精子的培养液,置于HTM-IVOS精子活力测定仪中测定。精子浓度过高时需要用培养基进行稀释后再进行测定。
6. 免疫蛋白印迹(Western blotting)小鼠睾丸中REGγ蛋白的表达:提取大脑、唾腺、肺、胃、结肠、肾、睾丸、附睾及胸腺组织。用脱颈椎法处死野生型成年小鼠后,迅速采集上述组织置于研钵中并加入液氮低温研磨,用组织裂解液进行裂解,进行免疫蛋白印迹实验。
7. 免疫组织荧光检测:取1周龄雄鼠睾丸,4%多聚甲醛固定过夜,常规石蜡包埋,切成4 μm切片。按组织免疫荧光常规步骤操作。一抗1∶1 000稀释。免疫荧光显微镜扫描成像。
三、统计学分析
结果
一、精原干细胞的分离及鉴定
1. 采用组合酶消化、选择性贴壁的方法,分离得到的精原干细胞,经细胞计数统计结果表明,精原干细胞的纯度可以达到75%以上(表1)。

表1 组合酶消化法分离纯化精原干细胞的结果
2.碱性磷酸酶染色结果:碱性磷酸酶染色结果显示,精原干细胞有褐色附着物(图1A)。
3. 流式细胞仪及精子浓度、活力分析结果:在6~8 d的小鼠睾丸中存在两种细胞,分别是精原干细胞和支持细胞。通过分离精原干细胞并检测其特定基因的表达,分析REGγ基因对小鼠精原干细胞的影响,从而得到其对雄性生殖的影响。流式细胞仪分析表明,野生型小鼠精原干细胞α6-integrin 与c-kit基因的表达均高于REGγ 基因敲除小鼠,差异有统计学意义(P<0.05)(图1 B)。对10对野生型雄鼠和REGγ基因敲除型雄鼠测量结果进行统计分析,结果显示:野生型雄鼠平均精子浓度为75.4×106/ml,精子活力为74%;而REGγ基因敲除型雄鼠平均精子浓度为37.1×106/ml,精子活力为54%。从结果可以看出,敲除REGγ导致了雄性小鼠精子浓度和精子活力的降低,与野生型组相比,差异有统计学意义(图2)。
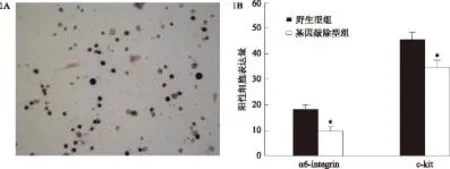
与野生型组比较,*P<0.051A:碱性磷酸酶鉴定结果×100 1B:流式细胞仪检测结果图1 精原干细胞的分离鉴定

与野生型组比较,*P<0.052A:REGγ基因敲除雄鼠与野生型雄鼠精子浓度 2B:REGγ基因敲除雄鼠与野生型雄鼠精子活力图2 REGγ基因敲除雄鼠精子浓度和精子活力
二、REGγ在睾丸组织中高表达
相对于其他组织,REGγ在睾丸中表达量很高,提示REGγ可能在雄性生殖方面发挥了一定的生物学功能(图3)。REGγ与PLZF蛋白表达位置一致,由于PLZF是精原干细胞标志分子,通过对1周龄野生型雄鼠睾丸组织检测表明,REGγ与PLZF在精原干细胞中共表达于细胞核内(图4)。

图3 Western blotting检测REGγ在成年小鼠各个组织表达分布

图4 REGγ和PLZF在精原干细胞中共表达 免疫荧光染色法 ×20
五、REGγ基因敲除雄鼠后代减少
REGγ基因敲除雄鼠在繁殖后代的能力方面显著低于野生型雄鼠 (P<0.05)。野生型雌鼠在与REGγ基因敲除雄鼠合笼时,其产生后代的周期变长,且每窝产生的小鼠后代数目有显著的减少(表2)。

表2 野生型组(REGγ+/+)和基因敲除型组(REGγ-/-)
注:与野生型组比较,*P<0.05
讨论
真核生物细胞中存在不同种类的能够激活20S的激活因子,如19S,11S等,形成各种结构不尽相同的20S蛋白酶体与调节亚基的复合物[14]。其中两种蛋白酶体激活因子PA200与REGγ有很高的相似度。PA200在DNA损伤修复中有很重要的作用[15],而REGγ能够通过影响p21、p53的水平作用于细胞周期[6],提示PA200与REGγ作用的相似性。有研究表明[16],PA200参与小鼠精子发生的过程,而与PA200有极高相似性的REGγ在雄鼠睾丸组织中有很高的表达,因此,有必要对REGγ在小鼠生精过程中的作用进行深入的探讨。
为了获得高纯度的小鼠精原干细胞用于REGγ功能的研究,根据参考文献报道[13],本实验利用改进的组合酶消化法将生精小管制成细胞悬液,组合酶包括胶原酶IV、胰蛋白酶和透明质酸酶。胶原酶IV和透明质酸酶主要消化细胞间质,对细胞影响不大。胰蛋白酶的短时、多次消化可以减少对细胞的损伤,并能充分分离精原干细胞和支持细胞。实验结果显示,这种组合酶消化法可以制备出高含量和高质量的精原干细胞悬液。然后利用两次选择性贴壁法收集精原干细胞,所得细胞70%以上均为精原干细胞。实验证明,此方法分离得到的细胞数量多,纯度比较高,增生旺盛,而且分离时间短,污染机会少,工作效率显著提高。
在小鼠及大鼠的睾丸中,kit配体是由支持细胞分泌的,而c-kit受体则存在于A型精原干细胞上。在B型及初级精母细胞为低水平表达,在精子细胞中不表达,因此,c-kit受体可作为A型精原干细胞的标志物,但该受体并不是精原干细胞特有的标志物,在其它干细胞中也有表达,故也常作为干细胞的一个常见的辅助检测指标[17],结合精原干细胞膜表达蛋白α6-整合蛋白[18],利用流式细胞仪技术,表明在REGγ基因敲除雄鼠睾丸内,精原干细胞数目明显减少,而精原干细胞是精子发生的起点,精原干细胞数目的减少对精子发生过程产生影响并导致精子浓度的降低,最终表现为REGγ基因敲除雄鼠生殖能力的下降。
REGγ在睾丸组织内高表达,表明REGγ有可能在睾丸中发挥着某种生物学功能。本文通过对野生型及REGγ基因敲除雄鼠进行系统的研究分析,发现敲除REGγ基因使得雄性小鼠生殖能力降低,主要表现在以下几个方面:(1)与REGγ基因敲除雄鼠合笼的野生型雌鼠产生的后代数目减少;(2)REGγ基因敲除雄鼠精子浓度降低;(3)REGγ基因敲除雄鼠精子活力降低。这几个指标的高低都代表着雄性生殖能力的强弱。相比较于野生型雄鼠,ERGγ基因敲除雄鼠这几个指标数值的降低,表明REGγ基因敲除雄鼠的生殖能力降低。
通过对野生型及REGγ基因敲除雄鼠睾丸组织切片进行免疫荧光染色,发现REGγ敲除雄鼠睾丸内精原干细胞的数目较野生型雄鼠有一定程度减少。REGγ基因敲除雄鼠睾丸内PLZF阳性细胞较野生型雄鼠有明显减少,表明REGγ基因敲除雄鼠睾丸内PLZF蛋白含量的减少导致了精原干细胞数目的减少。
PLZF是未分化的精原干细胞的标志蛋白,而且对于维持精原干细胞的自我更新发挥着重要的作用[19]。REGγ蛋白酶体的激活可以刺激P53蛋白的降解,P53/TGF-β信号通路可以通过REGγ的过表达干扰REGγ-20S蛋白酶体的信号通路。通过降解P53蛋白介导的对精原干细胞重要因子PLZF的转录调控,导致REGγ基因敲除雄鼠睾丸内PLZF蛋白的低表达,并最终导致精原干细胞数目减少[2]。但是REGγ是如何通过P53介导,其具体的信号通路是否只是通过PLZF转录调控,或者有其它的通路还需要通过进一步的实验进行验证。
总之,REGγ敲除小鼠精子浓度、活力以及后代数目明显低于野生型小鼠,初步验证了其在小鼠生精过程中的重要功能,揭示了REGγ在雄性生殖系统中的关键作用,为REGγ在男性不孕不育病症的治疗提供了一定的理论基础。
【参考文献】
[1]Nikaido T,Shimada K,Shibata M,et al. Cloning and nucleotide sequence of cDNA for Ki antigen,a highly conserved nuclear protein detected with sera from patients with systemic lupus erythematosus[J]. Clin Exp.Immunol,1990,79:209-214.
[2]Ali A,Wang Z,FU J,et al. Differential regulation of the REGγ-proteasome pathway by p53/TGF-β signaling and mutant p53 in cancer cells[J]. Nat Commun,2013,4:2667.
[3]Li X,Lonard DM,Junq SY,et al. The SRC-3/AIB1 coactivator is degraded in ubiquitin-and ATP-independent manner by the REGγ proteasome[J]. Cell,2006,124:381-392.
[4]Chen X,Barton LF,Chi Y,et al. Ubiqutin-independent degradation of cell-cycle inhibitors by the REGγ proteasome[J]. Mol Cell,2007,26:843-852.
[5]Wu Y,Wang L,Zhou P,et al. Regulation of REGγ cellular distribution and function by SUMO sodification[J]. Cell Res,2011,21:807-816.
[6]Liu J,Yu G,Zhao Y,et al. REGγ modulates p53 activity by regulating its cellular localization[J]. J Cell Sci,2010,123:4076-4084.
[7]Levy-Barda A,Lerenthal Y,Davis AJ,et al. Involvment of the muclear proteasome activator PA28γ in the cellular response to DNA duble-strand breaks[J]. Cell Cycle,2011,10:4300-4310.
[8]Masson P,Lundin D,Soderbom F,et al. Characterization of a REG/PA28 proteasome activator homolog in dictyostelium discoideum indicates that the ubiquitin-and ATP-independent REGgamma proteasome is an ancient nuclear protease[J]. Eukaryot Cell,2009,8:844-851.
[9]He J,Cui L,Zeng Y,et al. REGγ is assoiciated with multiple oncogenic pathways in human cancers[J]. BMC cancer,2012,12:75.
[10]Roessler M,Rollinger W,Mantovani-Endi L,et al. Indentification of PSME3 as novel serum tumor marker for colorectal cancer by combining two-dimensional polyacrylamide gel electrophoresis with a strictly mass spectrometry-based approach for data analysis[J]. Mol Cell Proteomics,2006,5:2092-2101.
[11]Zhang M,Gan L,Ren GS,et al. REGγ is a strong candidate for the regulation of cell cycle,proliferation and the invasion by pooly differentiated thyroid carcinoma cells[J]. Braz J Med Biol Res,2012,45:459-465.
[12]Li L,Dang Y,Zhang J,et al. REGγ is critical for skin carcinogenesis by modulating the Wnt/β-catenin pathway[J]. Nat Commun,2015,6:6875.
[13]Pramod RK,Mitra A. In vitro culture and characterization of spermatogonial stem cells on sertoli cell feeder layer in goat(Capra hircus)[J]. J Assist Reprod Genet,2014,31:993-1001.
[14]Demartino GN,Gillette TG. Progeasomes:machines for all reasons[J]. Cell,2007,129:659-662.
[15]Ustrell V,Hoffman L,Pratt G,et al. PA200,a nuclear proteasome activator involved in DNA repair[J]. EMBO J,2002,21:3516-3525.
[16]Khor B,Bredemeyer AL,Huang CY,et al. Proteasome activator PA200 is required for nomal spermatogenesis[J]. Mol Cell Biol,2006,26:2999-3007.
[17]Chan F,Oatley MJ,Kaucher AV,et al. Functional and molecular features of the Id4+germline stem cell population in mouse testes[J]. Genes Dev,2014,28:1351-1362.
[18]Shinohara T,Avarbock MR. Brinster RL,et al. β1-and α6-integrin are surface markers on mouse spermatogonial stem cells[J]. Proc Natl Acad,1999,96:5504-5509.
[19]Filipponi D,Hobbs RM,Ottolenqhi S,et al. Repression of kit expression by Plzf in germ cells[J]. Mol Cell Biol,2007,27:6770-6781.
[编辑:侯丽]
Effects of REGγ on spermatogenesis of male mouse
LINing1,LILei2,ZHAODeng-pan2,LIXiao-tao2,ZHANGXiao-feng1*
1.ShanghaiMunicipalHospitalofTraditionalChineseMedicine,Shanghai200071
2.CollegeofLifeScience,EastChinaNormalUniversity,Shanghai200241
【Abstract】
Objective: To study the effect of REGγ on mouse spermatogenisis.
Methods: The expression of REGγ in mouse testis was detected by using Western blot. The spermatogonial stem cells was isolated by enzymatic digestion method. The expression of c-kit and α6-integrin in spermatogonial stem cells were detected by using flow cytometry. The sperm concentration and motility of REGγ knockout mouse were analyzed by computer assisted sperm analysis system. The fertility of offspring of REGγ knockout and wild type mouse was investigated by mating experiment.
Results: REGγ was highly expressed in mouse testis. About 70% purity of spermatogonial stem cells were obtained by enzymatic digestion method. The expression of c-kit and α6-integrin in spermatogonial stem cells from knockout mice was significant lower than that from wild type mice (P<0.05). Besides,both sperm concentration (37.1×106/ml vs. 75.4×106/ml)and sperm motility (54% vs. 74%) in knockout mice were significantly lower in REGγ wild type mice (P<0.05). The numbers of offspring of REGγ knockout of REGγ mice were significantly less than that of wild type male mice (P<0.05).
Conclusions: REGγ is involved in regulation of spermatogenisis.
Key words:REGγ;Spermatogenesis;Spermatogonial stem cells
【作者简介】李宁,男,河北保定人,硕士,工程师,发育生物学专业.(*通讯作者)
【基金项目】上海市自然科学基金国际合作项目(项目编号:14430712100)
【收稿日期】2015-09-09;【修回日期】2015-10-13
DOI:10.3969/j.issn.1004-3845.2016.3.009

