宫颈粘液腺癌48例临床病理分析
刘鹏飞,李洁,吴鸣,沈铿,黄惠芳,向阳
(中国医学科学院,北京协和医学院,北京协和医院妇产科,北京 100730)
宫颈粘液腺癌48例临床病理分析
刘鹏飞,李洁,吴鸣,沈铿,黄惠芳,向阳*
(中国医学科学院,北京协和医学院,北京协和医院妇产科,北京100730)
【摘要】目的探讨宫颈粘液腺癌患者治疗后的近期和远期疗效,并分析其预后影响因素。方法收集中国医学科学院北京协和医院2000年1月至2014年10月收治的48例宫颈粘液腺癌患者的临床病理资料,分析其年龄分布、临床病理特点、治疗、预后及相关影响因素。结果患者中位年龄为43岁(23~72岁);临床分期:IA2期1例,IB1期16例,IB2期12例,IIA期5例,IIB期9例,III期4例,IV期1例;病理分型:宫颈管型38例,肠型1例,胃型(微偏腺癌)7例,印戒细胞型2例;宫颈局部肿瘤直径:≤4 cm者30例,>4 cm者18例。术后病理发现:33例子宫颈深间质受侵(浸润深度≥1/2),11例淋巴血管间隙受累(LVSI),14例盆腔和(或)腹主动脉旁淋巴结有转移。48例宫颈粘液腺癌患者中,近期疗效有效率>75%,随访期内死亡者共20例,5年累积总生存率49%,中位总生存时间为68个月。随访期内共21例患者术后出现复发、转移,中位复发、转移时间为12个月(1~55个月)。20例已死亡,1例带瘤生存。单因素生存分析显示,宫颈粘液腺癌患者的预后与肿瘤大小、脉管瘤栓、宫旁侵犯及淋巴结转移显著相关(P<0.05);多因素分析显示:仅淋巴结转移与否是独立的预后影响因素(P<0.001)。结论宫颈粘液腺癌患者的总体预后较差,发生淋巴结转移是影响其预后的重要不良因素。
【关键词】宫颈肿瘤;腺癌,粘液;肿瘤分期;子宫切除术;预后
(JReprodMed2016,25(3):226-231)
宫颈癌是妇科常见恶性肿瘤之一,在女性癌症患者死亡原因中居第4位。近年来,随着宫颈癌筛查的普及,宫颈癌发病率及病死率明显下降,其中腺癌约占10%~34%,虽然较少,但近年来发病呈上升及年轻化的趋势[1-2]。宫颈腺癌的生物学行为及对治疗的反应异于鳞癌,是导致其5年生存率较低的主因。其中宫颈粘液腺癌组织形态学表现多样,分类复杂,误诊率高,相关研究亦较少,本文总结了48例宫颈粘液腺癌的资料,分析了不同临床病理因素并分析其对预后的影响,以期提高宫颈粘液腺癌的诊治水平。
资料与方法
一、研究对象
连续收集本院妇产科于2000年1月至2014年10月收治的全部宫颈腺癌503例,宫颈粘液腺癌54例,占同期宫颈腺癌10.7%。剔除5例外院接受手术但无详细病理资料记录者或未行手术单纯接受放化疗者及1例放弃治疗者(IIB期1例,III期3例,IV期1例),接受手术治疗并有明确临床病理资料者48例。将该48例患者纳入本次临床病理研究。48例患者确诊时的中位年龄为43岁(23~72岁),确诊时均未发现有严重心血管或内分泌相关疾病。按照国际妇产科联盟(FIGO)2014年标准[3]进行临床分期:IA2期1例,IB1期16例,IB2期12例,IIA期5例,IIB期9例,III期4例,IV期1例。按照2014年WHO标准[4]进行病理分型:宫颈管型38例,肠型1例,胃型(微偏腺癌)7例,印戒细胞型2例;年龄:<40岁者17例,>40岁者31例;肿瘤大小:宫颈局部肿瘤直径≤4 cm者30例,>4 cm者18例。分化程度:高分化26例,中分化16例,低分化6例。
二、治疗
IA-IIA期34例,均行广泛性全子宫切除术,和(或)双侧附件切除及盆腔和(或)腹主动脉淋巴结清扫术,6例较年轻患者保留卵巢。其中,11例患者接受术前新辅助化疗(1~3疗程),主要指征为肿瘤直径>4 cm;28例接受术后辅助放疗,2例单纯化疗(均为顺铂+氟尿嘧啶),3例放疗+化疗(2例为卡铂+紫杉醇,1例为紫素+和美新),放疗采用相应的阴道残端野或盆腔野体外照射,放疗前应用DDP(顺铂)增敏。
9例IIB期患者中,2例行先期化疗1~3程后根治性子宫切除术加放疗,其中1例34岁年轻患者因强烈要求保留卵巢,于行双卵巢活检阴性后予以保留;另7例患者行放化疗后全子宫+双附件切除术。
4例III期患者:1例行同步放化疗后全子宫切除,术后辅以TC(紫杉醇+卡铂)化疗;1例因盆腔巨大包块怀疑卵巢癌行肿瘤细胞减灭术,病理证实为宫颈粘液腺癌卵巢转移,其后行TC化疗加放疗;1例因卵巢囊肿于外院行全子宫+双卵巢囊肿剥除+右穹窿结节切除术后病理发现宫颈微偏腺癌及结节内浸润,1月后补切双附件+部分阴道+盆腔淋巴结,二次术后补充放疗加化疗;1例于外院因卵巢包块行全子宫+双附件切除术后病理发现宫颈微偏腺癌卵巢转移,术后辅以同步放化疗。
1例IV期患者行子宫+双附件+大网膜+直肠前壁切除术+膀胱修补术。术后辅以放疗。
术后病理情况:子宫颈深间质受侵(浸润深度≥1/2)33 例(68.75%),阴道断端阳性10例(20.83%),宫旁组织受侵7例(14.58%),淋巴血管间隙受累(脉管瘤栓)11 例(22.91%),盆腔和(或)腹主动脉旁淋巴结有转移者14例(29.17%)。
三、随访
以开始治疗时间为起点,至患者死于该肿瘤(或存活者至末次随访)的时间为总生存时间,到观察到疾病进展或发生因为任何原因的死亡为无进展生存时间。应用先期化疗或放疗者,结合超声、妇科检查、核磁共振扫描(MRI)或电子计算机X射线断层扫描(CT)评估肿瘤变化情况。治疗完成2年内,每3~6个月复查1次,治疗完成2年及以上者,每6~12个月复查1次;发现可疑症状及体征则随时复诊。复查的内容包括:妇科检查、浅表淋巴结触诊、宫颈细胞学检查、及必要的影像学检查,包括胸片、B超、CT、MRI检查等。对没有规律返院复查的患者采用电话随访。随访截止时间为2015年10月,中位随访时间36个月(5~170个月),3例患者失访,该3例失访数据作为删失值,纳入生存分析。
四、统计学方法
采用SPSS 19.0软件进行统计学分析。生存率计算采用Kaplan-Meier法,与生存相关的单因素分析采用log-rank法。多因素分析应用Cox回归。P<0. 05为有统计学意义。
结果
一、宫颈粘液腺癌患者的近期和远期疗效
近期疗效:接受术前放疗和(或)化疗的21例患者中,根据2009年肿瘤疗效评价标准:病灶消失,所有病理淋巴结短径<10 mm(CR)11例,目标病变长径总和相比基线评估下降≥30% (PR)6例,病情稳定或进展4例,术前评估为有效,(CR+PR)>75%。检查宫旁组织均有不同程度的变软,间隙增宽。
远期疗效:随访期内死亡者共20例。5年累积生存率为49%,中位总生存时间为68个月。随访期内共21例患者术后出现复发、转移,中位复发、转移时间为12个月(1~55个月)。复发、转移部位:盆腔复发8例,肺转移4例,骨转移1例,膀胱转移1例,结肠转移2例,肾转移1例,直肠转移1例,锁骨上淋巴结转移2例,纵膈淋巴结转移1例,腋下淋巴结转移1例,髂血管旁淋巴结转移1例,其中5例患者为多发性转移(转移部位≥2个)。21例复发、转移患者中,20例死亡,1例带瘤生存。
二、影响宫颈粘液腺癌患者预后的相关因素分析
单因素生存分析显示,治疗前子宫颈局部肿瘤直径≥4 cm的宫颈粘液腺癌患者预后明显差于<4 cm者(P<0.05),有宫旁侵犯的患者预后差于无宫旁侵犯者(P<0.05),有脉管瘤栓及盆腔和(或)腹主动脉旁淋巴结转移均为患者预后的不良因素,两者统计学差异明显(P<0.01),其相关生存曲线见(图1)。而年龄、病理类型、肿瘤分期、切缘、宫颈深间质受侵、术中是否保留卵巢与患者的预后无关(P>0.05)(表1)。

表1 影响宫颈粘液腺癌患者的单因素分析
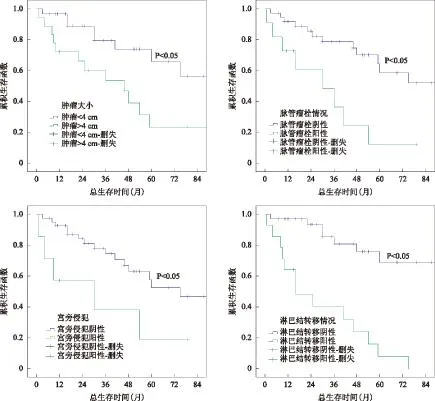
图1 肿瘤大小、脉管瘤栓、宫旁浸润及淋巴结转移情况生存曲线
将肿瘤大小、脉管瘤栓、宫旁侵犯及淋巴结转移纳入预后多因素Cox比例风险模型进行分析,结果显示,只有淋巴结转移与无进展生存期和总生存期有关(P<0.001)(表2)。
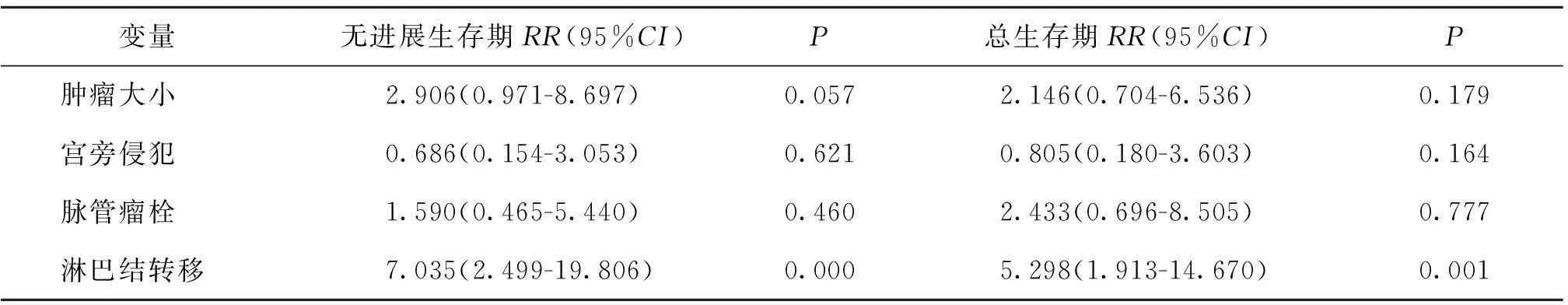
表2 宫颈粘液腺癌无进展生存期和总生存期的多因素分析
讨论
一、宫颈粘液腺癌的临床特点
根据2014年WHO宫颈肿瘤病理分类[4],宫颈黏液腺癌来源于宫颈内膜柱状黏液细胞,是宫颈腺癌的较少见病理类型,可进一步细分为宫颈管型、肠型、胃型、印戒细胞型四个不同亚型。临床主要表现为持续性大量黏液或水样分泌物,也可表现为阴道不规则出血,由于临床表现缺乏特异性,且多在颈管内生长,临床诊断有一定难度。此外,相较于宫颈鳞癌,细胞学筛查和人乳头瘤病毒(HPV)检测对宫颈腺癌的诊断意义稍差。本文中12例行术前HPV检查者,9例阳性,3例阴性。22例患者行宫颈细胞学涂片检查,阳性率为45%(10/22),稍高于韩肖燕等[5]报道的36.8%及曾四元等[6]报道的28%检出率。对于细胞学检查阴性患者,最后经宫颈活检及宫颈管搔刮术或宫腔镜检查、诊断性锥切术后才确诊。其中胃型又称为微偏腺癌,作为粘液腺癌的一类罕见亚型,其发病率约占宫颈腺癌的1%~3%,所有宫颈癌的0.15%~0.45%[7]。宫颈微偏腺癌分化程度高,组织学特征与其他良性病变甚至正常腺体难以区分,临床症状亦不典型,早期诊断困难[8]。鉴于微偏腺癌临床表现和病理学检查缺乏特异性,因此在临床上对于有阴道多量排液,不规则出血等相关表现,而HPV、细胞学检查无阳性发现的患者,应警惕微偏腺癌存在的可能性,必要时行MRI及超声等影像学检查,进行深部活检取材病理检查或行锥切术以进一步明确或排除。
二、宫颈粘液腺癌的治疗
总体上,宫颈腺癌的预后要差于同期别的宫颈鳞状细胞癌[8],本研究中,对于IA2-IIA期的早期宫颈黏液腺癌标准的治疗方式为广泛性子宫切除术和(或)双侧附件切除及盆腔和(或)腹主动脉淋巴结清扫术,同时对具有高危因素的患者给予术后辅助治疗。Chen等[9]认为对于早期宫颈腺癌患者,单纯手术的疗效要优于单纯放疗,可能与宫颈腺癌对放疗的敏感性较差有关。而Rotman等[10]则认为,术后放疗可以降低IB期宫颈腺癌及腺鳞癌患者的复发率。Peters等[11]发现治疗方式中包含化疗的患者其4年无进展生存率可提高至80%。Stehman等[12]通过对IB期宫颈癌患者的随访发现,相对于单纯放疗,以铂类药物为基础的化疗联合放疗更有利于改善患者的无进展生存率及总体生存率。
IIB期的宫颈腺癌应该以根治性放疗为主,辅以化疗。本文9例IIB期患者,2例行先期化疗1~3程后观察肿瘤体积缩小行根治性子宫切除术,术后辅以放疗,截至随访期2例患者均未复发;7例行放化疗后全子宫+双附件切除术者5例于术后12~55个月内复发,1例术后5月发现髂淋巴结转移,该6例患者中5例死亡,1例带瘤生存。因宫颈腺癌对放疗相对不敏感,放疗后肿瘤未得到控制及复发的几率较高,有学者认为进行同步放化疗时以紫杉醇和顺铂化疗进行辅助和巩固,有助于改善患者预后[13]。除此之外,辅助子宫切除可能具有一定的价值,尚需更多临床研究加以证实。
Ⅲ期以上的宫颈腺癌则以放疗为主,有助于缩小局部病灶、减轻症状、减少复发和转移。文献报道Ⅲ期宫颈腺癌综合治疗的5年生存率可以达到30%以上[12]。本研究中4例III期患者及1例IV期患者均死亡,其中3例死亡患者为微偏腺癌,提示相较于其他型别宫颈腺癌,粘液腺癌预后更差,尤以微偏腺癌为甚,有3例III期患者因外院怀疑“卵巢病变”进行手术,通过术后病理证实为宫颈腺癌卵巢转移。考虑与该病理类型临床进展快,早期诊断困难,发现病变时多已晚期有关。
微偏腺癌术前诊断较困难,病例数少,相关处理经验仍需积累。由于其具有易浸润、早期易转移扩散特点,且对于放化疗不够敏感,目前大多数学者认为手术治疗是最佳选择,对于早期患者,建议行广泛性全子宫切除术+盆腔淋巴结清扫术,根据是否伴有高危因素,术后酌情辅助放、化疗;晚期则采取同步放、化疗。但该治疗方案中手术方式的选择对年轻患者是否适用以及化、放疗的治疗价值仍需进一步研究[14-18]。
三、宫颈粘液腺癌的预后影响因素
本文48例进行手术的患者中,年龄<40岁患者5年生存率及中位生存时间均低于>40岁者,但差异无统计学意义,是否提示年轻患者宫颈腺癌预后更差仍需进一步研究。此外,本文研究中发现胃型(微偏腺癌)5年生存率低于宫颈管型及肠型,分期越低生存率也相应降低,切缘阳性者生存率低于阴性者,浸润肌层越深生存率越低,但以上均无统计学意义(P>0.05),分析可能跟本文研究病例数较少有关,同时宫颈粘液腺癌特殊的生物学行为如肿瘤侵袭性强、早期诊断困难等特点,使得基于宫颈鳞癌或其他类型宫颈腺癌的常见高危因素并不一定适用于宫颈粘液腺癌。因此尚需大规模研究进一步证实这些病理因素的意义。而肿瘤大小,有无脉管瘤栓、宫旁浸润及淋巴结转移与宫颈黏液腺癌预后有关。宫颈局部肿瘤较大,易发生淋巴、血管间隙受侵,发生宫旁浸润,淋巴结转移者,生存率降低,中位生存时间下降。经多因素分析后只有淋巴结是否转移是其独立影响因素。因此,对于淋巴结转移的宫颈粘液腺癌患者应加强警惕,存在相关高危因素的患者应予以综合治疗以利于改善预后。
综上,宫颈粘液腺癌发生率低,患者总体预后差,如何采取有效的手段进行早期诊断和治疗对于降低患者的复发和死亡率尤其重要。此外,从分子生物学角度发现其发生、发展的一些关键生物靶点,可作为另一条思路进行针对性诊治。
【参考文献】
[1]Kokawa K,Takekida S,Kamiura S,et al. The incidence,treatment and prognosis of cervical carcinoma in young women:a retrospective analysis of 4,975 cases in Japan[J]. Eur J Gynaecol Oncol,2010,31:37-43.
[2]Hovland S,Muller S,Skomedal H,et al. E6/E7 mRNA expression analysis:a test for the objective assessment of cervical adenocarcino- ma in clinical prognostic procedure[J]. Int J Oncol,2010,36:1533-1539.
[3]Belhadj H,Berek J,Bermudez A,et al. FIGO staging for carcinoma of the vulva,cervix,and corpus uteri[J].Int J Gynecol Obstet,2014,125:97-98.
[4]Kurman RJ,Carcangiu ML,Simon Herrington C,et al. World Health Organization classification of tumours of female reproductive organs[M]. Lyon:IARC Press,2014.
[5]韩肖燕,郄明蓉,曹泽毅,等.134 例原发性宫颈腺癌临床特点及预后分析[J].中国医药导刊,2008,10:2-6.
[6]曾四元,关玲,梁美,等.宫颈黏液腺癌88例临床病理分析[J].中华妇产科杂志,2013,48:602-606.
[7]Li GL,Jiang W,Gui SQ,et al.Minimal deviation adenocarcinoma of the uterine cervix[J].Int J Gynecol Obstet,2010,110:89-92.
[8]Park JY,Kim DY,Kim JH,et al. Outcomes after radical hysterectomy in patients with early-stage adenocarcinoma of uterine cervix[J]. Br J Cancer 2010,102:1692-1698.
[9]Chen YL,Ho CM,Chen CA,et al. Impact of various treatment modalities on the outcome of stage IBl-IIA cervicaladenocareinoma[J].Int J Gynaecol Obstet,2011,112:135-139.
[10]Rotman MZ,Sedlis A,Piedmonte MR,et a1.A Phase llIrandomized trial of postoperative pelvic irradiation in stage I Bcervical carcinoma with poor prognostic features:follow-up of agynecological oncology group study[J]. Int J Radiat Oncol Biol Phys,2006,65:169-176.
[11]Peters WA,3rd,Liu PY,Barrett RJ 2nd,et al. Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix.[J]. Clin Oncol,2000,18:1606-1613.
[12]Stehman FB,Ali S,Keys HM,et al. Radiation therapy with or without weekly cisplatin for bulky stage IB cervical carcinoma:follow-up of a Gynecological Oncology Group trial[J]. Am J Obstet Gynecol,2007,197(5):503. e1-6.
[13]Tang J,Tang Y,Yang J,et al. Chemoradiation and adjuvant chemotherapy in advanced cervical adenocarcinoma[J]. Gynecologic Oncology,2012,125:297-302.
[14]Tsuji T,Togami S,Nomoto M,et al. Uterine cervical carcinomas associated with lobular endocervical glandular hyperplasia.[J] Histopathology,2011,59:55-62.
[15]Lee H,Kim K,Cho N,et al. MicroRNA expression profiling and Notch1 and Notch2 expression in minimal deviation adenocarcinoma of uterine cervix[J]. World J Surg Oncol,2014,12:334.
[16]Nishil Y,Fukuda T,Imal K,et al. Minimal deviation mucinous adenocarcinoma of the uterine cervix that proved difficult to differentiate from endometrial cancer:A case report[J]. Oncol Lett,2014,8:2481-2484.
[17]Ferrandina G,Carbone A. Macchia G,et al. A complete Pathological Response to Treatment in a Young Patient with Locally Advanced Minimal Deviation Adenocarcinoma of the Uterine Cervix Undergoing Chemoradiation followed by Radical Surgery[J]. Gynecol Obstet Invest,2011,72:141-144.
[18]Zhu L,Yi X,Lin B,et al. A clinicopathological and immunohistochemical study of minimal deviation adenocarcinoma of the uterine cervix[J].Med Hypotheses,2013,80:643-648.
[编辑:谷炤]
关于确定文稿作者的几点说明
科技文稿的作者应是:(1)参与选题、设计,或参与资料分析和解释者;(2)起草或修改论文中关键性理论或其他主要内容者;(3)能对编辑部所提意见进行核对修改,在学术界进行答辩,并最终同意该文发表者。上述三者均需具备。仅参与获得资助或收集资料者,对科研设计进行一般管理者,不能列为作者。集体署名的文稿必须明确能对该文负责的作者。其他对该研究有贡献者,可在文后注明致谢。外籍作者应征得本人同意,并附证明信。作者顺序应在投稿时确定,在编排过程中不应再作更动。
本刊编辑部
Clinical pathologic analysis of 48 patients with mucinous adenocarcinoma of the uterine cervix
LIUPeng-fei,LiJie,WUMing,SHENKeng,HUANGHui-fang,XIANGYang*
DepartmentofObstetrics&Gynecology,PekingUnionMedicalCollegeHospital,CAMS&PUMCBeijing100730
【Abstract】
Objective: To analyze the short-term and long-term treatment effect on cervical mucinous adenocarcinoma and its prognostic factors.
Methods: The data of forty eight patients with mucinous adenocarcinoma of the uterine cervix diagnosed and treated in Peking Union Medical College Hospital from January 2000 to October 2014 were analyzed retrospectively. The data included clinic pathological characteristics,treatment,and prognosis.
Results: The patients’ median age was 43 years (range,23-72 years). Clinical stage was as follows:1 case stage IA1,16 cases stage IB1,12 cases stage IB2,5 cases stage IIA,9 cases stage IIB,4 cases stage III,1 case stage IV. Pathologic types was as follows:38 cases of endocervical type,1 case of intestinal type,7 cases of gastric type,2 cases of signet-ring cell type. The diameter of cervical tumor was as follows:30 cases≤4 cm,18 cases>4 cm. Pathologic examination showed that 33 cases with cervical deep stromal invasion (thickness≥1/2),11 cases with lymph-vascular space invasion (LVSI),and 14 cases with pelvic and (or) para-aortic lymph nodes metastasis. Among 48 patients with mucinous adenocarcinoma of uterine cervix,twenty patients died during the follow-up period. The cumulative overall survival (OS) of 5 years was 49%,and the median overall survival time was 68 months. Twenty patients had recurrence and metastasis,and the median recurrence and metastasis time was 12 months (range,1-55 months). Among 21 patients with recurrence and metastasis,20 patients died and 1 patient was survival with tumor-bearing. The univariate analysis showed that tumor size,vascular tumor thrombus,LVSI,and pelvic and para-aortic lymph nodes metastasis were the significant prognostic factors(P<0.05).The multivariate analysis showed that pelvic and (or) para-aortic lymph nodes metastasis was the only significant prognostic factors (P=0.000).
Conclusions: The prognosis of cervical mucinous adenocarcinoma is poor,and pelvic and (or) para-aortic lymph nodes metastasis is a significant adverse prognostic factor.
Key words:Cervical neoplasms;Adenocarcinoma;Mueinous;Neoplasm staging;Hysterectomy;Prognosis
【作者简介】刘鹏飞,女,山东人,博士,妇产科专业(* 通讯作者,Email:xiangy@pumch.cn)
【基金项目】国家自然基金项目(81472446)
【收稿日期】2015-11-16;【修回日期】2015-12-23
DOI:10.3969/j.issn.1004-3845.2016.3.006

