添加多酚对鲤鱼肌原纤维蛋白结构及膜性能的影响
张慧芸,吴静娟,段 续(河南科技大学食品与生物工程学院,河南 洛阳 471023)
添加多酚对鲤鱼肌原纤维蛋白结构及膜性能的影响
张慧芸,吴静娟,段 续
(河南科技大学食品与生物工程学院,河南 洛阳 471023)
摘 要:研究不同添加量(1%、2%、3%、4%、5%)多酚化合物(阿魏酸、鞣酸、迷迭香酸和丁香酸)对鲤鱼肌原纤维蛋白结构和膜特性的影响。结果表明,与丁香酸、迷迭香酸和阿魏酸相比,添加鞣酸的蛋白成膜液中自由氨基和巯基含量最低,表明鞣酸具有较高的蛋白交联能力(P<0.05)。随着多酚添加量的增加,膜的弹性和拉伸强度逐渐增强,断裂伸长率逐渐降低(P<0.05),表明添加多酚化合物提高了膜的硬度和强度。在相同质量分数条件下,添加鞣酸的鲤鱼肌原纤维蛋白膜具有最高的弹性和拉伸强度。添加多酚化合物有效降低了鲤鱼肌原纤维蛋白膜的紫外和可见光透过率,降低程度取决于多酚的种类和浓度。添加多酚化合物的鲤鱼肌原纤维蛋白膜可用于高脂食品的内包装,防止食品脂质氧化、延长货架期。
关键词:多酚;肌原纤维蛋白;结构;膜;性能
引文格式:
张慧芸,吴静娟,段续.添加多酚对鲤鱼肌原纤维蛋白结构及膜性能的影响[J].食品科学,2016,37(5):35-40.
ZHANG Huiyun,WU Jingjuan,DUAN Xu.Effect of polyphenolic compounds on protein structure and film properties of common carp myofibrillar protein[J].Food Science,2016,37(5):35-40.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605007.http://www.spkx.net.cn
可食性膜是以天然可食性物质为原料,通过不同分子间相互作用形成的具有多孔网络结构的薄膜,可作为食品成分直接食用。随着现代食品技术的发展和对绿色食品的推崇,可食性膜已成为食品保鲜与包装领域研究的热点[1]。与多糖和脂质膜相比 ,蛋白膜具有更广泛的功能特性,特别是具有更高的分子间结合潜力[2]。蛋白膜的性质是由其微观结构决定的,蛋白质结构和多肽链分子间相互作用显著影响蛋白膜的微观结构[3]。由于蛋白膜可选择性阻隔水分转移、氧气透过、紫外和可见光透过和挥发性芳香物质的损失,用于包装可延长食品货架期,维持食品贮藏期间品质[4-5],目前已被应用于坚果或焙烤食品的涂布膜[6]。
已有研究表明鱼肉肌原纤维蛋白和肌浆蛋白可被用作成膜材料。如Chinabhark等[7]采用0.02 g/mL大眼鲷鱼肌原纤维蛋白添加50%甘油塑化制备可食性蛋白膜,发现膜具有较高的拉伸强度和断裂伸长率。我国是一个渔业大国,淡水鱼类是我国居民食物的重要组成部分,是主要的动物蛋白质来源之一。鲤鱼是中国分布最广、养殖历史最悠久的淡水经济鱼类。适当开发来自鲤鱼肉的肌原纤维蛋白,获得具有营养和生物可降解性的食品包装膜具有一定的应用前景。但是,当蛋白膜暴露于潮湿条件下其机械性能相对较差,且与脂质膜相比成本较高,限制了其作为食品包装的应用[8-9]。因此需要对蛋白质进行结构改性以提高其机械强度和阻水性,可采用化学、物理和酶法改性[10],改善蛋白膜的性能。研究表明,不同来源的酚类化合物可与蛋白质发生相互作用或反应,使明胶材料的凝胶或膜性能得到改善[11]。多酚可在氧化条件下与肽的氨基侧链反应形成蛋白交联[12]。阿魏酸可通过产生共振稳定的自由基中间体与蛋白质和多糖交联[13]。氧化阿魏酸可与蛋白质中的氨基和硫醇基反应[14]。而且,阿魏酸自身反应形成的二阿魏酸可作为蛋白分子之间的连接桥梁[15]。鞣酸也具有结合蛋白质的能力[16]。与其他交互作用相比,酚类化合物和蛋白质共价键产生的共价交联作用更强,热稳定性更好。但是,关于酚类化合物对鱼肌原纤维蛋白结构及其膜性能影响的报道甚少。本实验以鲤鱼肌原纤维蛋白为原料,甘油为增塑剂,添加具有蛋白交联作用的几种多酚化合物(阿魏酸、鞣酸、迷迭香酸和丁香酸),制备鲤鱼肌原纤维蛋白-多酚复合可食性膜,主要研究多酚添加对肌原纤维蛋白结构及膜物理和机械 性能的影响,以期为开发应用新型可食包装技术提供理论参考。
1 材料与方法
1.1材料与试剂
鲜活鲤鱼购于洛阳市大张盛德美超市。
三硝基苯磺酸(trinitro-benzene-sulfonic acid,TNBS)、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithio bis-(2-nitrobenzoic acid),DTNB) 美国Sigma公司;迷迭香酸、丁香酸、阿魏酸(纯度>98%) 上海纯优生物科技有限公司;鞣酸(纯度>99%) 河北百味生物科技有限公司;亚硫酸钠、溴化钠 天津博迪化工有限公司;所用试剂均为分析纯。
1.2仪器与设备
DHG-9003型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;UV-754型紫外-可见光分光光度计上海光谱仪器有限公司;TA-XT2i质构仪 英国Stable Micro Systems公司;CS-32l便携式色差仪 日本美能达公司。
1.3方法
1.3.1鲤鱼肌原纤维蛋白的提取
鲤鱼肌原纤维蛋白提取参照Chin[15]和Jiang Xinjing[17]等的方法并适当修改,提取液采用20 mmol/L、pH 7.5的磷酸盐缓冲液,漂洗液采用0.1 mol/L NaCl。提取过程在4 ℃条件下操作。
1.3.2鲤鱼肌原纤维蛋白成膜液的制备
参考Shiku等[18]的方法,略有修改。配制0.015 g/mL的鱼肌原纤维蛋白溶液,搅拌15 min使其充分溶解,冷却后加入50%的甘油,室温下搅拌30 min。用1 mol/L NaOH调节溶液pH值为11,分别添加0(对照组)、1%、2%、3%、4%和5%的迷迭香酸、丁香酸、阿魏酸和鞣酸,室温下连续充氧搅拌1 h使部分多酚化合物氧化为醌,醌可在碱性条件下与蛋白质氨基发生反应[13-14]。得到成膜液用于分析及干燥成膜。
1.3.3添加多酚对鲤鱼肌原纤维蛋白结构的影响
1.3.3.1自由氨基含量的测定
参考Lertittikul等[19]的方法进行自由氨基含量的测定。取125 μL适当稀释的样品与2.0 mL 0.212 5 mol/L的磷酸盐缓冲溶液(phosphate buffer saline,PBS)(pH 8)充分混合,加入1.0 mL质量分数0.01%的三硝基苯磺酸(trinitro-benzene-sulfonic acid,TNBS)溶液。混合液放入50 ℃水浴中避光保持30 min后,加入2.0 mL 0.1 mol/L亚硫酸钠终止反应。将混合物放于室温下冷却15 min后,采用分光光度计测定其420 nm波长处的吸光度。自由氨基含量根据L-亮氨酸标准曲线计算得出,单位为mmol/L。
1.3.3.2总巯基含量的测定
参考Beveridge等[20]的方法测定成膜液的总巯基含量。取1.0 mL样品成膜液加入9 mL盐酸胍磷酸缓冲液(盐酸胍6 mol/L,PBS 0.1 mol/L,pH 8.0),取4 mL上述混合液加入0.4 mL 质量分数0.1% DTNB ,45 ℃保温,反应25 min,采用分光光度计测定其412 nm波长处的吸光度。巯基含量用摩尔吸光系数13 600 L/(mol·cm)计算,表示为每克蛋白质所含的摩尔数。
1.3.4鲤鱼肌原纤维蛋白膜的制备
将4 g成膜液倒入有机玻璃板(5 cm×5 cm)中,在60 ℃的干燥箱中干燥3 h成膜。之后在装有饱和NaBr溶液的干燥器中(相对湿度56%,20 ℃)平衡48 h,待测。
1.3.5添加多酚对鲤鱼肌原纤维蛋白膜性能的影响
1.3.5.1膜机械性能的测定
参考Yin等[21]的方法,采用质构仪TA-XT2i测定膜的弹性模量(E)、拉伸强度(tensile strength,TS)和断裂伸长率(elongation at break,EAB),每种膜测定5 个样品,每个样品尺寸为2 cm×5 cm。质构分析仪初设夹距为50 mm,拉伸速率设为30 mm/min。样品测试前在25 ℃、50%相对湿度条件下平衡2 d。弹性模量由膜应力应变图的初始斜率测得,拉伸强度和断裂伸长率按下式计算。

式中:Fmax为最大拉力/N;L为膜样品的厚度/mm;W为膜样品的宽度/mm。

式中:L1为膜断裂后的长度/mm;L0为膜断裂前的长度/mm。
1.3.5.2颜色值的测定[22]
使用便携式色差计对其进行测定,参照CIELAB系统表示复合膜的颜色。将膜样品平放在白色校正板上,校正板型号CR-A43,其中L*=94.0,a*=0.313,b*=0.319,测试记录+L*值为亮色方向,-L*值为暗色方向、+a*值为红色方向,-a*值为绿色方向、+b*值为黄色方向,-b*值为蓝色方向以及ΔE值。每个样品选择5 个点进行测量,一个点从中央选取,另外沿着膜四周取4 个点,取平均值。
1.3.5.3透光率的测定
参考Shiku等[23]的方法,用紫外-可见分光光度计测定膜在200~800 nm波长范围内的透光率,每个样品重复测定3 次,取平均值。
1.4数据分析
所得数据均为3 次重复的平均值,用Statistix 8(分析软件,St Paul,MN)进行数据分析,平均数之间差异显著性(P<0.05)通过最小显著差值(least s ignificant difference,LSD)进行判断,用Sigmaplot 9.0软件作图。
2 结果与分析
2.1添加多酚对鲤鱼肌原纤维蛋白成膜液中自由氨基含量的影响
添加多酚对鲤鱼肌原纤维蛋白自由氨基含量的影响如图1所示。添加多酚的成膜液与对照组相比自由氨基含量较低(P<0.05),且随着多酚添加量的增加,成膜液中自由氨基含量显著降低(P<0.05)。这是由于蛋白质氨基酸的α-或ε-NH2可与酚类化合物产生共价交联作用,在较大范围内形成了酚-蛋白复合物,尤其在较高浓度酚类化合物的情况下,酚类化合物的氧化产物——醌具有较强的攻击氨基活性[13-14]。与丁香酸、迷迭香酸和阿魏酸相比,添加鞣酸的蛋白成膜液中自由氨基含量最低,表明鞣酸具有较高的蛋白交联能力(P<0.05)。这是由于鞣酸中羟基含量较高,羟基可被转化为具有交联作用的醌[14,24],此外,剩余羟基可通过弱键与氨基相互作用[25]。Prigent[26]报道了酚类化合物的羟基与氨基酸的氮或氧的相互作用,酚类化合物和氨基酸之间亦可发生疏水相互作用。

图1 添加多酚对鲤鱼肌原纤维蛋白自由氨基含量的影响Fig.1 Free amino group contents of film-forming solutions(FFS)containing fish myofibrillar proteins added with various phenolic compounds at different concentrations
2.2添加多酚对鲤鱼肌原纤维蛋白成膜液中总巯基含量的影响
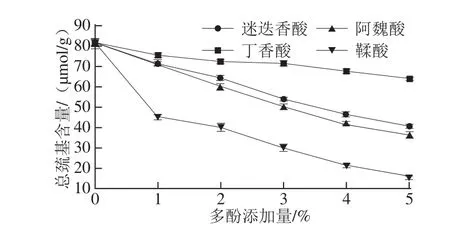
图2 添加多酚对鲤鱼肌原纤维蛋白总巯基含量的影响Fig.2 Sulfhydryl group contents of film-forming solutions(FFS)containing fish myofibrillar proteins added with various phenolic compounds at different concentrations
添加多酚化合物对鲤鱼肌原纤维蛋白总巯基含量的影响如图2所示。与对照组相比,添加多酚化合物的成膜液具有较低的巯基含量(P<0.05)。多酚的添加可能会引起蛋白质巯基和多酚羟基之间的相互作用,形成更好的构造。巯基含量的降低可能是由于添加多酚提高了巯基氧化为二硫键的程度[26]。而且,多酚氧化产物——醌类化合物亦可直接与巯基相互作用[14],导致巯基被醌类化合物掩蔽。咖啡酸和鞣酸在不同浓度水平下均引起巯基含量的较大降低。添加多酚化合物有助于鱼肌原纤维蛋白膜二硫键的形成,提高了膜的强度与刚度。
2.3添加多酚对鲤鱼肌原纤维蛋白膜机械性能的影响
不同添加量的多酚对鲤鱼肌原纤维蛋白膜弹性、拉伸强度和断裂伸长率的影响见图3。如图3A所示,随着多酚添加量的增加,膜的弹性均显著增强(P<0.05)。对照组膜的弹性值最低,为153.45 MPa,添加1%阿魏酸的蛋白膜弹性值与对照组差异不显著(P>0.05)。如图3B所示,随着多酚添加量的增加,膜的拉伸强度也逐渐增加(P<0.05),添加3%~5%的迷迭香酸和丁香酸时膜的拉伸强度增加不再显著(P>0.05)。膜的强度和刚度增加是由于氧化酚类增强了蛋白膜中非二硫共价键与二硫键及非共价键之间的交联作用,表1中蛋白成膜液自由氨基和巯基含量的降低也证实了这一点。
如图3C所示,添加1%~5%的多酚降低了膜的断裂伸长率(P<0.05),添加3%~5%迷迭香酸对膜断裂伸长率的影响差异不再显著(P>0.05)。多酚的添加增强了膜蛋白链的相互作用,使膜的强度和硬度增加,延展性降低,这是由于在碱性条件下酚类化合物可被氧化为醌,醌可作为蛋白交联剂与蛋白质分子的亲核性氨基或巯基侧链反应形成C—N或C—S共价键[14],还可引起蛋白质之间形成非二硫共价键,导致蛋白质分子之间的相互连接更加紧密,改善膜的弹性和拉伸强度。此外,多酚化合物的羟基可通过氢键与蛋白质分子的氢受体结合。Rattaya等[9]报道了添加海藻提取物的胶原蛋白膜机械性能增强主要是由于蛋白质和多酚之间的疏水作用和氢键结合力作用。
在相同添加量条件下,添加鞣酸的蛋白膜具有最高的弹性和拉伸强度,其次是迷迭香酸、丁香酸和阿魏酸。这可能是由于与其他多酚化合物相比,鞣酸对肌原纤维蛋白具有更大的交联能力,蛋白成膜液的自由氨基含量测定结果也证实了这一点。这表明不同结构的酚类化合物与蛋白质的相互作用不同。添加羟基含量高的多酚化合物有利于蛋白质-多酚之间氢键的形成和膜网络结构的改善[13-14]。Cao Na等[11]报道了向碱性胶原蛋白成膜液中添加阿魏酸和鞣酸使膜的拉伸强度显著增加;Friesen等[27]报道了向碱性大豆分离蛋白成膜液中添加阿魏酸使膜的拉伸强度显著增加。
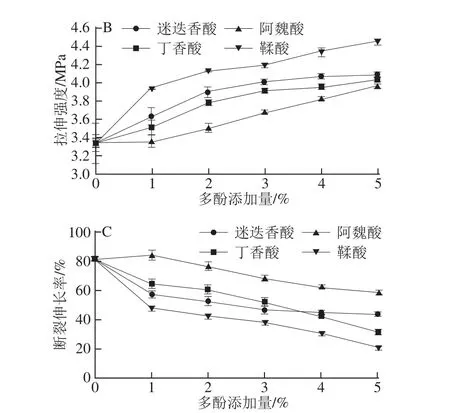
图3 添加多酚对鲤鱼肌原纤维蛋白膜弹性(A)、拉伸强度(BB)和断裂伸长率(CC)的影响Fig.3 Young’s modulus(A),tensile properties(B)and elongation(C)at break of fish myofibrillar protein films incorporated with various phenolic compounds
2.4添加多酚对鲤鱼肌原纤维蛋白膜颜色值的影响
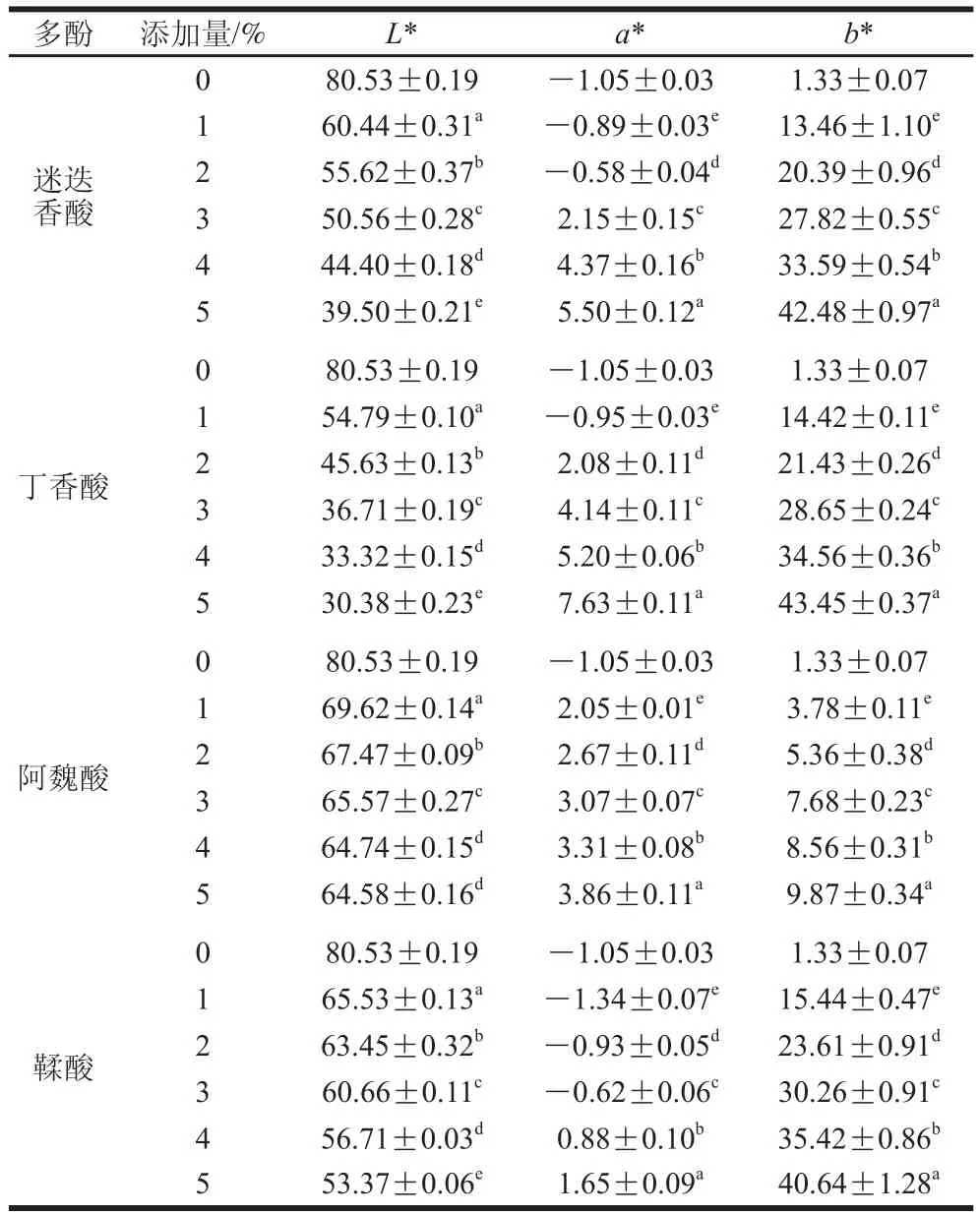
表1 添加多酚对鲤鱼肌原纤维蛋白膜颜色的影响Table 1 Color parameters of fish myofibrillar protein films added with various phenolic compounds at different concentrations
不同添加量多酚化合物对鲤鱼肌原纤维蛋白膜颜色值的影响如表1所示。随着多酚添加量的增加,膜颜色强度增加。与对照组相比,添加1%~5%多酚化合物使膜的L*值降低,a*值和b*值升高(P<0.05)。添加4%和5%阿魏酸的蛋白膜L*值差异不显著(P>0.05)。添加多酚化合物的种类和浓度极大影响了鲤鱼肌原纤维蛋白膜的颜色,这是由不同酚类化合物的色素含量、类型及化学组成不同引起的。Rattaya等[9]报道了向胶原蛋白膜中添加海藻提取物引起膜颜色的变化是由于海藻提取物中色素的影响。Nuthong等[28]报道了添加氧化咖啡酸使猪血浆蛋白膜的b*值增加。
2.5添加多酚对鲤鱼肌原纤维蛋白膜透光率的影响

表2 添加多酚对鲤鱼肌原纤维蛋白膜透光率的影响Table 2 Light transmittance of fish myofibrillar protein films added with various phenolic compounds at different concentrations %
添加多酚对鲤鱼肌原纤维蛋白膜紫外光和可见光透光率的影响如表2所示。在200~280 nm波长范围内,添加不同多酚化合物均降低了膜的紫外光透过率。多酚添加量较高的蛋白膜具有较低的紫外光透过率。由于紫外光可使食品产生有害变化特别是脂质氧化,因此膜透光率的降低对食品保藏是有利的。在可见光范围(350~800 nm)内,对照膜的透光率为80%~90%,添加多酚化合物导致膜的透光率降低。膜的光学特性是膜的重要属性,影响产品的外观、适销性及应用性[5],透明度高的可食性膜在食品包装系统中具有较高的应用性和可接受性。随着多酚化合物添加量的增加,膜的可见光透过率降低。这是由于较高浓度的多酚化合物具有较高的阻光性,导致膜在可见光范围内具有有限的透光率。多酚对膜可见光透过性的影响取决于多酚的种类、多酚在膜基质中的含量和分布,具有不同透光率的膜基质形态亦不同。
3 结 论
添加多酚化合物可有效加强鲤鱼肌原纤维蛋白的交联或相互作用,改善鲤鱼肌原纤维蛋白膜的性能,提高膜的硬度和强度。由于鞣酸具有较高的蛋白交联效率,添加鞣酸的膜具有较高的拉伸强度。添加多酚化合物可对膜的颜色和透光率产生影响,在紫外和可见光范围内,添加多酚化合物增加了膜的阻光性,有利于防止包装食品的脂质氧化。因此可通过选择性添加酚类化合物改善鲤鱼肌原纤维蛋白膜的物理和机械特性。
参考文献:
[1]SHAH A A,HASAN F,HAMEED A,et al.Biological degradation of plastics:a comprehensive review[J].Biotechnology Advances,2008,26(3):246-265.DOI:10.1016/j.biotechadv.2007.12.005.
[2]TONGNUANCHAN P,BENJAKUL S,PRODPRAN T.Physicochemical properties,morphology and antioxidant activity of film from fish skin gelatin incorporated with root essential oils[J].Journal of Food Engineering,2013,117(3):350-360.DOI:10.1016/j.jfoodeng.2013.03.005.
[3]NUANMANO S,PRODPRAN T,BENJAKULS.Potential use of gelatin hydrolysate as plasticizer in fish myofibrillar protein film[J].Food Hydrocolloids,2015,47:61-68.DOI:10.1016/j.foodhyd.2015.01.005.
[4]马越,张超,赵晓燕,等.含花青素大豆蛋白可食膜对油脂贮藏的影响[J].中国粮油学报,2010,25(3):22-25.
[5]JONGJAREONRAK A,BENJAKUL S,VISESSANGUAN W,et al.Antioxidative activity and properties of fish skin gelatin films incorporated with BHT and α-tocopherol[J].Food Hydrocolloids,2008,22(3):449-458.DOI:10.1016/j.foodhyd.2007.01.002.
[6]PEELMANA N,RAGAERTA P,de MEULENAERB B,et al.Application of bioplastics for food packaging[J].Trends in Food Science & Technology,2013,32(2):128-141.DOI:10.1016/j.tifs.2013.06.003.
[7]CHINABHARK K,BENJAKUL S,PRODPRAN T.Effect of pH on the properties of protein-based fi lm from bigeye snapper(Priacanthus tayenus)surimi[J].Bioresource Technology,2007,98(1):221-225.DOI:10.1016/j.biortech.2005.11.012.
[8]ARTHARN A,PRODPRAN T,BENJAKUL S.Round scad proteinbased film:storage stability and its effectiveness for shelf-life extension of dried fish powder[J].LWT-Food Science and Technology,2009,42(7):1238-1244.DOI:10.1016/j.lwt.2008.08.009.
[9]RATTAYA S,BENJAKUL S,PRODPRAN T.Properties of fish skin gelatin film incorporated with seaweed extract[J].Journal of Food Engineering,2009,95(1):151-157.DOI:10.1016/j.jfoodeng.2009.04.022.
[10]ZHANG X,DO M D,CASEY P,et al.Chemical cross-linking gelatin with natural phenolic compounds as studied by high-resolutionNMR spectroscopy[J].Biomacromolecules,2010,11(4):1125-1132.DOI:10.1021/bm1001284.
[11]CAO N,FU Y H,HE J H.Mechanical properties of gelatin films cross-linked,respectively,by ferulic acid and tannin acid[J].Food Hydrocolloids,2007,21(4):575-584.DOI:10.1016/j.foodhyd.2006.07.001.
[12]STRAUSS G,GIBSON S M.Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J].Food Hydrocolloids,2004,18:81-89.DOI:10.1016/S0268-005X(03)00045-6.
[13]YANG F,ZHOU B R,ZHANG P,et al.Binding of ferulic acid to cytochrome c enhances stability of the protein at physiological pH and inhibits cytochrome c-induced apoptosis[J].Chemico-Biological Interactions,2007,170(3):231-243.DOI:10.1016/j.cbi.2007.08.005.
[14]OU S Y,WANG Y,TANG S Z,et al.Role of ferulic acid in preparing edible fi lms from soy protein isolate[J].Journal of Food Engineering,2005,70(2):205-210.DOI:10.1016/j.jfoodeng.2004.09.025.
[15]CHIN K B,GO M Y,XIONG Y L.Konjac flour improved textural and water retention properties of transglutaminase·mediated,heat induced porcine myofibrillar protein gel:effect of salt level and transglutaminase incubation[J].Meat Science,2009,8l(3):565-572.DOI:10.1016/j.meatsci.2008.10.012.
[16]INTARASIRISAWAT R,BENJAKUL S,VISESSANGUAN W.Stability of emulsion containing skipjack roe protein hydrolysate modifi ed by oxidised tannic acid[J].Food Hydrocolloids,2014,41(12):146-155.DOI:10.1016/j.foodhyd.2014.03.034.
[17]JIANG X J,ZHANG Z J,CAI H N,et al.The effect of soybean trypsin inhibitor on the degradation of myofibrillar proteins by an endogenous serine proteinase of crucian carp[J].Food Chemistry,2006,94(4):498-503.DOI:10.1016/j.foodchem.2004.11.046.
[18]SHIKU Y,HAMAGUCHI P Y,TANAKA M.Effect of pH on the preparation of edible films based on fish myofibrillar proteins[J].Fisheries Sciences,2003,69(5):1026-1032.DOI:10.1046/j.1444-2906.2003.00722.x.
[19]LERTITTIKUL W,BENJAKUL S,TANAKA M.Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J].Food Chemistry,2007,100(2):669-677.DOI:10.1016/j.foodchem.2005.09.085.
[20]BEVERIDGE T,TOMA S J,NAKAI S.Determination of SH- and SS-groups in some food proteins using Ellman’s reagent[J].Journal of Food Science,1974,39(1):49-51.
[21]YIN S,TANG C,WEN Q,et al.Properties of cast films Hemp(Cannabis sativa L.)and soy protein isolates a comparative study[J].Journal of Agricultural and Food Chemistry,2007,55:7399-7404.
[22]叶文斌,樊亮,贠汉伯.添加中草药对黄原胶-长角豆半乳甘露聚糖复合膜性质的影响[J].食品科学,2012,34(13):24-28.DOI:10.7506/spkx1002-6630-201313006.
[23]SHIKU Y,HAMAGUCHI P Y,BENJAKUL S,et al.Effect of surimi quality on properties of edible films based on Alaska Pollack[J].Food Chemistry,2004,86(4):493-499.DOI:10.1016/j.foodchem.2003.09.022.
[24]BALANGE A K,BENJAKUL S,Effect of oxidised tannic acid on the gel properties of mackerel(Rastrelliger kanaguita)mince and surimi prepared by different washing processes[J].Food Hydrocolloids,2009,23:1693-1701.DOI:10.1016/j.foodhyd.2009.01.007.
[25]LANIER T C,PARK J W.Surimi and surimi seafood[M].New York:Marcel Dekker,2000:237-265.
[26]PRIGENT S.Interactions of phenolic compounds with globular proteins and their effects on food related functional properties[D].The Netherlands:Wageningen University,2005.
[27]FRIESEN K,CHANG C,NICKERSON M.Incorporation of phenolic compounds,rutin and epicatechin,into soy protein isolate films:mechanical,barrier and cross-linking properties[J].Food Chemistry,2015,172(4):18-23.DOI:10.1016/j.foodchem.2014.08.128.
[28]NUTHONG P,BENJAKUL S,PRODPRAN T.Effect of phenolic compounds on the properties of porcine plasma protein-based film[J].Food Hydrocolloids,2009,23:736-741.DOI:10.1016/j.foodhyd.2008.08.003.
Effect of Polyphenolic Compounds on Protein Structure and Film Properties of Common Carp Myofibrillar Protein
ZHANG Huiyun,WU Jingjuan,DUAN Xu
(College of Food and Bioengineering,Henan University of Science and Technology,Luoyang 471023,China)
Abstract:The objective of this study was to investigate the effects of several polyphenolic compounds(ferullic acid,tannic acid,rosmarinic acid and syringic acid)at various concentrations(1%,2%,3%,4% and 5% based on protein)on structure and properties of fi lm from myofi brillar protein of common carp(Cyprinus carpio).Among all the investigated polyphenolic compounds,tannic acid showed the highest cross-linking capacity on myofi brillar protein as evidenced by in the lowest free amino group and sulfhydryl group contents in the fi lm-forming protein solution.The addition of polyphenolic compounds could enhance mechanical properties of the resulting films.With increasing concentration of polyphenolic compounds added,Young’s modulus(E)and tensile strength(TS)of the fi lms increased,while their elongation at break(EAB)decreased (P<0.05),suggesting stronger and stiffer fi lm structure.At the same concentration used,tannic acid could result in higher mechanical properties(elasticity and tensile strength)of the fi lm when compared with other polyphenolic compounds.The transparency and color of the film were reduced by polyphenolic compounds,depending on the type and concentration.Therefore,polyphenolic compounds can potentially be applied in inner packaging materials for high-fat foods to prevent lipid oxidation,thus prolonging the shelf-life of foods during storage.
Key words:polyphenolic compounds; myofi brillar proteins; structure; fi lm; properties
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)05-0035-06
DOI:10.7506/spkx1002-6630-201605007 10.7506/spkx1002-6630-201605007.http://www.spkx.net.cn
作者简介:张慧芸(1977—),女,副教授,博士,主要从事天然产物活性研究。E-mail:zhanghuiyun21@163.com
基金项目:河南人才培养联合基金项目(C2003)
收稿日期:2015-03-30

