白细胞介素-8对前列腺癌细胞增殖及迁移的影响
李鑫屹 杨 杨 黄校青 曹 宇 李凤英 贾琳琳 王丽敏 陈洁茹 赵晓莲 王伟群
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
白细胞介素-8对前列腺癌细胞增殖及迁移的影响
李鑫屹杨杨1黄校青曹宇2李凤英贾琳琳王丽敏陈洁茹赵晓莲王伟群
(佳木斯大学基础医学院,黑龙江佳木斯154007)
〔摘要〕目的研究白细胞介素(IL)-8及其受体在前列腺细胞系的表达及IL-8对前列腺癌细胞增殖及迁移的影响。方法免疫荧光和Western印迹技术分别检测IL-8及其受体在前列腺细胞系中的表达;利用CCK8、克隆形成、划痕实验检测IL-8对前列腺癌细胞生长和迁移的影响。结果免疫荧光和Western印迹结果显示PC-3、DU145和RWPE-1细胞中都有IL-8及其受体的表达,PC-3细胞中IL-8及其受体表达明显多于DU145和RWPE-1(P<0.05);不同浓度的外源性IL-8能促进PC-3细胞增殖,随着浓度的增加细胞增殖效应也随之增加,浓度为80 ng/ml时增殖效果最明显,但浓度超过80 ng/ml后增殖效果有所下降,浓度为80 ng/ml时与其他组差异显著(P<0.05);克隆形成和划痕实验结果显示80 ng/ml的外源性IL-8能明显促进PC-3细胞克隆形成和迁移能力(P<0.01)。结论IL-8可通过促进前列腺癌细胞生长、迁移而参与前列腺癌发生与演进过程。
〔关键词〕白细胞介素(IL)-8;前列腺癌;增殖;迁移
西方前列腺癌发病率和死亡率分别位于男性恶性肿瘤的首位和第二位〔1〕,但目前对前列腺癌的发生、发展和转移等机制尚不十分明确。白细胞介素(IL)-8是多效性细胞因子,也是趋化因子家族中的一员,其在炎症反应中起重要作用。研究表明,IL-8 也参与了肿瘤的发生、发展过程〔2,3〕。本研究讨论IL-8对前列腺癌细胞生长和迁移的作用。
1 材料与方法
1.1材料RPMI-1640培养基、胎牛血清、青-链霉素、0.25%胰蛋白酶(Gibco,美国)。人前列腺癌细胞株PC-3和DU145及永生化前列腺上皮细胞株RWPE-1(ACTT,美国),重组人IL-8(Peprotech,美国),兔抗IL-8多克隆抗体(ImmunoWay,美国),兔抗IL-8 R A/B多克隆抗体(Santa Cruz,美国),鼠抗β-actin抗体、CY3-羊抗兔IgG(中杉金桥,中国),辣根过氧化物酶标记的山羊抗鼠和山羊抗兔IgG(武汉博士德,中国)。
1.2细胞培养PC-3、DU145和RWPE-1细胞培养在RPMI-1640培养基(含10%胎牛血清、 11.1 mmol/L谷氨酰胺、100 U/ml青链霉素),细胞贴壁生长,每2~3 d更换培养液,待细胞融合度达到80%按1∶3 传代。
1.3免疫荧光将培养板中已铺好细胞的玻片用磷酸盐缓冲液(PBS)浸洗3×3 min;3.7%的多聚甲醛固定细胞15 min,PBS浸洗3×5 min;0.2% Triton X-100(PBS配制)室温通透10 min,PBS浸洗3×5 min,吸干PBS;用正常兔血清封闭液室温封闭45 min,吸去封闭液;滴加兔抗IL-8多克隆抗体(1∶200),4℃孵育过夜;次日,PBS浸洗玻片3×5 min,吸干玻片上多余液体后滴加CY3-羊抗兔IgG(1∶100),37℃孵育30 min,PBS浸洗3×5 min;滴加4'-6-二脒基-2-苯基吲哚(DAPI)避光孵育2 min以进行复染核,吸去多余的DAPI;滴加抗荧光淬灭剂,封片;激光共聚焦显微镜观察并采集图像。
1.4Western印迹检测IL-8受体A和B的表达胰酶消化10 cm培养皿中长满的细胞,并收集细胞沉淀。加入100 μl蛋白裂解液(含10%蛋白酶抑制剂),4℃ 1.5 ×104r/min 离心15 min,取上清,聚氰基丙烯酸正丁酯(BCA)法检测蛋白浓度。取30 μg蛋白样本经10%SDS-PAGE凝胶电泳后,电转移到硝酸纤维素(PVDF)膜上,5%脱脂奶粉封闭1 h,分别用β-actin(1∶500)和IL-8受体A/B抗体(1∶200)4℃孵育过夜,Tris-HCl吐温缓冲液(TBST)洗膜3×5 min,分别加入1∶5 000 辣根过氧化物酶标记的山羊抗鼠和山羊抗兔IgG,37℃孵育45 min,TBST洗膜4×10 min,电化学发光(ECL)曝光,显影。
1.5增殖实验将100 μl PC-3细胞接种于96孔板中(2×103个/孔),并于37℃含5%CO2培养箱中培养24 h。次日,加入10 μl不同浓度的IL-8(0,20,40,60,80,100 ng/ml)培养细胞,每个浓度做6个复孔,72 h后,每孔加入10 μl CCK8溶液,并于培养箱内孵育2 h。经酶标仪测得450 nm处的吸光度值。
1.6克隆形成实验将1 ml PC-3细胞铺入24孔板中(150个/孔)后。将实验分成2组,每组3孔,对照组加入正常培养基,实验组加入含IL-8(80 ng/ml)的培养基。每3 d更换相应培养基,直到培养细胞至12 d。吸去培养基,加入结晶紫溶液固定、染色细胞。自来水冲洗后,镜下计数并拍照。
1.7划痕实验检测细胞迁移将2 ml PC-3细胞接种于6孔板中后。将实验分成2组,每组3孔,对照组加入正常培养基,实验组加入含IL-8(80 ng/ml)的培养基。待细胞融合度达到80%时,用灭菌的移液吸头在培养板底部划出一条约1 mm宽的无细胞区域,PBS漂洗2次,加入相应新鲜培养基继续培养细胞24 h,倒置荧光显微镜下(×200)观察细胞迁移情况。
1.8统计学方法采用SPSS17.0统计学软件进行单因素方差分析,秩和检验。
2结果
2.1免疫荧光实验结果IL-8在前列腺癌细胞株PC-3和DU145及永生化前列腺上皮细胞株RWPE-1中均有表达(图1),PC-3最多(0.21±0.03),RWPE-1最少(0.15±0.01)。PC-3与DU145(0.17±0.01)和RWPE-1差异显著(P<0.05)。
2.2Western印迹实验结果IL-8受体A和B在PC-3、PU145和RWPE-1细胞中均有表达。IL-8受体A相对表达量分别为1.20±0.11、0.92±0.11和0.57±0.07,IL-8受体B分别为0.97±0.16、0.41±0.07和0.42±0.03。PC-3中IL-8受体A和B的表达量均多于其他两株细胞(P<0.01)。在DU145细胞中,IL-8受体A的表达量多于RWPE-1细胞(P<0.05)。见图2。
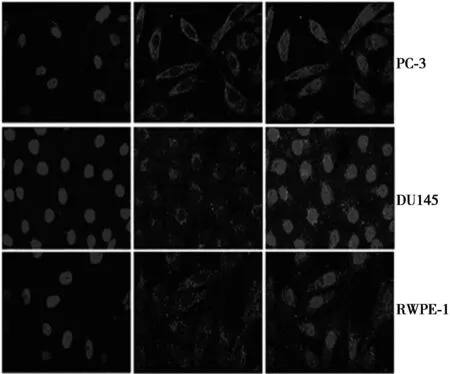
图1 前列腺细胞株中IL-8的表达(×400)
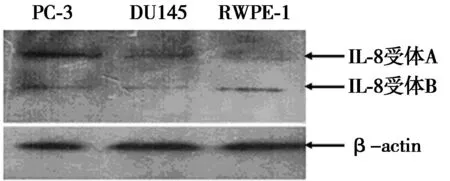
图2 IL-8受体在不同前列腺细胞株的表达情况
2.3CCK8实验结果72 h后,0、20、40、60、80、100 ng/ml亚组吸光度值分别为0.91±0.10、0.97±0.06、0.98±0.07、1.06±0.06、1.19±0.06和1.10±0.05,与0 ng/ml比较,60、80、100 ng/ml明显促进PC-3细胞增殖(P<0.05)。
2.4克隆形成实验结果细胞培养12 d后,对照组和IL-8组克隆数分别为(27.8±5.67)和(44.6±5.98),两者差异显著(P<0.01)。这表明80 ng/ml的重组人IL-8可促进PC-3细胞的克隆形成能力,见图3。
2.5迁移实验结果24 h后对照组向划痕区域迁移进的细胞数量〔(0.37±0.05)mm〕较IL-8组少〔(0.46±0.03)mm,P<0.01〕,见图4。
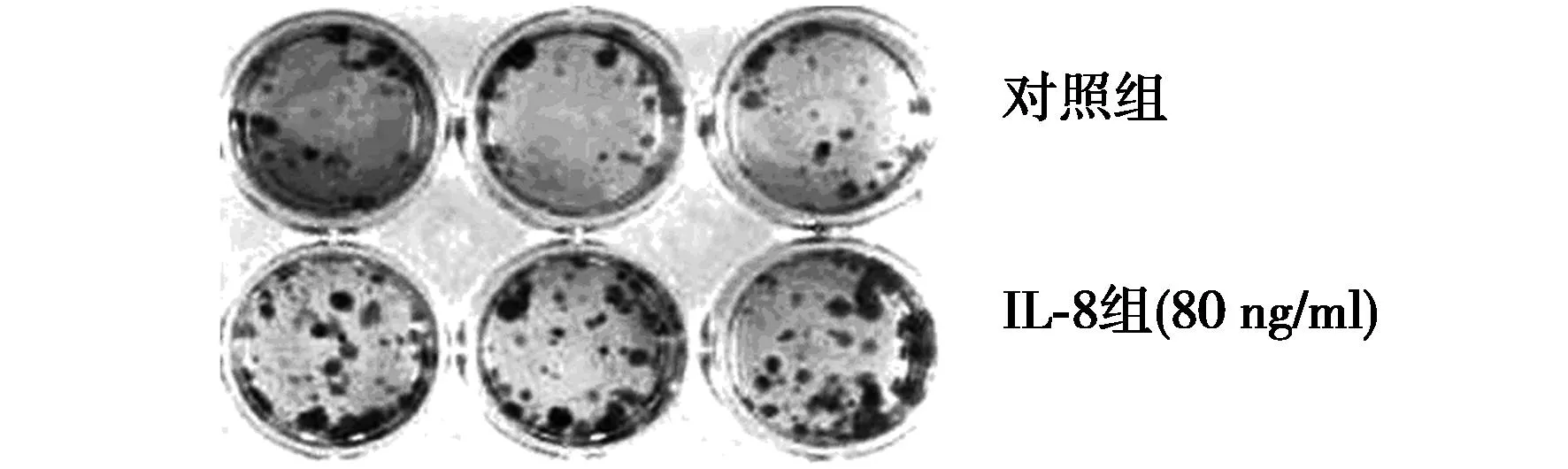
图3 重组人IL-8促进PC-3细胞的克隆形成能力

图4 重组人IL-8促进PC-3细胞的迁移
3讨论
前列腺癌已确定的发病危险因素有年龄、种族和遗传因子等〔4〕。IL-8是一种促炎性趋化因子,对白细胞等具有趋化作用〔5〕。研究表明,炎症因子在肿瘤发生发展中起到非常重要的作用〔6〕。它们是肿瘤细胞与肿瘤微环境之间的重要连接因子。IL-8可与其受体A相结合,通过G蛋白信号转导产生生物学效应,可激活下游信号分子,促进肿瘤细胞的增殖,分化和转移〔7〕。血管内皮生长因子(VEGF)家族可促使内皮细胞生长及血管生成,从而有助于肿瘤的侵袭和转移,并已经发现在肺癌脑转移中发挥一定的作用〔8〕。而IL-8可通过影响VEGF的表达,而加强肿瘤细胞的侵袭及黏附能力〔9〕。Akiba等〔10〕曾报道,IL-8在肝癌组织和细胞系中高表达,且与门脉和胆道转移密切相关。尹华〔3〕采用MTT和划痕实验证实施加一定浓度的IL-8 可明显促进NCI-157细胞增殖及迁移能力。由此可见,IL-8可参与多种恶性肿瘤的生长,转移及血管发生〔11,12〕。本文提示,IL-8的自分泌机制也可能参与前列腺癌的发生和演进过程。因此,应通过基因转染和RNA干扰正反两方面技术来开展IL-8自分泌机制研究,并明确其相关机制,从而为人类对前列腺癌发病机制的认识提供新的理论依据,也可为前列腺癌及相关肿瘤的治疗提供新的靶点。
4参考文献
1Siegel R,Ma J,Zou Z,etal.Cancer statistics 〔J〕.CA Cancer J Clin,2014;64(1):9-29.
2Center MM,Jemal A,Lortet-Tieulent J,etal.International variation in prostate cancer incidence and mortality rates 〔J〕.Eur Urol,2012;61(6):1079-92.
3尹华.IL-8对肺癌NCI-H157细胞增殖和迁移的影响〔J〕.标记免疫分析与临床,2015;22(7):682-6.
4王建业,杨泽,魏东,等.整合素α6、β-微精浆蛋白基因和染色体8q24区与前列腺癌的关联研究〔J〕.中华泌尿外科杂志,2011;32(7):471-6.
5Sadik CD,Kim ND,Luster AD.Neutrophil escascading their way to inflammation 〔J〕.Trends Immunol,2011;32(10):452-60.
6Chekhun VF.Inflammation and cancer〔J〕.Exp Oncol,2009;31(4):190.
7杨敏,傅海涛,杨再兴.IL-8及其受体CXCR1,CXCR2与肝癌关系的研究进展〔J〕.临床检验杂志,2013;31(12):926-8.
8刘懿,陈军.肺癌脑转移的治疗进展〔J〕.中国肺癌杂志,2013;16(7):382-6.
9殷娟,于超,杨竹.川芎嗪抑制IL-8诱导人卵巢癌SKOV3细胞迁移的作用〔J〕.重庆医科大学学报,2011;36(4):401-4.
10Akiba J,Yano H,Ogaswara S,etal.Expression and function of interleukin-8 in human hepatocellular carcinoma〔J〕.Int J Oncol,2001;18(2):257-64.
11孙晓明,罗南萍.IL-8在不同肿瘤患者血清中的表达〔J〕.放射免疫学杂志,2010;23(3):245-7.
12Farah H,Jayson W,Raida A,etal.The expression of IL-8 and IL-8 receptors in pancreatic adenocarcinomas and pancreatic neuroendocrine tumours〔J〕.Cytokine,2010;49(1):134-40.
〔2015-02-15修回〕
(编辑苑云杰)
The effect of IL-8 on prostate cancer cell proliferation and migration
LI Xin-Qi,YANG Yang,HUANG Xiao-Qing,etal.
Basic Medical College of Jimusi University,Jiamusi 154007,Heilongjiang,China
【Abstract】ObjectiveTo study the expression of interleukin(IL)-8 and its receptor in prostate cancer cell lines and the effects of IL-8 on prostate cancer cell proliferation and migration.MethodsThe expression of IL-8 and its receptor were detected by immunofluorescence and Western blot,respectively;the proliferation and immigration were detected by CCK8,clone formation and scratch test.ResultsImmunofluorescence and Western blot showed that PC-3,DU145 and RWPE-1 expressed IL-8 and its receptor,the expression of IL-8 and its receptor in PC-3 cells were more than those of both DU145 and RWPE-1(P<0.05).Different concentrations of IL-8 promoted proliferation of PC-3 cells,and the effect of proliferation increased gradually with the increase of concentration,the effect of proliferation was most obvious when the concentration was 80 ng/ml,however,the effect of proliferation would fall after concentration being more than 80 ng/ml,there was significant difference between 80 ng/ml of group and either of other groups(P<0.05),the results of clone formation and scratches showed that 80 ng/ml of exogenous IL-8 obviously promoted clone formation and migration ability of PC-3 cells(P<0.01).ConclusionsIL-8 can participate in the occurrence and evolution of prostate cancer by promoting the growth and migration of prostate cancer cells.
【Key words】IL-8;Prostate cancer;Proliferation;Migration
〔中图分类号〕R737
〔文献标识码〕A
〔文章编号〕1005-9202(2016)06-1294-03;
doi:10.3969/j.issn.1005-9202.2016.06.006
通讯作者:王伟群(1974-),男,硕士生导师,副教授,主要从事肿瘤病理生理学研究。
基金项目:国家自然科学基金面上资助项目(No.81272854);黑龙江省自然科学基金资助项目(No.D201129);黑龙江省大学生创新创业训练计划项目(No.201410222036);佳木斯大学研究生科技创新项目(No.LZR2014-004);佳木斯大学校长创新创业基金项目(No.xzyf 2014-12)
1佳木斯大学临床医学院2佳木斯大学第一附属医院
赵晓莲(1967-),女,硕士生导师,教授,主要从事泌尿生理学研究。
第一作者:李鑫屹(1989-),女,在读硕士,主要从事生殖系统肿瘤病理生理学研究。

