辛伐他汀对DH豚鼠自发性膝骨性关节炎关节软骨退变的影响
赵海勇 马 娜 田发明
(唐山市工人医院骨外科,河北 唐山 063000)
辛伐他汀对DH豚鼠自发性膝骨性关节炎关节软骨退变的影响
赵海勇马娜田发明1
(唐山市工人医院骨外科,河北唐山063000)
〔摘要〕目的探讨辛伐他汀灌胃干预对DH豚鼠原发性膝骨关节炎(OA)关节软骨退变的影响。方法3个月龄DH豚鼠18只,6只在实验开始时处死(基线组),其余12只分别给予辛伐他汀(20 mg·kg(-1)·d(-1))(辛伐他汀组)或生理盐水灌胃(对照组),6个月后处死所有动物。留取静脉血备行酶联免疫吸附(ELISA)检测分析白细胞介素(IL)-1β的表达;取膝关节股骨行常规石蜡包埋,经Van Gieson(VG)染色及国际骨性关节炎研究协会(OARSI)评分,评价软骨退变情况,免疫组化染色检测IL-1β的表达;对胫骨软骨下骨行Micro-CT分析骨密度(BMD)、相对体积(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)及结构模型指数(SMI)。结果①血清学指标:辛伐他汀组和对照组IL-1β水平显著高于基线组,辛伐他汀组显著低于对照组(P<0.05);②关节软骨组织学评价:与基线组相比,对照组关节软骨出现退变表现,OARSI评分显著升高(P<0.05),辛伐他汀组与对照组无显著差别;③免疫组化染色结果提示辛伐他汀组和对照组关节软骨IL-1β的表达水平显著高于基线组,但辛伐他汀组和对照组无显著区别;④软骨下骨Micro CT检测结果:辛伐他汀组及对照软骨下骨BMD、Tb.Th显著高于基线组,SMI显著低于基线组(P<0.05),辛伐他汀组与对照组无显著差别。结论辛伐他汀系统性干预可降低DH豚鼠血IL-1β水平,但不能抑制其膝关节软骨自发性退变及软骨下骨骨量和微观结构的改变。
〔关键词〕骨性关节炎;辛伐他汀;白细胞介素-1β
原发性骨性关节炎(OA)是中老年最常见的骨关节疾病,据世界卫生组织统计,65岁以上女性人群OA的发病率为70%,男性为60%〔1,2〕。45岁以上人群OA发病率为26.6%,其中膝关节OA发病率为13.8%,在所有关节中最高〔3~5〕。研究提示辛伐他汀(SIM)体外干预可抑制白细胞介素(IL)-1诱发的软骨细胞衰老和炎症反应〔6〕,体内干预关节腔内注射可以部分阻止关节失稳诱发的大鼠继发性关节炎进程〔7〕。通过系统给药观察SIM对原发性OA模型的干预效果目前尚未见报道,本研究分析SIM对DH豚鼠OA进程的干预效果及可能机制。
1 材料与方法
1.1试剂与药品SIM(浙江瑞邦药业,国药准字H20000007),大鼠IL-1b ELISA试剂盒(上海鑫乐生物,xl-Er0187),Van Gieson染液(上海哈灵生物科技有限公司),IL-1β多克隆抗体(武汉博士德生物技术有限公司,BA2782)。
1.2实验动物及处理18只3个月龄SPF级雌性DH豚鼠(北京维通利华实验动物技术有限公司,SCXK京,2012-0001),饲养于河北联合大学实验动物中心屏障实验室,于室温20℃自然光照条件下自由饮食水。随机分为3组,每组6只,基线对照组(BL组)于实验开始时处死,其余两组分别给予SIM(SIM组,20 mg·kg-1·d-1)或生理盐水(对照组)灌胃干预,9个月龄时处死所有动物。处死前留取静脉血,备行ELISA检测。取膝关节胫骨备行Micro-CT分析,股骨制备常规石蜡切片,备行Van Gieson(VG)染色。
1.3ELISA检测血清IL-1水平用ELISA法检测血清IL-1β的含量,酶标仪450 nm处读取OD值。以标准品浓度为横坐标,以OD值为纵坐标,绘制标准曲线,通过标准曲线及各样本的OD值,计算IL-1β量。
1.4VG 染色及组织学评分膝关节标本经10%甲醛固定,15%乙二胺四乙酸(EDTA)-2Na脱钙3个月,针刺确定标本软化后,石蜡包埋制备5 μm厚度切片,行VG染色,光镜下观察关节软骨退变情况。采用国际骨性关节炎研究协会(OARSI)评分标准进行组织学评分。主要通过观察关节软骨结构(0~8分)、软骨基质着色(0~6分)、软骨细胞分布及数量(0~3分)、潮线是否完整(0~1)及有否骨赘形成(0~3分)等5个方面对软骨退变程度进行量化分析〔8〕,退变越严重分值越高,每组6个样本分别由两位经过专业培训的实验人员遵循双盲原则进行评分,然后计算出每个样本的均值。
1.5免疫组织化学染色观察IL-1β在软骨组织中的表达石蜡切片经60℃烤箱烘烤30 min,二甲苯脱蜡,梯度酒精水化,3%H2O2室温下孵育6~8 min,阻断内源性过氧化物酶活性,磷酸盐缓冲液(PBS)冲洗,滴加IL-1β一抗试剂(20 μl,稀释比例1∶100),置于4℃冰箱中12 h过夜;32℃烤箱中复温20 min,PBS冲洗后每张切片滴加20 μl酶二抗聚合物,室温下孵育30~40 min;PBS洗后滴加30 μl二氨基联苯胺(DAB)显色,显微镜下观察,适时终止;苏木素复染8 min,0.5%盐酸酒精分化10 s,自来水冲洗30 min返蓝;切片经梯度酒精脱水,二甲苯透明,中性树胶封片。参照以往研究〔9〕,对IL-1β在关节软骨中的表达进行半定量评分,分别按照阳性细胞表达比例高低(由低到高0~5分)及表达强度(由低到高0~3分)评分,两者之和为最终得分。样本量及双盲原则同OARSI组织学评分。
1.6软骨下骨Micro-CT分析应用SkyScan 1076 Micro-CT,在40 kVp及250 μA的条件下对胫骨软骨下骨进行扫描检测,收集数据,并利用Micro-CT配套软件对扫描图像进行三维重建及结果分析。兴趣区为软骨下骨骨板下0.5~4 mm,直径为9 μm的圆柱体(皮质骨内侧的松质骨)。主要检测指标包括:骨密度(BMD)、骨小梁相对体积(BV/TV)、骨小梁厚度(Tb.Th)、结构模型指数(SMI)。
1.7统计学方法应用SPSS19.0统计软件进行单因素方差分析及LSD-t检验。
2结果
2.1血清IL-1β水平SIM组〔(122.17±14.81)pg/ml〕和对照组IL-1β水平〔(138.31±9.39)pg/ml〕显著高于BL组〔(103.83±11.09)pg/ml〕,SIM组显著低于对照组(P<0.05)。
2.2膝关节软骨大体观察BL组多数标本关节软骨面光滑,少数标本关节面稍显粗糙,欠光滑,部分区域光泽暗淡;对照组关节面失去光泽,关节面粗糙,有破坏,关节液浑浊、量多,关节面出现破溃;SIM组与对照组无明显差异。
2.3组织学观察及评分BL组软骨表面完整,软骨基质染色较均一,个别标本存在局部着色较浅,软骨细胞结构正常,层次清楚,分布规则,个别标本软骨细胞减少,排列紊乱;对照组关节表面较粗糙,个别标本有溃疡形成,软骨细胞排列紊乱,基质着色不均一,纤维化及蛋白多糖丢失较前增加,并浸润至深层,软骨细胞克隆明显呈细胞巢状。与BL组相比,对照组和SIM组IL-1β阳性着色细胞较多,着色更深。见图1。
2.4OARSI评分结果与BL组(1.58±0.97)相比,对照组关节软骨出现退变表现,OARSI评分(6.50±1.79)显著升高(P<0.05),SIM组(5.83±1.99)与对照组比较无显著差别。
2.5免疫组化染色结果IL-1β在软骨细胞内及细胞外基质均有阳性表达,表层软骨较深层软骨表达更明显,见图2。评分结果提示SIM组和对照组关节软骨IL-1β的表达水平(4.58±0.97、4.83±0.88)显著高于BL组(2.33±0.98),但SIM组和对照组无显著区别。
2.6micro-CT分析结果见表1。SIM组及对照组软骨下骨BMD、Tb.Th显著高于BL组,SMI显著低于BL组(P<0.05),SIM组与对照组无显著差异。BV/TV三组间无显著差异。
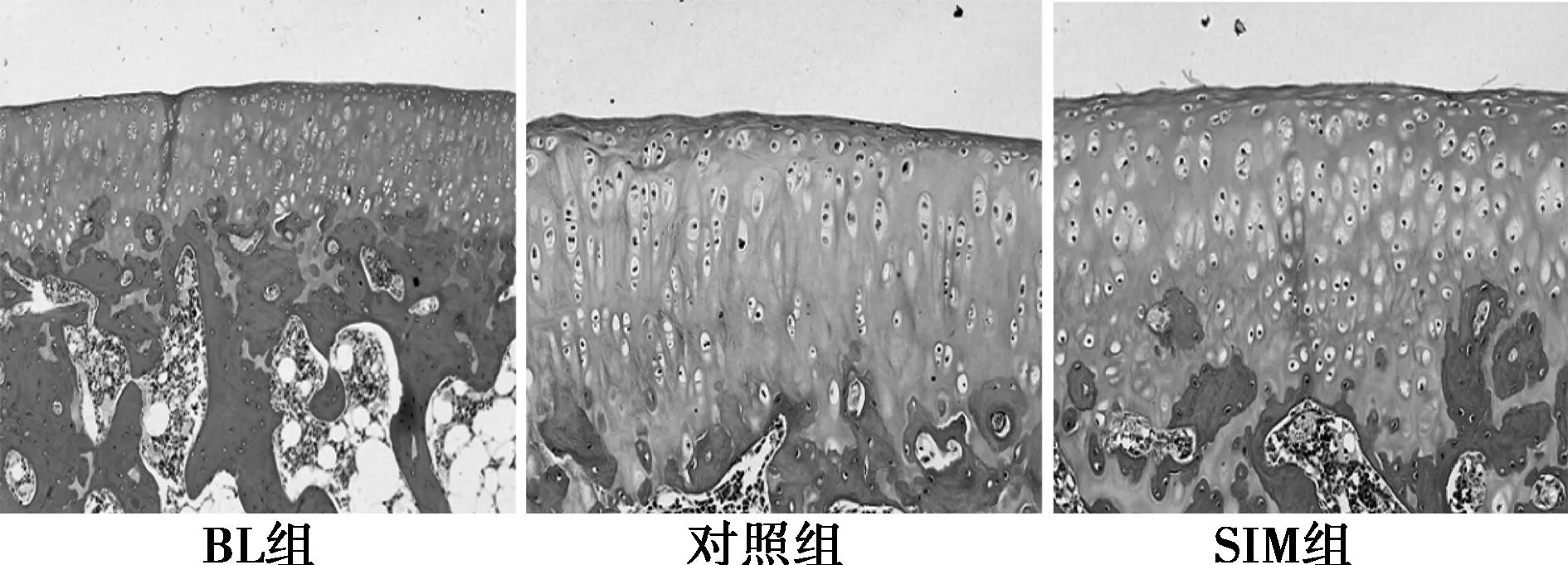
图1 VG染色结果(×200)

图2 免疫组化染色及评分结果(×200)

指标BL组对照组SIM组BMD(mg/cm3)631.8±40.9707.2±30.71)714.5±28.61)BV/TV(%)41.8±2.842.2±3.742.6±3.6Tb.Th(μm)98.7±9.1114.3±7.81)113.2±11.21)SMI(μm)1.43±0.330.97±0.281)1.03±0.261)
与BL组比较:1)P<0.05
3讨论
DH豚鼠作为原发性OA模型,相关实验表明,软骨的降解与人类的发展非常相似,在自然病程、诱发因素、治疗干预方面能很好地模拟发病过程〔10,11〕。以往研究表明,该模型大致在3~4个月龄发生OA病理改变〔12,13〕,因此本研究选取3个月龄动物作为基线组,发现3个月龄DH豚鼠多数标本无明显OA表现,部分标本出现细胞减少,基质丢失现象。与3个月龄相比,9个月龄DH豚鼠发生明显的OA病理改变,关节面粗糙不平,基质减少,细胞丢失,克隆多见,OARSI评分显著升高。
研究证实,关节滑液中IL-1β的含量与骨关节炎病情发展呈正相关,IL-1通过生产一氧化氮下调细胞外基质的合成和上调基质金属蛋白酶(MMP)的合成引起软骨分解〔14~16〕。本研究结果发现,随着OA发展,IL-1β在DH豚鼠外周血和关节软骨中的表达水平均显著升高。
软骨下骨的组织结构的生物力学特性的变化是OA病理改变之一。本次研究采用Micro-CT分析发现DH豚鼠OA进展过程中,BMD与Tb.Th增加,SMI降低。这些改变一方面可能与豚鼠正常生长有关,另一方面,可能是OA进展的始动因素或反馈效应之一,这一问题的阐明尚有待深入研究。
SIM作为降脂类药物,因表现出包括保护软骨细胞等多种降脂之外的作用潜能而备受关注。Lazzerini等〔17〕证实SIM可以抑制IL-1β诱导的人软骨细胞炎症反应中MMP-3的高表达,Dombrecht等〔18〕则发现SIM可以剂量依赖得形式降低IL-1β及肿瘤坏死因子(TNF)-α刺激的人软骨细胞IL-6及IL-8的水平。Yudoh等〔6〕提示SIM体外干预可抑制IL-1诱发的软骨细胞的衰老和炎症反应,Aktas等〔7〕发现关节腔内注射SIM可以通过抑制MMP-3水平部分阻止关节失稳诱发的大鼠继发性关节炎进程。本研究发现,SIM虽然可以降低外周血IL-1β水平,但对DH豚鼠OA进展无显著影响,对软骨下骨的作用亦不明显。体外或局部干预与系统性给药干预效果的区别可能主要源于口服SIM经过肝脏代谢到达关节软骨局部组织的血药浓度更低,这一点在关于SIM抗骨质疏松(OP)的相关研究中亦有述及〔19,20〕。因此,靶向性更强的SIM可能更具备应用前景。
4参考文献
1Forestier R,Francon A,Briole V,etal.Prevalence of generalized osteoarthritis in a population with knee osteoarthritis〔J〕.Joint Bone Spine,2011;78(3):275-8.
2Sarzi-Puttini P,Cimmino MA,Scarpa R,etal.Osteoarthritis:an overview of the disease and its treatment strategies〔J〕.Semin Arthritis Rheum,2005;35(1 Suppl 1):1-10.
3Turkiewicz A,Petersson IF,Björk J,etal.Current and future impact of osteoarthritis on health care:a population-based study with projections to year 2032〔J〕.Osteoarthritis Cartilage,2014;22(11):1826-32.
4Tehrani-Banihashemi A,Davatchi F,Jamshidi AR,etal.Prevalence of osteoarthritis in rural areas of Iran:a WHO-ILAR COPCORD study〔J〕.Int J Rheum Dis,2014;17(4):384-8.
5Mobasheri A.The future of osteoarthritis therapeutics:targeted pharmacological therapy〔J〕.Curr Rheumatol Rep,2013;15(10):364.
6Yudoh K,Karasawa R.Statin prevents chondrocyte aging and degeneration of articular cartilage in osteoarthritis(OA)〔J〕.Aging(Albany NY),2010;2(12):990-8.
7Aktas E,Sener E,Gocun PU.Mechanically induced experimental knee osteoarthritis benefits from anti-inflammatory and immunomodulatory properties of simvastatin via inhibition of matrix metalloproteinase-3〔J〕.J Orthop Traumatol,2011;12(3):145-51.
8Kraus VB,Huebner JL,DeGroot J,etal.The OARSI histopathology initiative recommendations for histological assessments of osteoarthritis in the guinea pig〔J〕.Osteoarthritis Cartilage,2010;18(3):S35-52.
9Santangelo KS,Pieczarka EM,Nuovo GJ,etal.Temporal expression and tissue distribution of interleukin-1β in two stains of guinea pigs with varying propensity for spontaneous knee osteoarthritis〔J〕.Osteoarthritis Cartilage,2011;19(4):439-48.
10Jimenez PA,Glasson SS,Trubetskoy OV,etal.Spontaneous osteoarthritis in Dunkin Hartley guinea pigs:histologic,radiologic and biochemical changes〔J〕.Lab Anim Sci,1997;47(6):598-601.
11Wang T,Wen CY,Yan CH,etal.Spatial and temporal changes of subchondral bone proceed to microscopic articular cartilage degeneration in guinea pigs with spontaneous osteoarthritis〔J〕.Osteoarthritis Cartilage,2013;21(4):574-81.
12Bendele AM,White SL,Hulman JF.Osteoarthrosis in guinea pigs:histopathologic and scanning electron microscopic features〔J〕.Lab Anim Sci,1989;39(2):115-21.
13Yan JY,Tian FM,Wang WY,etal.Parathyroid hormone(1-34)prevents cartilage degradation and preserves subchondral bone micro-architecture in guinea pigs with spontaneous osteoarthritis〔J〕.Osteoarthritis Cartilage,2014;22(11):1869-77.
14HedbomE,Hauselmann HJ.Molecular aspects of pathogenesis in osteoarthritis:the role of inflammation〔J〕.Cell Mol Life Sci,2002;59(1):45-53.
15Kobayashi M,Squire GR,Mousa A,etal.Role of interleukin-l andtumor necrosis factor alpha in matrix degradation of human osteoarthritic cartilage〔J〕.Arthritis Rheum,2005;52(1):128-35.
16何耀华,翁习生,邱贵兴.白细胞介素1对肿瘤坏死因子α在膝关节原发性骨关节病发病中的作用〔J〕.中华骨科杂志,1999;19(5):281-4.
17Lazzerini PE,Capecchi PL,Nerucci F,etal.Simvastatin reduces MMP-3 level in interleukin 1b stimulated human chondrocyte culture〔J〕.Ann Rheum Dis,2004;63(7):867-9.
18Dombrecht EJ,Van Offel JF,Bridts CH,etal.Influence of simvastatin on the production of pro-inflammatory cytokines and nitric oxide by activated human chondrocytes〔J〕.Clin Exp Rheumatol,2007;25(4):534-9.
19Maritz FJ,Conradie MM,Hulley PA,etal.Effect of statins on bone mineral density and bone histomorphometry in rodents〔J〕.Arterioscler Thromb Vasc Biol,2001;21(10):1636-41.
20Von SD,Fish S,Yahalom D,etal.Does simvastatin stimulate bone formation in vivo〔J〕?BMC Musculoskelet Disord,2003;4:8.
〔2014-12-19修回〕
(编辑苑云杰)
〔中图分类号〕R684.3
〔文献标识码〕A
〔文章编号〕1005-9202(2016)06-1291-03;
doi:10.3969/j.issn.1005-9202.2016.06.005
通讯作者:田发明(1980-),男,博士,副教授,硕士生导师,主要从事骨质疏松与骨关节退变研究。
基金项目:河北省高等学校科学研究计划(No.QN20131007);河北省自然科学基金(No.H2013209255)
1华北理工大学医学实验研究中心
第一作者:赵海勇(1975-),男,硕士,主要从事骨关节退行性疾病研究。

