T肽对树突细胞的协同作用及其对肾癌细胞抗肿瘤效应和免疫微环境的影响
杨旭初 王怀璋 张新峰 刘怀民
(郑州大学附属肿瘤医院 河南省肿瘤医院中西医结合肿瘤内科,河南 郑州 450008)
T肽对树突细胞的协同作用及其对肾癌细胞抗肿瘤效应和免疫微环境的影响
杨旭初王怀璋张新峰刘怀民
(郑州大学附属肿瘤医院河南省肿瘤医院中西医结合肿瘤内科,河南郑州450008)
〔摘要〕目的探究T肽对树突细胞(DC)的协同作用及其对肾癌细胞的抗肿瘤效应和免疫微环境的影响。方法(1)将人DC的培养皿分为3组:A组人DC的培养皿加入生理盐水100 μl,B组人DC的培养皿加入T肽50 μg/100 μl,C组人DC的培养皿加入脂多糖(LPS)50 μg/100 μl;使用流式细胞仪检测DC成熟度,并观察DC表面共刺激分子表达。(2)将人DC的培养皿分为两组:D组人DC的培养皿加入生理盐水100 μl,F组人DC的培养皿加入T肽50 μg/100 μl;观察人DC分泌IL-12b的情况。(3)将人肾癌细胞的培养皿分为2组:E组人肾癌细胞的培养皿加入生理盐水100 μl,F组人肾癌细胞加入人DC悬液100 μl;D组人肾癌细胞加入T肽50 μg/ 100 μl和人DC悬液100 μl;观察T肽协同DC对肾癌细胞的凋亡率,并且检测趋化因子CCL2、CCL5、CCL20、CCL22和CCL27的表达。结果T肽促进DC的成熟,促进其表面共刺激分子表达水平上调;T肽可促进DC分泌IL-12b; T肽联合DC组对肿瘤细胞的抑制作用最强,差异有统计学意意义(P<0.05);DC组和T肽联合DC组对肾癌细胞免疫微环境的影响明显,而且T肽联合DC组对肾癌细胞免疫微环境的影响最明显(P<0.05)。结论T肽对DC具有协同作用,且可增强DC的抗肿瘤效应和对免疫微环境的影响。
〔关键词〕T肽;树突细胞;肾癌肿瘤细胞株;杀灭效果;微环境
T肽是一种适用于多种晚期恶性实体瘤术后使用的抗肿瘤药物,特点是以提高肿瘤患者自身免疫机能来达到抗肿瘤的目的,是一个高效、低毒、广谱、药物费用为广大患者可接受的创新型抗肿瘤药物〔1,2〕。树突细胞(DC)注入体内后可以刺激体内的肿瘤杀伤性淋巴细胞增殖,发挥肿瘤杀伤作用〔3〕。在临床开展的肿瘤抗原致敏DC、荷载肿瘤抗原DC诱导的肿瘤特异性细胞毒T细胞的免疫疗法治疗肾癌,已经获得中位生存期延长的良好疗效〔4,5〕。在对肾癌治疗中出现全身转移的患者进行免疫治疗后,亦获得了3年以上生存和全身多处转移灶消退的疗效。尽管如此,并非所有的患者均能获得良好疗效。本文探究T肽对DC的协同作用及其对肾癌细胞的抗肿瘤效应和免疫微环境的影响。
1资料与方法
1.1实验资料T肽纯品及人DC悬液(北京,解放军总医院多肽实验室);人肾癌细胞株(美国ATCC公司);FACSArill型高速分选流式细胞仪(美国 BD公司);Freedom EVO 75 全自动酶联免疫吸附分析仪(瑞士Tecan公司)。
1.2人外周血DC的培养新鲜外周血50 ml经淋巴分离液梯度离心,取界面层单个核细胞,用PRMI 1640培养液悬浮细胞,3 000 r/min离心15 min(r=10 cm),洗涤细胞3次,贴壁2 h后,贴壁细胞加入GM-CSF 1 000U/ml和IL-4 100 U/ml,每3 d换液1次。
1.3肿瘤细胞裂解物的制备离心收集肿瘤细胞,沉淀利用PBS洗2次后,溶于1 ml PRMI 1640,经超声波粉碎后,至倒置显微镜观察到95%细胞破碎、溶解,将匀浆倒入离心管中,100 000 r/min超速离心90 min(r=15 cm),吸取上清即为肿瘤细胞裂解物,-20℃保存备用。
1.4DC抗原负载将肿瘤细胞裂解物作为肿瘤抗原,在DC培养的第5天加入肿瘤细胞裂解物20 μg负载1×106DC,于第8天收集的悬浮细胞即为负载后的成熟DC,流式细胞仪检测DC细胞的免疫表型。
1.5研究方案(1)将人DC的培养皿分为3组,生理盐水组:人DC的培养皿加入生理盐水100 μl;脂多糖(LPS)组:培养皿中加入LPS 50 μg/100 μl;T肽组:培养皿中加入T肽50 μg/100 μl。使用流式细胞仪检测DC成熟度,并观察DC表面共刺激分子和白细胞介素(IL)-12的表达;在DC培养的第6、9和12 天,取少许各组上清液,用ELISA方法测各组血清中IL-12,步骤参照 IL-12检测盒说明书。(2)将人肾癌细胞的培养皿分为3组,空白对照组:人肾癌细胞的培养皿加入生理盐水100 μl;DC组:人肾癌细胞加入人DC悬液100 μl;协同治疗组人肾癌细胞加入T肽50 μg/100 μl和人DC悬液100 μl。使用高速分选流式细胞仪观察T肽协同DC对肾癌细胞的凋亡率,并且通过ELISA对常见趋化因子CCL2、CCL5、CCL20、CCL22和CCL27在肿瘤微环境中的表达进行检测,分析其肿瘤细胞免疫微环境的变化趋势。
1.6统计学处理采用SPSS19.0软件进行χ2及方差分析。
2结果
2.1T肽对DC成熟度和表面共刺激分子表达的影响T肽促进人DC的成熟,促进其表面共刺激分子(CD80、CD11c)表达水平上调(表1)。
2.2T肽对DC分泌IL-12b的影响T肽可促进人DC分泌IL-12b,有助于杀伤肿瘤细胞(表2)。
2.3T肽协同DC对肾癌细胞的抗肿瘤效应DC组和T肽联合DC组对肿瘤细胞的抑制作用明显,而且T肽联合DC组对肿瘤细胞的抑制作用最强(P<0.05)(表3)。

表1 T肽对DC成熟度和表面共刺激分子表达的

表2 T肽对DC分泌IL-12b的影响(n=25,荧光强度,
2.4T肽协同DC对肾癌细胞免疫微环境的影响DC组和 T肽联合DC组对肾癌细胞免疫微环境的影响明显,而且T肽联合DC组对肾癌细胞免疫微环境的影响最明显(P<0.05)(表4)。

表3 T肽协同DC对肾癌细胞凋亡率的影响
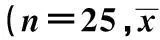
表4 T肽协同DC对肾癌细胞免疫微环境的影响±s)
3讨论
由于肿瘤抗原性较弱,患者 DC 可能存在低能或失能,因此往往难以激发出自身强有力的肿瘤特异性免疫。如何在促进 DC 摄取、消化和递呈抗原方面优化条件,制备出优良的 DC 疫苗以打破肿瘤免疫耐受,是增强肿瘤特异性免疫能力的重要途径之一。目前,DC负载抗原后常以肿瘤坏死因子(TNF)-α作为促成熟剂,但需要探索效率更高的促进 DC 成熟及活化的制剂。促吞噬素(Tuftsin) 是一种由人体脾脏分泌的多肽类物质,通过与细胞表面的特定受体结合,可促进吞噬细胞的吞噬作用来达到杀伤肿瘤的效果,但对于 DC临床 的作用尚不明确,有待进一步的研究。
T肽是以天然四肽Tuftsin为母体进行结构改造获得的一种新衍生物,它不仅保留了Tuftsin的促吞噬和抗肿瘤的生物活性,而且大大提高了抗酶解能力,延长了体内半衰期〔6,7〕。T肽是一种适用于多种晚期恶性实体瘤术后使用的抗肿瘤药物〔8~10〕。T肽还是DC的激活剂,可促进DC的成熟,其表面共刺激分子表达水平更高,可能增强DC的抗原递呈功能。医药领域中还未曾有肽类及免疫增强剂成为临床治疗肿瘤的药物,T肽有望突破这一局限成为第一个治疗恶性肿瘤的多肽类药物。T肽可以显著增强 DC 的吞噬功能,有利于 DC 功能的表达,分泌更多的正向免疫调节因子;肿瘤抗原多肽联合TNF-α、T肽致敏DC诱导的CTL在体外的杀肿瘤活性显著优于其余各组;肿瘤抗原多肽联合TNF-α、T肽致敏DC诱导的CTL治疗荷人结肠癌裸鼠有显著疗效,相对于现在临床应用的DC 治疗方法抑制肿瘤生长的效果更好。
肿瘤细胞无法被T细胞识别、杀伤是由于荷瘤宿主的DC功能有缺陷,无法有效提呈肿瘤抗原所致,肿瘤患者存在DC数量减少及功能缺陷的特点〔11,12〕。肿瘤患者外周血DC的MHC-Ⅱ类分子表达水平比正常对照组明显下降。因此,MHC-Ⅱ类分子及某些共刺激分子的低表达可能是DC无法有效激发细胞毒性T淋巴细胞反应的原因。免疫激活剂处理可提高肿瘤的免疫原性,进而增强肿瘤组织负载的DC抗肿瘤免疫效应。本研究发现,T肽可促进DC的成熟,其表面共刺激分子表达水平更高,可能增强DC的抗原递呈功能。同时,T肽可促进DC分泌IL-12b,有助于杀伤肿瘤细胞。T肽促进DC的成熟,其表面共刺激分子表达水平更高。
本研究发现,DC组和 T肽联合DC组对肿瘤细胞的抑制作用明显,而且T肽联合DC组对肿瘤细胞的抑制作用最强。此外,DC组和T肽联合DC组对肾癌细胞免疫微环境的影响明显,而且T肽联合DC组对肾癌细胞免疫微环境的影响最明显。
综上所述,本实验结果说明,T肽对DC具有协同作用,且可增强DC的抗肿瘤效应和对免疫微环境的影响,即T肽不但是一种抗肿瘤药物,还是DC的激活剂。
4参考文献
1 安映红,贾娜,李琳娜,等.Tuftsin 衍生物 TP 影响肿瘤相关巨噬细胞 MIP-1α 分子表达〔J〕.中国药理学通报,2014;30(10):1357-61.
2 汪琼,胡亚欧,贾娜,等.促吞噬肽衍生物 T 肽对裸鼠术后残瘤 VEGF 表达的影响〔J〕.生物技术通讯,2012;23(6):821-4.
3 Carlsson JA,Wold AE,Sandberg AS,etal.The polyunsaturated fatty acids arachidonic acid and docosahexaenoic acid induce mouse dendritic cells maturation but reduce T-cell responses in vitro 〔J〕.PLoS One,2015;10(11):e0143741.
4 Uyangaa E,Kim JH,Patil AM,etal.Distinct upstream role of type I IFN signaling in hematopoietic stem cell-derived and epithelial resident cells for concerted recruitment of Ly-6Chi Monocytes and NK cells via CCL2-CCL3 Cascade 〔J〕.PLoS Pathog,2015;11(11):e1005256.
5 Qi F,Wang D,Liu J,etal.Respiratory macrophages and dendritic cells mediate respiratory syncytial virus-induced IL-33 production in TLR3-or TLR7-dependent manner 〔J〕.Int Immunopharmacol,2015;29(2):408-15.
6 吴辉,常静,丁家望,等.促吞噬肽衍生物T肽抑制小鼠移植瘤和术后残瘤生长的药效学研究〔J〕.军事医学,2012;36(5):357-61.
7 张磊昌.CD4+IL9+T细胞在结直肠癌免疫微环境中分布、表型、分化与募集的实验研究〔D〕.桂林:广西医科大学,2014.
8 昂冰.OXA/5Fu 诱导结肠癌细胞释放 DAMPs 及在抗肿瘤免疫应答中效应〔D〕.上海:第二军医大学,2011.
9 贾娜,李琳娜,杨德宣.小鼠术后残瘤模型的建立及T肽抑制术后残瘤生长的初步研究〔J〕.解放军药学学报,2010;26(5):377-8.
10 贺艳琳,顾若兰,韩苏,等.一种人工合成 Tuftsin 类似肽大鼠组织分布和排泄研究〔J〕.解放军药学学报,2013;15(3):334-6.
11 Carretero R,Sektioglu IM,Garbi N,etal.Corrigendum:eosinophils orchestrate cancer rejection by normalizing tumor vessels and enhancing infiltration of CD8+ T cells 〔J〕.Nat Immunol,2016;17(2):214.
12 Ercetin AP,Ozcan MA,Aktas S,etal.Ex vivo evaluation of the effect of regulatory T cells (Treg) on the anti-tumor activity of bortezomib in multiple myeloma 〔J〕.Exp Hematol,2016;piiS0301-472X(16)00003-5〔Epub ahead of print〕.
〔2016-01-26修回〕
(编辑曲莉)
〔中图分类号〕R73-35+4
〔文献标识码〕A
〔文章编号〕1005-9202(2016)05-1057-03;
doi:10.3969/j.issn.1005-9202.2016.05.015
通讯作者:刘怀民(1970-),男,博士,主任医师,主要从事恶性肿瘤综合治疗研究。
基金项目:国家自然科学基金资助项目(81473638)
第一作者:杨旭初(1985-),男,主治医师,硕士,主要从事中西医结合肿瘤学研究。

