榭皮素对皮层神经元细胞氧化应激的保护作用
冯莉芳,张玲莉
(武汉大学人民医院 1.感染科; 2.药学部,湖北 武汉 430060)
榭皮素对皮层神经元细胞氧化应激的保护作用
冯莉芳1,张玲莉2
(武汉大学人民医院 1.感染科; 2.药学部,湖北 武汉 430060)
目的 探讨榭皮素对皮层神经元细胞氧化应激的保护作用。方法 原代培养皮层神经元细胞,随机分成对照组、H2O2(100 μmol/L)组、榭皮素组(Qu组)、AMPK抑制剂Compound C组(CC组)、H2O2+Qu组、H2O2+Qu+CC组,采用CCK8法检测细胞存活率,活性氧检测试剂盒检测细胞内活性氧,ELISA试剂盒检测βA表达水平,Western blot检测AMPK、p-AMPK及BACE1蛋白表达水平。结果 CCK8结果显示,榭皮素可明显降低H2O2对皮层神经元细胞存活率的抑制作用,并可显著降低H2O2诱导细胞内ROS及βA的表达;进一步研究发现,榭皮素可通过激活AMPK,上调p-AMPK的表达水平来达到抑制BACE1酶的表达。结论 H2O2刺激神经元细胞可上调氧化应激水平,榭皮素可通过促进AMPK的磷酸化,降低βA在细胞中的沉积,进一步下调ROS在细胞中的表达,从而减缓了H2O2对神经元细胞造成的损伤。
榭皮素; 神经元细胞; 氧化应激
老年痴呆症,又名阿尔茨海默症,是一种进行性发展的致死性神经退行性疾病。研究表明体内胆固醇平衡异常可引起神经退行性病变[1],体内外实验证实高浓度胆固醇参与老年痴呆症的发病过程,可直接调节淀粉样前蛋白(APP)的分解过程,促进β-淀粉样蛋白(βA)在体内的积累[2-3]。除此之外,胆固醇诱导的大脑氧化应激和神经元炎症反应,可促进大脑βA的积累并加快老年痴呆症的发病过程。研究表明降胆固醇药物(如他汀类药物)可降低βA的合成及沉积,并可降低老年痴呆的发病风险[4-5]。
榭皮素(quercetin,Qu),一种天然的黄酮类化合物,具有较强的抗氧化和抗炎症活性,对神经退行性疾病、糖尿病、癌症及肥胖均有良好的疗效[6-11]。AMP激活蛋白激酶(AMPK)是一种丝氨酸/苏氨酸蛋白激酶,可调节细胞内代谢和能量平衡[12],AMPK苏氨酸(172位)磷酸化可减少活性氧(ROS)的合成[13]。因此,AMPK可能是治疗H2O2引起的神经元毒性的潜在靶点。本实验以皮层神经元细胞为模型,评估榭皮素对H2O2诱导的神经退行性疾病的影响,并对其潜在的神经元保护作用机制进行初步的探讨。
1 材料与仪器
1.1 材料
榭皮素(Sigma,CAS No.117-39-5,≥99%);Compound C(AMPK抑制剂,SELLECK,≥99%);DMEM培养基(Gibcol公司);胎牛血清(FBS,Gibcol公司);GAPDH抗体、p-AMPK抗体、AMPK抗体及BACE1抗体均购自GeneTex (USA);CCK-8试剂盒购置武汉谷歌生物有限公司;ELISA试剂盒购自Boster公司;原代大鼠皮层神经元细胞购自基尔顿生物科技有限公司。
1.2 主要仪器
ISO14644-1型超净工作台(天津泰斯特);Spectra max plus 384型酶标仪(Molecular Devices公司);Odyssey近红外扫描仪(LI-COR Biosciences)。
2 方法与结果
2.1 神经元细胞原代培养与分组
原代培养大鼠皮层神经元细胞用高糖培养基(DMEM)培养,成分包括10%(φ)FBS、1%青霉素-链霉素双抗,于5%(φ)CO2、37 ℃培养箱中培养,待细胞贴壁便可用于细胞模型构建及药物处理。H2O2氧化损伤模型的建立以及H2O2浓度参考文献[14]进行。将培养好的细胞分为6组:对照组、H2O2(100 μmol/L)组、榭皮素组(Qu组)、Compound C组(CC组)、H2O2+Qu组、H2O2+Qu+CC组。
2.2 统计学分析
2.3Qu对神经元细胞存活率的影响
将神经元细胞重悬后,以1×105个/孔细胞数接种于96孔板中,细胞分组同上。待细胞贴壁生长到80%~90%后,弃去旧培养基,每组细胞加入相应的Qu(10μg/mL)或CC(2μg/mL)处理细胞24h后,加入100μmol/L的H2O2处理细胞24h后,吸弃旧培养基,每孔加入含10μLCCK8试剂新鲜培养基100μL,继续培养1h后取出置于酶标仪中,于450nm处测定吸光度值。结果如图1所示,H2O2组和H2O2+Qu+CC组细胞存活率分别为(47.3±2.03)%、(51.7±3.12)%,显著低于对照组细胞存活率(85.4±3.15)%;而H2O2+Qu组、CC组、Qu组细胞存活率分别为(72.5±2.64)%、(69.8±1.94)%和(68.4±2.45)%,显著高于H2O2组细胞存活率,说明Qu可以改善由H2O2引起的神经元细胞的损伤。

1.对照组; 2.H2O2组; 3.H2O2+Qu组; 4.H2O2+Qu+CC组; 5.Qu组; 6.CC组(下同)。与对照组比较:*P<0.05;与H2O2组比较:#P<0.05。
图1 榭皮素对H2O2处理的皮层神经元细胞存活率的影响
Figure 1 Effect of quercetin on cell survival of neurons (n=3)
2.4 Qu对神经元细胞中ROS的影响
将神经元细胞重悬后,以1×106个/孔细胞数接种于6孔板中,细胞分组同上。待细胞贴壁生长到80%~90%后,弃去旧培养基,每组细胞加入相应的Qu(10 μg/mL)或CC(2 μg/mL)处理细胞24 h后,加入100 μmol/L的H2O2处理细胞24 h后,采用活性氧检测试剂盒检测ROS的含量。结果如图2所示,H2O2组和H2O2+Qu+CC组细胞中ROS的相对表达水平显著高于对照组细胞,而H2O2+Qu组、CC组、Qu组细胞中ROS的相对表达水平则显著低于H2O2组细胞,说明Qu可以降低由H2O2引起的神经元细胞的氧化应激损伤。
2.5 Qu对神经元细胞中βA40和βA42表达的影响
将神经元细胞重悬后,以1×106个/孔细胞数接种于6孔板中,细胞分组同上。待细胞贴壁生长到80%~90%时后,弃去旧培养基,每组细胞加入相应的Qu(10 μg/mL)或CC(2 μg/mL)处理细胞24 h后,

与对照组比较:*P<0.05;与H2O2组比较:#P<0.05。
图2 榭皮素对H2O2处理的皮层神经元细胞中ROS表达水平的影响
Figure 2 Effect of quercetin on the levels of ROS expression in neurons (n=3)
加入100 μmol/L的H2O2处理细胞24 h后,采用ELISA试剂盒检测神经元细胞培养基中βA40和βA42的表达水平。结果如图3所示,H2O2组和H2O2+Qu+CC组细胞中βA40和βA42的表达水平显著高于对照组细胞;H2O2+Qu组、CC组、Qu组细胞中βA40和βA42的表达水平则显著低于H2O2组细胞;而H2O2+Qu+CC组细胞中βA40和βA42的表达水平显著低于H2O2组细胞(均为P<0.05)。说明Qu可以降低由H2O2引起的神经元细胞中βA40和βA42沉积,进一步减少ROS的产生。
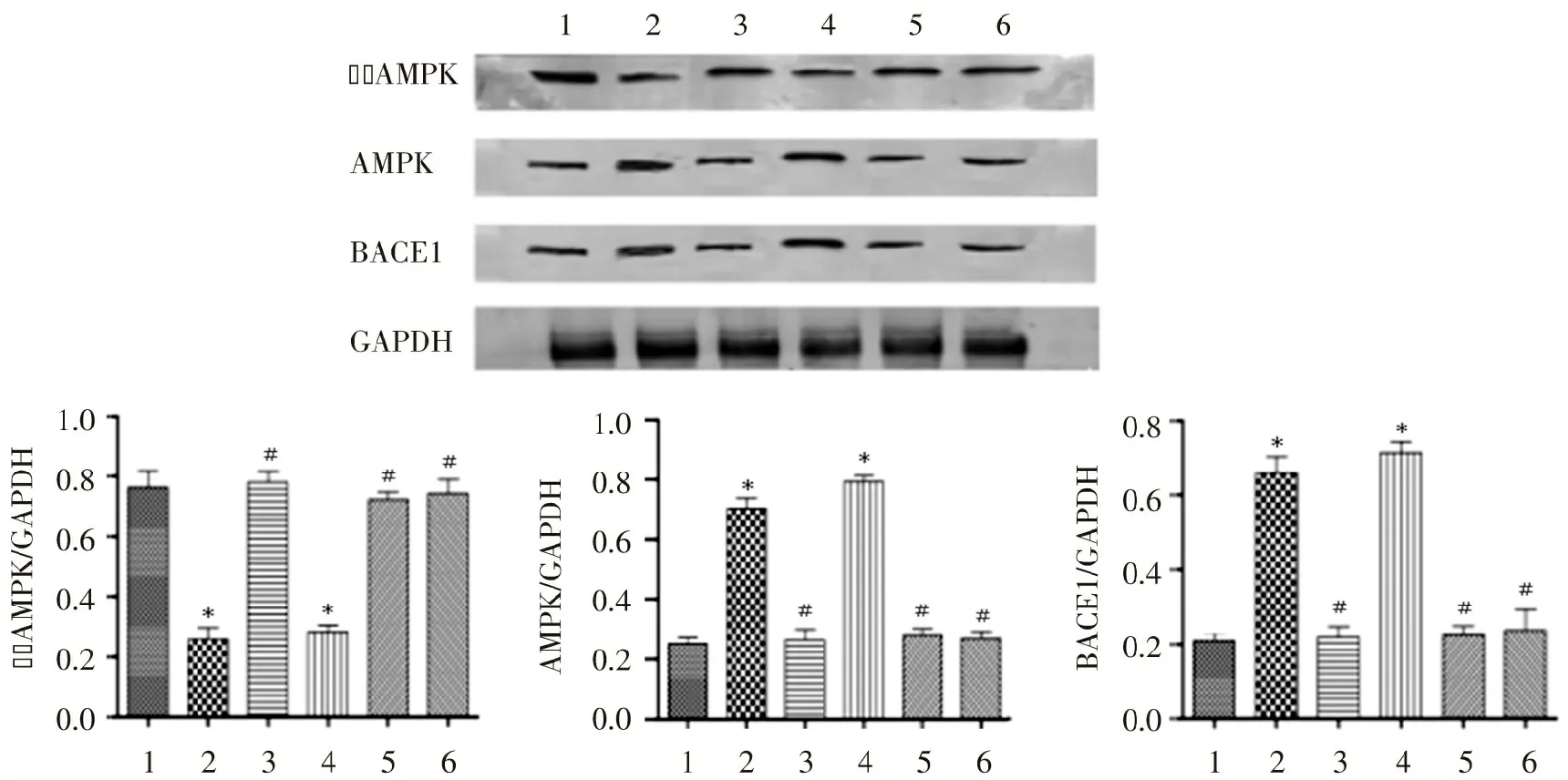
2.6 Qu对神经元细胞中AMPK、p-AMPK及BACE1表达水平的影响
将神经元细胞重悬后,以1×106个/孔细胞数接种于6孔板中,细胞分组同上。待细胞贴壁生长到80%~90%时后,弃去旧培养基,每组细胞加入相应的Qu(10 μg/mL)或CC(2 μg/mL)处理细胞24 h后,加入100 μmol/L的H2O2处理细胞24 h后,采用BCA试剂盒测定蛋白浓度,采用Western blot技术检测蛋白表达水平,每孔上样40 μg蛋白质进行凝胶电泳,电泳完成后将蛋白转移至PVDF膜,然后一抗孵育过夜,洗膜3次后二抗孵育1 h,利用Odyssey近红外扫描仪对GAPDH、AMPK、p-AMPK(Thr172)、BACE1表达水平进行检测。结果如图4所示,H2O2组和H2O2+Qu+CC组细胞中p-AMPK(Thr172)的表达水平显著低于对照组细胞,而H2O2+Qu组、CC组、Qu组细胞中p-AMPK的表达水平则显著高于H2O2组细胞;AMPK、BACE1在H2O2+Qu组、CC组、Qu组细胞中的表达下调,说明Qu可以促进AMPK的磷酸化,进一步抑制了BACE1的表达,阻滞了APP向βA的转变,达到改善神经元细胞氧化应激的损伤。
3 讨论
绿茶、儿茶素、姜黄色素及榭皮素等黄酮类化合物对老年痴呆症有着良好的治疗效果[15],其中榭皮素具有广泛的药理作用,生物活性较强。因此,本实验评估了榭皮素对由H2O2诱导皮层神经元细胞氧化应激及神经元毒性的保护作用,并对其潜在的作用机制进行了探讨。AMPK在调节脂质代谢、能量平衡和食物摄取过程中起着关键的作用[16],AMPK的磷酸化可以增强脂肪酸氧化代谢过程,抑制脂肪酸、胆固醇、蛋白质的生物合成代谢过程,并且AMPK的活化可以被剧烈运动、营养缺失及动脉缺血缺氧所调控,还可以被天然化合物榭皮素或姜黄素所调控[17-18]。本实验中榭皮素可以促进AMPK的磷酸化,导致p-AMPK在皮层神经元细胞中的表达水平升高,抑制了BACE1蛋白的表达,引起APP的γ裂解生成βA量降低,减少了βA在细胞中的沉积,进一步降低了皮层神经元细胞中氧化应激的水平,改善了由H2O2诱导的细胞损伤。
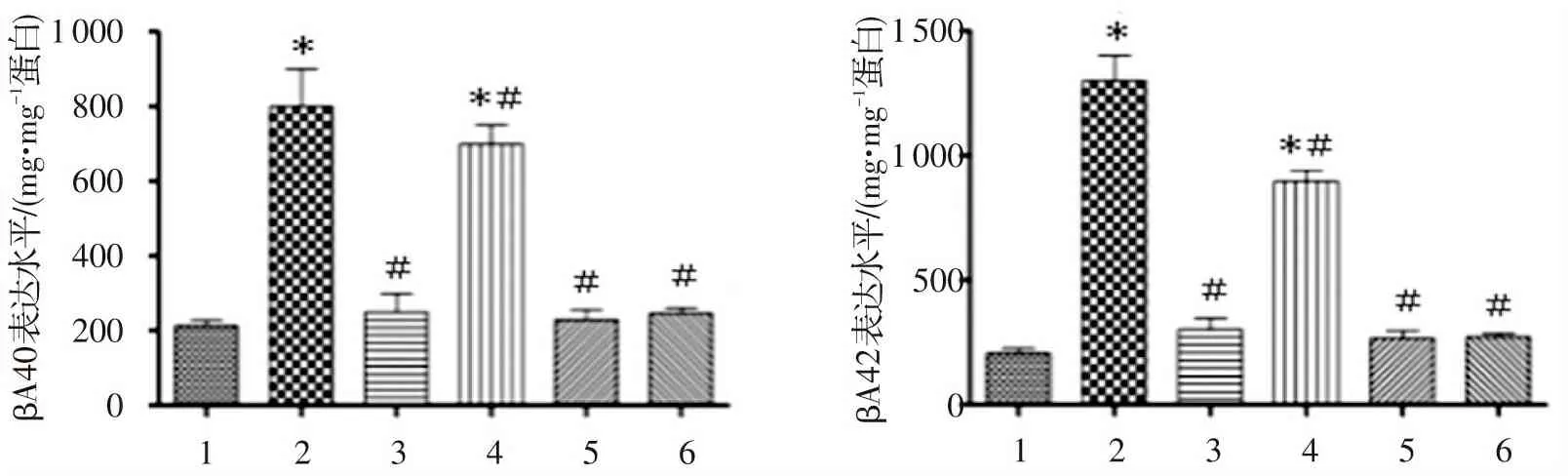
与对照组比较:*P<0.05; 与H2O2组比较:#P<0.05。 图3 榭皮素对H2O2处理的皮层神经元细胞中βA40和βA42表达水平的影响Figure 3 Effect of quercetin on the levels of βA40 and βA42 expression in neurons (n=3)
与对照组比较:*P<0.05; 与H2O2组比较:#P<0.05。
图4 榭皮素对H2O2处理的皮层神经元细胞中AMPK、p-AMPK(Thr172)、BACE1表达水平的影响
Figure 4 Effect of quercetin on the levels of AMPK,p-AMPK (Thr172) and BACE1 expression in neurons (n=3)
实验结果表明榭皮素对皮层神经元细胞的保护作用部分依赖于AMPK的活化。除此之外,榭皮素能明显降低βA40和βA42在细胞中的表达水平,并且这一过程可被AMPK抑制剂阻断。说明βA在细胞中的沉积可能是由于AMPK活化受到抑制而导致BACE1蛋白酶表达上调,促进了APP的γ裂解。H2O2+Qu+CC组细胞中βA40和βA42的表达水平显著低于H2O2组细胞,可能是因为榭皮素还可通过其他通路来调节βA在皮层神经元细胞中的沉积,而这些通路不被AMPK抑制剂所阻断。综上所述,榭皮素对皮层神经元细胞所受氧化应激的保护作用可通过激活AMPK来实现,通过减少βA在细胞中的沉积,降低ROS在细胞中的表达,起到改善神经元毒性的效果。
[1] LU J,WU D M,ZHENG Y L,et al. Trace amounts of copper exacerbate beta amyloid-induced neurotoxicity in the cholesterol-fed mice through TNF-mediated inflammatory pathway[J]. Brain Behav Immun,2009,23:193-203.
[2] CASSERLY I,TOPOL E J. Convergence of atherosclerosis and Alzheimer’s disease:inflammation,cholesterol,and misfolded proteins[J]. Lancet,2014,363:1139-1146.
[3] LU J,ZHENG Y L,WU D M,et al. Trace amounts of copper induce neurotoxicity in the cholesterol-fed mice through apoptosis[J]. FEBS Lett,2006,580:6730-6740.[4] WOLOZIN B,KELLMAN W,RUOSSEAU P,et al. Decreased prevalence of Alzheimer disease associated with 3-hydroxy-3-methyglutaryl coenzyme A reductase inhibitors[J]. Arch Neurol,2011,57:1439-1443.
[5] FASSBENDER K,SIMONS M,BERGMANN C,et al. Simvastatin strongly reduces levels of Alzheimer’s diseaseβ-amyloid peptides Aβ42 and Aβ40invitroandinvivo[J]. Proc Natl Acad Sci USA,2011,98:5856-5861.
[6] COMALADA M,CAMUESCO D,SIERRA S,et al.invivoquercitrin antiinflammatory effect involves release of quercetin,which inhibits inflammation through down-regulation of the NF-κB pathway[J]. Eur J Immunol,2015,35:584-592.[7] SHOSKES D A. Effect of bioflavonoid quercetin and curcumin on ischemic renal injury:a new class of renoprotective agents[J]. Transplantation,2009,66:147-152.
[8] DOK-G O H,LEE K H,KIM H J,et al. Neuroprotective effects of antioxidative flavonoids,quercetin,(+)-dihydro-quercetin and quercetin 3-methyl ether,isolated fromOpuntiaficus-indicavar. saboten[J]. Brain Res,2013,965:130-136.
[9] LU J,PAPP L V,FANG J,et al. Inhibition of mammalian thioredoxin reductase by some flavonoids:implications for myricetin and quercetin anticancer activity[J]. Cancer Res,2014,66:4410-4418.
[10] LU J,ZHENG YL,LUO L,et al. Quercetin reverses d-galactose induced neurotoxicity in mouse brain[J]. Behav Brain Res,2016,171:251-260.
[11] KEMPURAJ D,CASTELLANI M,PETRARCA C,et al. Inhibitory effect of quercetin on tryptase and interleukin-6 release,and histidine decarboxylase mRNA transcription by human mast cell-1 cell line[J]. Clin Exp Med,2006,6:150-156.
[12] HARDIE D G. AMPK:a key regulator of energy balance in the single cell and the whole organism[J]. Int J Obes,2008,32:S7-S12.
[13] RONNETT G V,KLEMAN A M,KIM E K,et al. Fatty acid metabolism,the central nervous system,and feeding[J]. Obesity,2006,14:S201-S207.
[14] ZHZO Z Y,LUAN P,HUANG S X,et al. Edaravone protects HT22 neurons from H2O2-induced apoptosis by inhibiting the MAPK signaling pathway[J]. CNS Neurosci Ther,2013,19(3):163-169.
[15] MANDEL S,AMIT T,BAR-AM O,et al. Iron dysregulation in Alzheimer’s disease:multimodal brain permeable iron chelating drugs,possessing neuroprotective-neurorescue and amyloid precursor protein-processing regulatory activities as therapeutic agents[J]. Prog Neurobiol,2007,82:348-360.
[16] DZAMKO N,DENDEREN B J W,HEVENER A L,et al. AMPK β1 deletion reduces appetite,preventing obesity and hepatic insulin resistance[J]. J Biol Chem,2010,285:115-122.
[17] MCCULLOUGH L D,ZENG Z,LI H,et al. Pharmacological inhibition of AMP-activated protein kinase provides neuroprotection in stroke[J]. J Biol Chem,2012,280:20493-20502.
[18] KEMP B E,MITCHELHILL K I,STAPLETON D,et al. Dealing with energy demand:the AMP-activated protein kinase[J]. Trends Biochem Sci,2009,24:22-25.
(责任编辑:幸建华)
Protection effect of quercetin on oxidative stress-induced cortical neuron injury
FENG Lifang,ZHANG Lingli
(1.DepartmentofInfectiousDiseases; 2.DepartmentofPharmacy,RenminHospitalofWuhanUniversity,Wuhan430060,China)
Objective To investigate the protective effect of quercetin on oxidative stress-induced cortical neuron injury. Methods Cortical neurons were cultured and grouped into six groups,including the control group,H2O2group,quercetin group,CC group,H2O2combined with quercetin group,and H2O2+ quercetin +CC group. Cell viability was detected by CCK8 assay. The level of ROS in cortical neuron was detected by ROS assay kit and the protein level of βA was detected by ELISA assay. Western blot was used to determine the expression of AMPK,p-AMPK and BACE1 proteins. Results Treatment with quercetin decreased the suppression of H2O2on cell viability and the expression of ROS and βA induced by H2O2. In addition,quercetin reduced the expression of BACE1 by upregulation of AMPK phosphorylation. Conclusion The level of oxidative stress in neurons could be upregulated by H2O2stimulation. Quercetin may inhibit the expression of ROS and βA via upregulation of AMPK phosphorylation,which alleviates H2O2-induced cortical neuron injury.
quercetin; neurons; oxidative stress
2016-07-11
冯莉芳,女,硕士,主管护师,主要从事中药药理学研究,Email:zhangwhu@hotmail.com。
时间:2016-10-19 15:28:12
http://www.cnki.net/kcms/detail/44.1413.R.20161019.1528.001.html
R965
A
1006-8783(2016)05-0609-04
10.16809/j.cnki.1006-8783.2016071102

