液相色谱-四极杆飞行时间质谱结合化学计量学方法筛查饲料中的未知药物
侯 粲,邱 静,程永友,赵璐瑶,杨曙明
(中国农业科学院 农业质量标准与检测技术研究所,北京 100081)
液相色谱-四极杆飞行时间质谱结合化学计量学方法筛查饲料中的未知药物
侯 粲,邱 静*,程永友,赵璐瑶,杨曙明*
(中国农业科学院 农业质量标准与检测技术研究所,北京 100081)
建立了液相色谱-四极杆飞行时间质谱(LC-Q-TOF/MS) 对饲料中非目标污染物(兽药) 的筛查方法,以及未知物的判定和确认技术。饲料样品经0.1% EDTA-乙腈-甲醇(1∶1∶1,含0.1%甲酸) 混合溶液提取,Q-TOF全扫描模式采集数据,数据经过峰对齐(质量误差5 mDa以内) 、噪音过滤、自动排除无用峰等处理后,进行正交偏最小二乘判别分析(OPLS-DA) 处理,根据Score图、S-Plot图和VIP图判定出特征离子,结合二级信息与自建谱库比对,进行结构式确认,或通过同位素丰度比例和分子式生成功能,确认分子式,结合二级断裂信息,判定特征离子的结构式,从而判定未知物的成分。结果显示:16份饲料样品共筛查出27种兽药。采用液相色谱-三重四极杆串联质谱法对其中的12种兽药进行定性定量分析,验证结果仅出现2个假阳性,兽药含量在12.5~152.0 mg/kg之间。通过LC-Q-TOF/MS结合OPLS-DA的方法能够对饲料中的非目标物进行筛查分析,方法准确度高。
液相色谱-四极杆飞行时间质谱;非目标物;正交偏最小二乘判别分析;饲料;兽药
目前大多数的仪器分析技术特别是色谱分析、色谱-质谱联用分析技术多是针对已知目标物的测定[1],用已知的标准品作为参考,进行样品中目标成分的定性或定量分析,且针对目标物的检出限达到ppb级,甚至ppt级别[2-11],但这种针对目标物的检测分析技术往往会忽略“目标”以外的“非目标物”,不利于对样品的全面分析。近年来随着分析仪器技术的发展,高分辨质谱仪器的产生,应用色谱-高分辨质谱技术分析时,在复杂的基质中即可以实现体系中的非目标化合物或者未知化合物的检测[12]。分辨率是保证质谱数据的一致性和可靠性的重要参数[13],在分析过程中,质谱的质量分辨率受到被分析化合物的浓度、基质类型以及样品制备方法等因素的影响[14]。应用其高分辨性能得到的精确质量数信息,结合化学计量学方法,使得非目标物的分析成为可能[15],该方法能够在目标物背景未知、无标准品的前提下,对非目标化合物进行筛选、确认和定量分析。目前已有针对中药[16]、环境水[17]、尿液和食品[18-19]等未知物的分析报道,而针对饲料中未知物的筛查报道很少。
“瘦肉精”问题对饲养管理以及相关化工产品的产、销以及中间环节敲响了警钟,同时也对食品安全提出更高的要求。所以,解决兽药滥用、违法使用的现象迫在眉睫。通过“非目标”方式的分析,针对饲料进行事前筛查监督,防止出现问题后的“事后监测”现象,做到先知先觉,杜绝饲料中兽药的滥用、违法使用问题,提高监管力度,对于保证饲料及畜产品的安全具有重要意义。因此,本文应用液相色谱-飞行时间质谱结合化学计量学的方法,建立了饲料中非目标污染物的判别及确证方法,为相关的质量监督、监测提供了依据。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1200高效液相色谱仪(美国Agilent公司);QSTAR四极杆飞行时间质谱仪、API2000 三重四极杆质谱仪(美国Applied Biosystems公司);ThermoST16冷冻高速离心机(美国Thermo公司);超声波提取仪(昆山市超声仪器有限公司);GENIUS 3涡旋混合仪(德国IKA公司);水浴氮吹仪(北京东方精华苑科技有限公司);Milli-Q超纯水系统(美国Millipore公司)。

1.2 实验步骤
1.2.1 样品制备 准确称取饲料样品2 g(精确至0.01 g)置于50 mL干净离心管中,加入20 mL 0.1% EDTA-乙腈-甲醇(1∶1∶1,含0.1%甲酸)混合溶液提取,充分涡旋混合1 min后,室温下超声提取20 min,高速离心机中以7 000 r/min离心10 min后,取全部上清液于另一干净离心管中,氮气吹至近干,用1 mL乙腈-0.1%甲酸(4 ∶96)溶液定容,取全部溶液过0.22 μm滤膜,上机待测。
1.2.2 饲料中未知物的LC-Q-TOF/MS筛查分析 对饲料样品进行LC-Q-TOF/MS检测,全扫描模式采集数据,进行质谱数据处理后,利用SIMCA-P(瑞典Umetrics公司)软件对数据进行降维处理,判定样品中的未知特征离子,利用分子式生成(Formula Finder)软件对未知兽药进行定性分析。结合二级质谱信息和同位素丰度信息对未知兽药进行结构确证分析。
1.2.3 饲料中未知物的LC-MS/MS验证分析 针对筛查出的兽药,选择现有的12种兽药标准品进行LC-MS/MS检测,对饲料样品进行MRM检测,验证LC-Q-TOF/MS筛查结果的准确性和可靠性,并对筛查结果进行定量分析。
1.3 实验条件
1.3.1 液相色谱参数 色谱柱:Agilent Eclipse XDB-C18色谱柱(2.1×150 mm,5 μm);进样体积:10 μL;柱温:30 ℃;流动相:A为0.1%甲酸水,B为甲醇;流速:300 μL/min;梯度洗脱程序:0~3 min,10% ~70% B,维持3 min;6~7.5 min,70% ~90% B,维持1.5 min;9.1~20 min,90% B。
1.3.2 质谱参数 质谱方法A:正离子模式(ESI+),TOF/MS全扫描模式,一级质谱扫描范围为m/z50~1 000。帘气压力(Curtain gas):20 psi;离子源喷雾电压(Ionspray voltage):5 500 V;去簇电压(Declustering potential):80 V;碰撞气压力(Collision gas):5 psi;雾化气压力(Gas1):50 psi;加热辅助气压力(GS2):60 psi;离子源温度(Temperature):500 ℃;碰撞室入口电压(Entrance potential):10 V ;驻留时间(Storage time ):20 ms。
二级质谱扫描采用信息相关性采集(IDA),扫描范围为:离子响应大于(Ion that exceeded)100 cps;质量数偏差:50 mDa;碰撞能量(Collision energy):40 V;动态背景扣除(Dynamic background subtract )activated。采集数据时应用m/z149.023 3,279.159 1,391.284 3共3个离子作为质量轴进行数据的质量数校正工作。
质谱方法B:MRM正离子模式扫描,离子喷雾电压:5 500 V;离子源温度:500 ℃;帘气压力:20 psi;雾化气压力(Gas1):50 psi;加热辅助气压力(GS2):60 psi;碰撞室入口电压(Entrance potential):10 V;驻留时间(Storage time ):20 ms。
1.3.3 数据处理 质谱数据处理采用MarkerView(美国Applied Biosystems公司)软件,将仪器扫描获得的Wiff格式文件导入MarkerView软件,设置误差范围(50 mDa)、噪音过滤、自动排除无用峰等,对数据降维,导出为XLS格式文件,随后使用SIMCA-P(瑞典Umetrics公司)软件的正交偏最小二乘判别分析(OPLS-DA)的方法进行统计学分析。
1.3.4 兽药筛查谱库 利用包含347种兽药标准品建立的谱库,包括一级谱库信息:精确质量数、分子式;二级谱库信息:相应化合物的二级断裂谱图信息。
2 结果与讨论
2.1 前处理条件的选择
本实验的前处理步骤简单,目的是避免在繁琐的前处理过程中丢失一些化合物信息,尽管这一过程会降低分析方法的可靠性,在对未知物的研究过程中,应当尽可能多地获取样品中化合物的信息。使用0.1%EDTA-乙腈-甲醇(1∶1∶1,含0.1%甲酸)混合溶液作为提取剂,能够适用于大多数兽药和药物的多残留液相色谱-质谱法分析[20]。
2.2 LC-Q-TOF/MS的方法学考察
取空白饲料样品连续进样6次,考察了正离子模式下总离子流色谱图中的4个主要色谱峰的保留时间和峰响应强度的变化情况。结果表明,主要色谱峰的保留时间的相对标准偏差(RSD)均小于0.3%,响应强度的RSD均小于5%。因此,该方法稳定性较好,重现性良好,能够满足后续的统计学分析要求。部分阳性饲料样品的总离子流色谱图见图1。
2.3 统计学分析
对采集的数据进行统计学分析,即正交偏最小二乘判别(OPLS-DA)分析法来建立判别模型,其结果以Score plot,S-Plot,VIP图和Permutation图的形式表现出来。如图2所示,模型的R2(模型准确度)大于0.8,Q2(模型预测性)大于0.5,建立的预测模型经200次模拟后,可以相交于一点,即说明是有效模型。从OPLS-DA的得分图中(见图3)可以看出,空白组与样品组能够明显区分,说明样品中含有不同于空白组的成分或者不同的含量。载荷图中包括母离子、同位素离子、单一同位素离子,用于识别导致各组有差异的特征成分,即标志物。图4A中所有离子中距离载荷图原点位置最远的离子,对导致各组出现差异的贡献相对最大,因此将载荷图最两端的离子选定为特征离子,VIP值用来说明各离子在所有数据中的可信度(误差范围)和影响力(纵坐标数值)(如图4B)。选择VIP值大于1且可信度高(误差小)的离子作为特征离子,结合载荷图和VIP图的选择条件,去除同位素离子和单一同位素离子,确定特征离子,进行后续的分子式、结构式的确证工作。通过统计学分析的方法处理数据后,可以判别出样品之间的组分差异,这与Bourgin等、Vaclavik等报道的结论一致,同样通过统计学分组的方法快速的判别不同红酒、正常人和糖尿病患者的尿液、环境水中的差异化合物[21-23]。
2.4 特征离子(标志物)的确认
利用软件的分子式生成功能,同时参照化合物的同位素分布和精确质量数匹配信息(匹配误差小于5 ppm),匹配结果能够剔除大部分不正确的分子式以提高未知化合物鉴定分析的准确度和可靠性。结合化合物的二级质谱信息,通过自建谱库比对或者Chemspider结合二级结构确定结构式。根据化合物的精确质量数和同位素丰度进行匹配,匹配出的分子式按照综合得分的高低进行排列,通常分数高的分子式可能性比较大,此时需结合化合物的二级结构断裂信息、Chemspider中的结构式信息进行化合物的确证,判定化合物可能的结构式信息。饲料样品筛查的结果见表1,从表中可以看出,16份饲料样品中共筛查出27种兽药,包括喹诺酮类、咪唑类、抗病毒类、磺胺类、激素类等兽药,其中有3份样品未筛查出药物残留。27种药物的具体匹配结果和匹配得分见表2,所有药物的质量数误差在-2.2~5.0 ppm之间,匹配分数均大于85分。
从匹配的过程可以看出,应用OPLS-DA分析法得到未知特征离子的质荷比(m/z)信息之后,需要查看特征离子的二级信息,确认特征离子的碎片信息,同时需根据特征离子的同位素分布情况,利用分子式生成功能,得到可能的分子式,其中包括根据同位素匹配程度得到的分数,分数越高,说明分子式匹配成功率越高。最后再根据特征离子的二级信息,确认结构式。
表1 16份饲料样品的筛查结果
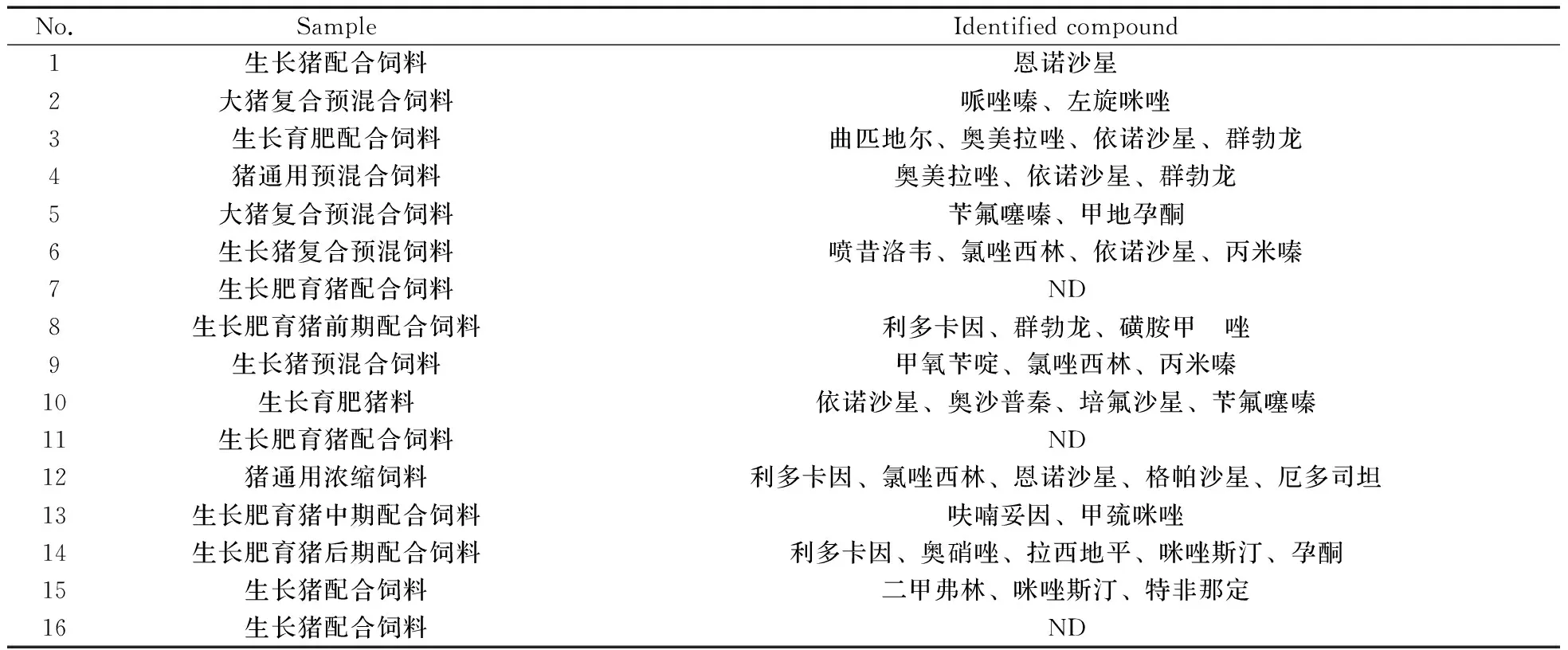
Table 1 Non-targeted screening of 16 feed samples
ND:no detected

表2 LC-Q-TOF/MS方法鉴定出的未知化合物Table 2 Non-target compounds identified in feed samples by LC-Q-TOF/MS
通过高分辨质谱的全扫描模式能够获得复杂样品体系中相对较多的信息,利用统计学的方法对数据信息进行降维处理,将杂乱无章的质谱数据转换成二维数据,通过模型判别,快速找出未知样品中的未知离子,利用得到的精确质量、二级质谱和同位素丰度比3种条件进行未知物的匹配。首先,高分辨质谱仪器得到的精确质量数信息(精确到0.001)相比串联质谱仪器得到的质荷比(m/z,精确到0.01)而言,缩小了相似质量的化合物范围,这与Ibanez等[24]采用精确质量数确认水中未知化合物的报道相符。同位素丰度比值可以判定未知化合物的元素组成,二级质谱信息能够反映化合物结构的断裂情况,将这3种条件同时应用于未知化合物的分析有理论基础,同时也有文献依据,Bueno等[25]应用精确分子量、天然同位素丰度和二级质谱信息对河水中的药物进行定性研究。谭和平等[26]通过与自建滥用药物数据库比对进行快速筛查,用精确分子量、同位素分布和碎片离子信息进行确证,发现中成药中相对含量最高的3种成分均为非法添加药物。Krauss等[27]应用高分辨质谱对环境中的未知物进行识别分析,得到精确质量数、同位素分布和二级质谱信息之后,基于上述3种信息,完成了对未知化合物的定性分析。
2.5 筛查结果的验证及定量分析

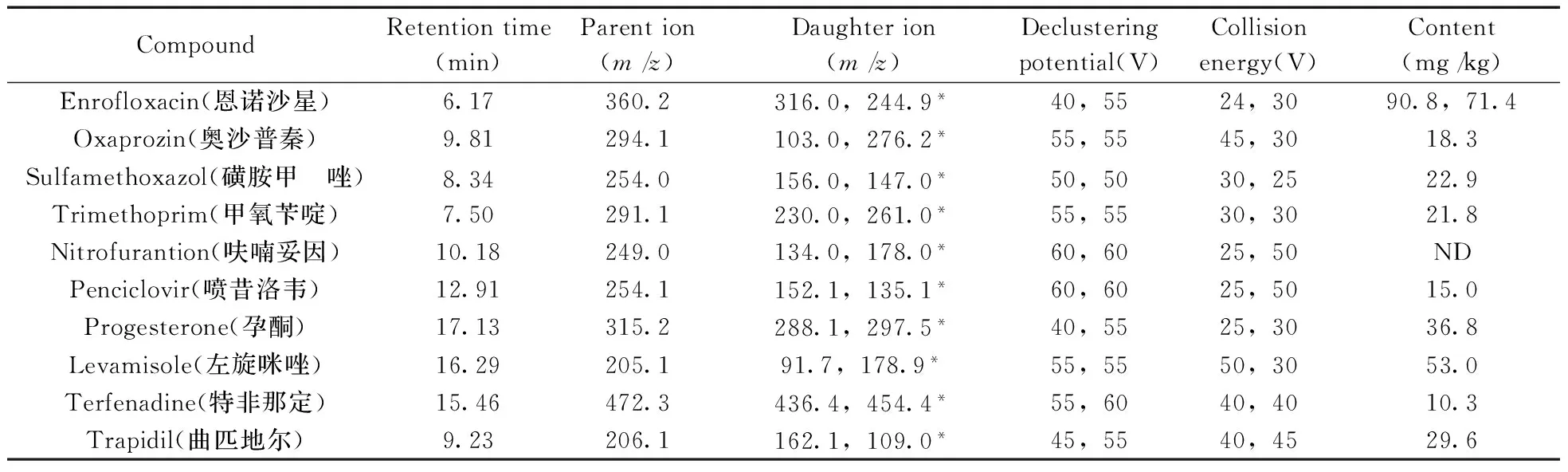
表3 MRM检测模式下12种药物的仪器条件、含量结果Table 3 Parameters of multiple reaction monitoring and analysis results of 12 veterinary drugs
(续表3)
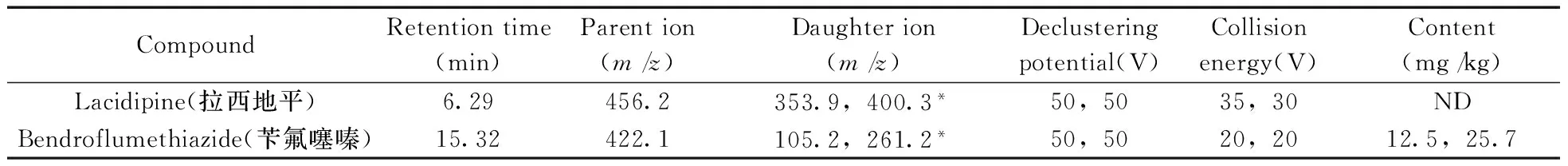
CompoundRetentiontime(min)Parention(m/z)Daughterion(m/z)Declusteringpotential(V)Collisionenergy(V)Content(mg/kg)Lacidipine(拉西地平)6.29456.2353.9,400.3*50,5035,30NDBendroflumethiazide(苄氟噻嗪)15.32422.1105.2,261.2*50,5020,2012.5,25.7
ND:no detected,*:quantitative ion
3 结 论
本研究建立了LC-Q-TOF/MS结合统计学方法对饲料中的未知物(兽药)进行筛查分析,该方法结合了高分辨仪器的精确度、软件快捷和准确性的优势,为未知物的筛查提供了快速、准确的分析方法,对未知样品进行筛查之后,可以判定样品中大致的兽药成分,从而进行有目标的检测研究,扩展了液质联用仪器的应用范围,为饲料中兽药的筛查工作提供了技术参考。同时在养殖、生产过程中,可将正常的环境数据建库,实时进行比对,一旦发现异常,可及时阻止问题的扩大化,减少损失,保证食品/农产品安全。
[1] Leporati M,Bergoglio M,Capra P,Bozzetta E,Abete M C,Vincent M.MassSpectrom.,2014,49(9):936-946.
[2] Yin S,Wu G P,Lei Y P.Chin.J.Pharm.Anal.(殷帅,吴公平,雷玉萍.药物分析杂志),2010,30:400-403.[3] Sandin-Espana P,Mateo-Miranda M,Lopez-Goti C,De Cal A,Alonso-Prados J L .FoodChem.,2016,192(1):268-273.
[4] Zhang J L,Wang Z L,Zhang Y N.J.Chin.MassSpectrom.Soc.(张建丽,王占良,张亦农.质谱学报),2009,30:271-274.
[5] Hiba A,Carine A,Haifa A R,Ryszard L,Farouk J.FoodChem.,2016,192(1):212-227.
[6] Gao S,Yu L M,Bi K S.Pharm.Anal.,2009,29:1715-1718.
[7] Nguyen D D,Busetti F,Johnson S K,Solah V A.FoodCompos.Anal.,2015,44:102-110.
[8] Xiong L,Gao Y Q,Li W H,Guo T F,Yang X L.FoodSci.Technol.,2015,24(5):1629-1635.
[9] Zhao Z Y,Liu N,Yang L C,Deng Y F,Wang J H,Song S Q,Lin S H,Wu A B,Zhou Z L,Hou J F.Anal.Bioanal.Chem.,2015,407(24):7359-7368.
[10] Reinholds I,Pugajeve I,Bartkevics V.FoodControl,2016,60:683-689.
[11] Fan S,Miao H,Zhao Y F,Chen H J,Wu Y N.J.Agric.FoodChem.,2012,60(8):1898-1905.
[12] Qu B,Chen R,Geng S W,Lu G P,Jiang T M,Shao D J,Jiang J H.J.FoodSaf.Qual.Test.(曲斌,陈蓉,耿士伟,陆桂萍,蒋天梅,邵德佳,姜加华.食品安全质量检测学报),2015,6(5):1654-1660.
[13] Kellman M,Muenster H,Zomer P,Mol H.J.Am.Soc.MassSpectrom.,2009,20(8):1464-1476.
[14] Van der Heeft E,Bolck Y J C,Beumer B,Nijrolder A W J M,Stolker A A M,Nielen M W F.J.Am.Soc.MassSpectrom.,2009,20(3):451-463.
[15] Ibanez M,Sancho J V,Bijlsma L,van Nuijs A LN,Covaci A,Hemandez F.TrAC,TrendsAnal.Chem.,2014,57:107-117.
[16] Li L J,Zeper A,Xiang Y,Wang A G,Feng X Z,Li B,He W Y.J.Instrum.Anal.(李立军,再帕尔·阿不力孜,项赟,王爱国,冯孝章,李斌,贺文义.分析测试学报),2001,20(S1):63-64.
[17] Masia A,Campo J,Blasco C,Pico Y.J.Chromatogr.A,2014,1345(6):86-97.
[18] Diaz R,Lbanez M,Sancho J V,Hernandez F.Anal.Methods,2012,4(1):196-209.
[19] Tang D Y,Dong Y M,Guo N,Li L,Ren H K.J.Sci.FoodAgric.,2014,94(8):1639-1647.
[20] Dasenaki M E,Thomaidis N S.Anal.Chim.Acta,2013,880(23):103-121.
[21] Bourgin M,Bichon E,Antignac J P,Monteau F,Leroy G,Barritaud L,Chachignon M,Ingrand V,Roche P,Le Bizec B.Chemosphere,2013,93(11):2814-2822.
[22] Ma X L,Meng L,Li X X,Li L L,Wang Y,Mao X M.J.Instrum.Anal.(马晓丽,孟磊,李新霞,李琳琳,王烨,毛新民.分析测试学报),2014,3(6):621-627.
[23] Vaclavik L,Lacina O,Hajslova J,Zweigenbaum J.Anal.Chim.Acta,2011,685(1):45-51.
[24] Ibanez M,Sancho J V,Pozo O J,Niessen W,Hernandez F.RapidCommun.MassSpectrom.,2005,19(2):169-178.[25] Bueno M J M,Ulaszewska M M,Gomez M J,Hernando M D,Fernandez-Alba A R.J.Chromatogr.A,2012,1256(21):80-88.
[26] Tan H P,Tan F Y,Zou Y,Wang Y J,Zhao A P,Zhou L L.Chin.Measur.Test.Technol.(谭和平,谭福元,邹燕,王彧婕,赵爱平,周黎黎.中国测试),2011,37(4):37-40.
[27] Krauss M,Singer H,Hollender J.Anal.Bioanal.Chem.,2010,397(3):943-951.
Screening on Non-targeted Comporcents in Feed Using High Performance Liquid Chromatography Time-of-Flight Mass Spectrometry Combined with Chemometrics
HOU Can,QIU Jing*,CHENG Yong-you,ZHAO Lu-yao,YANG Shu-ming*
(Institute of Quality Standard and Testing Technology for Agro-products,Chinese Academy of Agricultural Sciences,Beijing 100081,China)
To screen feed for new or unexpected contaminants at the ppm level,a generic method was developed.The sample was extracted with 0.1%EDTA-acetonitrile-methanol (1∶1∶1,containing 0.1% formic acid) ,and analyzed by high-performance liquid chromatography coupled to electrospray ionization time-of-flight mass spectrometry(HPLC-Q-TOF/MS) in positive ionization mode.The data were collected after peak alignment (mass error within 50 mDa) ,noise filtration,elimination of useless peaks and statistical evaluation was performed based on Orthogonal Partial Least Squares Discriminant Analysis (OPLS-DA) .According to the score plot,S-plot and VIP,blind statistical evaluation revealed that feed samples could be separated regarding unknown components by OPLS-DA and them/z-retention time pair.With the assistance of MS/MS data,isotope abundance ratio,formula generation and self-built spectral library,the structures of unknown compounds were confirmed.The results showed that 27 veterinary drugs were screened out from 16 feed samples.By quantitative analysis of 12 existing veterinary drugs using liquid chromatography tandem mass spectrometry(LC-MS/MS) ,only two false positives appeared in the verification results,and the concentration levels of 12 veterinary drugs were between 12.5 mg/kg and 152.0 mg/kg.From the perspective of the results,TOF-MS data and OPLS-DA could be applied in the non-targeted screening of veterinary drugs in feed samples with high accuracy.
liquid chromatography quadrupole time-of-flight mass spectrometry (LC-Q-TOF/MS) ;non-targeted screening;orthogonal partial least squares discriminant analysis(OPLS-DA);feed;veterinary drugs
2016-04-18;
2016-06-10
农业部行业科技项目(201203023)
10.3969/j.issn.1004-4957.2016.11.007
O657.63;TQ460.72
A
1004-4957(2016)11-1409-07
*通讯作者:杨曙明,博士,研究员,研究方向:农产品质量安全检测技术,Tel:010-82106561,E-mail:yangshumingcaas@sina.com 邱 静,博士,研究员,研究方向:农产品风险评估与监测,Tel:010-82106551,E-mail:qiujing@caas.cn

