CXCR4/CXCL12信号途径在食管鳞癌浸润转移中的作用机制
周玉汀 田 辉
CXCR4/CXCL12信号途径在食管鳞癌浸润转移中的作用机制
周玉汀1田 辉2
目的 研究趋化因子受体4(CXCR4)/趋化因子12(CXCL12)信号途径在食管鳞癌浸润转移中的作用机制,为探讨CXCR4成为食管癌治疗新的靶点提供理论依据。方法 取对数生长期的食管鳞癌EC9706细胞,添加趋化因子CXCL12,通过侵袭转移实验、黏附实验分别检测食管鳞癌EC9706细胞株的细胞侵袭、移动和黏附能力。采用RT-PCR和Western Blot技术检测表皮生长因子受体(EGFR)mRNA及蛋白的表达水平。结果 添加不同浓度趋化因子CXCL12(终浓度为5、10μg/ml),食管鳞癌EC9706细胞株的细胞侵袭、移动和黏附能力均较空白对照组高,并且存在剂量依存关系,即CXCL12浓度越高,细胞的侵袭、移动、黏附能力越强,差异均有统计学意义(P<0.01)。添加不同浓度趋化因子CXCL12,食管鳞癌细胞的EGFR mRNA和蛋白表达水平均较对照组高,并且存在剂量依存关系,即CXCL12浓度越高,EGFR mRNA和蛋白表达水平越高,差异均有统计学意义(P<0.01)。结论 CXCR4/CXCL12信号途径与食管鳞癌细胞的侵袭、转移相关,并且存在剂量依存关系,有可能通过调控EGFR的表达参与食管鳞癌的浸润转移。
食管鳞状细胞癌; 趋化因子受体4; 趋化因子12; 表皮生长因子受体; 肿瘤侵袭; 肿瘤转移
我国是世界上食管癌发病率最高的地区。趋化因子受体4(chemokine receptor 4,CXCR4)是趋化因子12(chemotactic factor 12,CXCL12)的特异性趋化因子受体,研究表明[12],CXCR4/CXCL12调节多种肿瘤细胞的增殖,CXCR4可能会成为食管癌治疗新的靶点。表皮生长因子受体(epidermal growth factor receptor,EGFR)的高表达可促进血管生成和肿瘤细胞的增殖、黏附、侵袭和转移,抑制肿瘤细胞的凋亡,与多种肿瘤的发生、发展密切相关。
本实验采用食管鳞癌EC9706细胞,添加趋化因子CXCL12,通过侵袭实验、黏附实验分别检测食管鳞癌EC9706细胞株的细胞侵袭、移动和黏附能力,同时采用RT-PCR和Western Blot技术检测EGFR mRNA和蛋白的表达水平,进一步深入研究CXCR4/CXCL12信号途径在食管鳞癌浸润转移中的作用及机制,为探讨CXCR4成为食管癌治疗新的靶点提供理论依据。
材料与方法
一、材料
细胞株和细胞培养:食管鳞癌EC9706细胞株由中科院上海细胞生物研究所提供,采用含10%小牛血清的RPMI-1640培养液进行细胞培养。
二、方法
1.体外细胞预处理及分组:取处于对数生长期的细胞,常规胰酶消化,接种于培养板中,培养12h后分别添加趋化因子CXCL12,使其终浓度为10和5μg/ml,另设空白培养基作阴性对照。体外细胞黏附试验及侵袭转移试验采用96孔板,细胞EGFR mRNA及蛋白检测采用9孔板。
2.体外细胞黏附试验:96孔板中分别滴加含2μg Matrigel的RPMI1640培养基50μl,每孔加入无血清培养液20μl,采用PBS处理,之后每孔分别加入经处理后的细胞,以1×106/ml接种,每组细胞设3个复孔,孵育1h,洗去未黏附细胞。每孔加入50μl 0.04%结晶紫染液,PBS洗涤后,光学显微镜(×200)观察成像。每孔加入10%冰醋酸100μl,抽取结晶紫染液10min,于多功能酶标仪560nm处检测吸光度值。
3.体外细胞侵袭转移试验:Transwell小室上室面加入5μg Matrigel包被,在下室面铺10μl纤维黏连蛋白,向小室加入含1%BSA的无血清培养基,孵育2h,使基质胶再水化。食管鳞癌EC9706细胞培养至对数生长期,用无血清RPMI 1640培养基继续培养12h,取细胞,将细胞胰酶消化,制成细胞悬液。将细胞悬液接种到Transwell小室,用棉签轻轻擦除Matrigel基质胶和上室面未侵袭的细胞,以0.1%结晶紫染色,中性树胶将膜封于载玻片上。光学显微镜(×200)观察并成像,400倍显微镜下每膜随机计数10个视野侵袭细胞数,取平均值为每种细胞的侵袭转移数。侵袭细胞数=小室膜黏附细胞数+孔内细胞数。
4.PCR-PCR检测细胞EGFR mRNA的表达:PCR引物由生工生物工程(上海)股份有限公司合成。EGFR引物序列:5’-GGACGACGTGGTGGATGCCG-3’(上游引物);5’-GGCGCCTGTGGGGTCTGAGC-3’(下游引物)。内参照为人β-actin,引物序列:5’-AACTCCATCATGAAGTGTGA-3’(上游引物);5’-ACTCCTGCTTGCTGATCCAC-3’(下游引物)。
加入Trizol,提取细胞总RNA,反转录合成cDNA,以试剂盒提供的对照RNA反转录作为阳性对照,监测整个反转录反应体系。按RevertAidTMFirst Strand cDNA Synthesis Kit说明书操作。cDNA模板2μl,10μmol/L的上下游引物各lμl,2×PCR TaqMix 12.5μl,充分混匀后,于PCR仪上进行PCR扩增。EGFR的PCR产物长度为208bp,β-actin PCR产物长度为247bp。扩增产物琼脂糖凝胶电泳检测,扩增产物条带用凝胶成像分析系统作光密度(OD)测定,用目的基因与β-actin光密度的比值作为目的基因mRNA的相对含量,并与Marker对照,观察扩增效果。
5.Western blotting检测细胞EGFR蛋白的表达:每孔细胞样本加入100μl细胞裂解液,裂解物移入离心管中。取5μl样本加入5μl 2×SDSPAGE加样缓冲液,100℃加热处理5min,冰上冷却。样品使用10%SDS-PAGE分离,每孔上样量为20μl。电泳结束后,将PVDF膜在甲醇中浸泡1min,再使用Transfer Buffer浸泡凝胶、滤纸和在甲醇中浸泡过的PVDF膜10min,然后制备转移三明治。进行半干电泳转移,转移条件为30mA 60min。转移完毕后,用膜染色液染色并标记蛋白质Marker的条带位置。免疫反应,用0.01mol/LPBS洗膜,加入包被液;弃包被液,PBS洗膜,加入一抗;(阴性对照:以1%BSA取代一抗)弃一抗和1%BSA,PBS洗膜;加入辣根过氧化物酶偶联的二抗;弃二抗,PBS洗膜。进行化学发光检测,X线片曝光。显影定影处理后,胶片用凝胶成像分析系统拍照,使用Gel-Pro Analyzer软件分析处理。
三、统计学分析
采用SPSS 17.0统计软件处理数据,计数资料用n(%)表示,两样本率的比较采用四格表资料的χ2检验;多样本率的比较采用行×列表χ2检验;计量资料以x±s表示,两样本比较采用t检验和方差分析。P<0.05表示差异有统计学意义。
结 果
一、癌细胞与细胞外基质(extracellular matrix,ECM)的黏附能力
细胞黏附试验结果显示,食管鳞癌EC9706细胞经不同处理后与ECM的黏附能力不同。图1显示,添加空白培养基以及趋化因子CXCL12 5、10 μg/ml黏附细胞的平均光密度值分别为0.12± 0.021、0.25±0.011和0.38±0.006,癌细胞与ECM的黏附能力有显著性差异,其中添加趋化因子CXCL12 10μg/ml表现出与ECM更强的黏附能力,空白培养基最弱,三者之间两两比较差异有统计学意义(F=809.75,P﹤0.001)。试验结果表明,癌细胞与ECM的黏附能力与趋化因子CXCL12密切相关,并且存在剂量依存关系,即CXCL12浓度越高,癌细胞与ECM的黏附能力越强。
二、CXCL12与其受体CXCR4结合,可提高癌细胞的侵袭、迁移能力
图2显示,经不同处理后癌细胞的侵袭、迁移能力显著不同。添加空白培养基及5、10μg/ml趋化因子CXCL12,癌细胞穿过人工基膜的细胞数分别为5.3±1.8,18.9±2.1和41.2±4.6,其中添加10μg/ml趋化因子CXCL12表现出更强的侵袭、迁移能力,空白培养基最弱,三者之间两两比较差异有统计学意义(F=338.25,P<0.001)。这一结果同细胞黏附实验结果一致,充分证明添加不同浓度趋化因子CXCL12与细胞的侵袭、迁移能力密切相关,并且存在剂量依存关系,CXCL12浓度越高,癌细胞侵袭、迁移能力越强。

图1 细胞黏附实验:添加不同浓度CXCL12后癌细胞与ECM的黏附能力(×200)。A:空白对照;B:添加趋化因子CXCL12 5μg;C:添加趋化因子CXCL12 10μg。
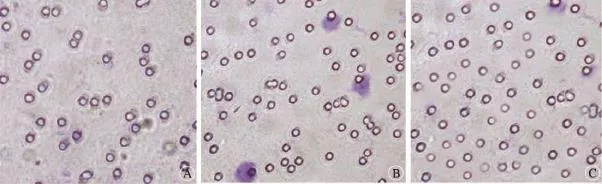
图2 Transwell小室检测添加不同浓度CXCL12癌细胞是侵袭、迁移能力(×200)。A:空白对照;B:添加趋化因子CXCL12 5μg;C:添加趋化因子CXCL12 10μg。
三、CXCL12与其受体CXCR4结合,癌细胞的EGFR mRNA表达增强
1.RNA纯度和完整性分析:RNA经双光束紫外分光光度计检测,所有样本A260nm/A280nm的比值均在1.8~1.9,表明所提取的总RNA纯度好,可用于下一步的反转录及实时荧光定量PCR扩增。RNA琼脂糖凝胶电泳显示,28S、18S、5S条带清晰,表明所提取的总RNA完整性好,无降解(图3)。

图3 RNA琼脂糖凝胶电泳图
2.EGFR mRNA的表达水平:图4显示,经不同处理后,癌细胞的EGFR mRNA表达水平显著不同,经内参β-actin标准化后,添加空白培养基以及5、10μg/ml趋化因子CXCL12,与其比值分别为0.103±0.044、0.851±0.167和1.114±0.732,其中添加趋化因子CXCL12 10μg/ml表现出更强的mRNA表达,空白培养基最弱,三者之间两两比较差异有统计学意义(F=14.62,P﹤0.001)。试验结果表明,癌细胞EGFR mRNA表达水平与趋化因子CXCL12密切相关,并且存在剂量依存关系,CXCL12浓度越高,癌细胞的EGFR mRNA表达水平越强。

图4 RT-PCR技术检测EGFR mRNA的表达水平
四、CXCL12与其受体CXCR4结合,癌细胞EGFR蛋白的表达水平增强
图5显示,经不同处理后,癌细胞EGFR蛋白表达水平显著不同,经内参β-actin标准化后,添加空白培养基以及5、10μg/ml趋化因子CXCL12后,与其比值分别为0.065±0.033、0.443±0.101和0.907±0.226,其中添加趋化因子CXCL12 10μg/ml表现出更强的蛋白表达,空白培养基最弱,三者之间两两比较差异有统计学意义(F=85.26,P<0.001)。实验结果表明,癌细胞EGFR蛋白表达水平与趋化因子CXCL12密切相关,并且存在剂量依存关系,CXCL12浓度越高,癌细胞的EGFR蛋白表达越强。
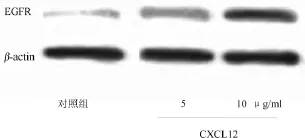
图5 Western Blot检测EGFR蛋白的表达水平
讨 论
趋化因子(chemokines)是一类分泌型的小分子多肽,在抗感染免疫中起着关键作用,还能影响血管的生成、胶原的产生及造血干细胞的增殖等[3]。CXCR4是最常见的趋化因子受体,并且是CXCL12的特异性α趋化因子受体[4]。研究显示:CXCL12-CXCR4轴能发挥多种作用,如介导炎症细胞跨膜迁移、对T淋巴细胞增殖起共刺激作用和参与慢性炎症发生,作为T细胞人类免疫缺陷病毒(human immunodeficiency virus,HIV)-1的共受体作用,参与白细胞浸润、细胞迁移和器官发育等[5]。CXCL12/CXCR4生物学轴在包括食管癌、胃癌等在内的多种实体瘤的生长、播散、器官特异性转移及肿瘤免疫抑制中发挥作用,与恶性肿瘤的发生、发展及预后密切相关[6]。CXCL12在肝、肺、乳腺、淋巴结、骨髓组织内强表达。高表达CXCR4的恶性肿瘤细胞,可能在CXCL12趋化、牵引下转移至作为配体产生源的某些器官,而特异性转移至以上器官。阻断CXCR4的作用可以抑制肿瘤的发生和远处转移[78]。
成纤维细胞是基质中分泌CXCL12的主要细胞,研究发现肿瘤组织中成纤维细胞分泌的CXCL12明显升高,内皮祖细胞通过血液循环,趋化到达肿瘤病灶,并进一步作用于CXCR4,促使CXCR4表达上调[9]。本实验通过体外细胞黏附试验及侵袭转移试验,结果充分说明添加不同浓度趋化因子CXCL12与癌细胞的侵袭、迁移能力密切相关,并且存在剂量依存关系,即CXCL12浓度越高,癌细胞侵袭、迁移能力越强。而CXCL12作用于CXCR4,使CXCR4表达上调,进而通过刺激肿瘤细胞生长、趋化肿瘤细胞以及促进血管生长和消化ECM的间接作用,促进肿瘤生长、侵袭和转移。实验结果表明,CXCR4/CXCL12信号途径与肿瘤的侵袭、转移相关。
RT-PCR和Western Blot实验结果表明,癌细胞的EGFR mRNA和蛋白表达水平与趋化因子CXCL12密切相关,并且存在剂量依存关系,CXCL12浓度越高,EGFR mRNA及蛋白表达越强。EGFR是一种膜表面传感器,具有酪氨酸蛋白激酶的活性,其本身是原癌基因表达的产物。EGFR与表皮生长因子(epidermal growth factor,EGF)结合,可以导致细胞内酪氨酸蛋白激酶活化,激活一系列信号转导通路,细胞出现异常增殖和凋亡障碍,并促进肿瘤的形成和进展。试验结果表明,CXCR4基因有可能通过调控EGFR的表达参与食管鳞癌的浸润转移,是其参与食管鳞癌浸润转移的可能机制之一。Porcile等[10]在卵巢癌的研究中证实CXCR4活化诱导EGFR磷酸化,依次激活细胞内激酶ERKl/2、Akt。另外细胞内酪氨酸激酶也参与了CXCL12/CXCR4-EGFR的转活,提示EGFR也在CXCL12/CXCR4细胞增殖的途径中发挥作用。Dutton等[11]应用针对EGFR靶点的治疗药物吉非替尼及安慰剂治疗化疗后进展的食管癌患者,发现吉非替尼组吞咽疼痛症状缓解更明显。Meng等[12]研究报道,应用另一种针对EGFR靶点的治疗药物西妥昔单抗联合同步放化疗治疗食管癌55例,效果良好,不良反应未增加。黄镜等[13]报道用另一种EGFR激酶抑制剂埃克替尼治疗EGFR过表达或扩增的晚期食管癌,展现出良好的抗肿瘤活性和安全性。已有多项研究显示EGFR在食管癌中高表达,意味着为食管癌的靶向治疗提供了潜在的选择。
目前研制有关阻断CXCL12/CXCR4轴的药物已引起了人们的高度关注[14],CXCL12中和抗体、CXCR4受体拮抗剂[15]、通过RNA干扰技术抑制CXCR4基因[16]、CXCR4抑制剂AMD3100等可阻断异常的信号转导通路[17]。应用慢病毒介导shRNA静默CXCR4可有效地抑制食管鳞癌细胞生长,提高凋亡率,有效地抑制食管癌的转移能力[18]。食管癌靶向治疗正处在一个起步阶段,研究还相对较少,以CXCL12/CXCR4轴为靶点治疗的方法值得期待。
1 Raman D,Baugher PJ,Thu YM,Richmond A.Role of chemokines in tumor growth.Cancer Letters[J].2007;256(2):137-165.
2 Shrivastava MS,Hussain Z,Giricz O,et al.Targeting chemokine pathways in esophageal adenocarcinoma[J].Cell Cycle.2014,13(21):3320-3327.
3 Charo IF,Ransohoff RM.The many roles of chemokines and chemokine receptors in inflammation[J].N Engl J Med,2006,354(6):610-621.
4 Smith H,Whittall C,Weksler B,et al.Chemokines stimulate bidirectional migration of human mesenchymal stem cells across bone marrow endothelial cells[J].Stem Cells Dev,2012,21(3):476-86.
5 Balkwill F.The significance of cancer cell expression of the chemokine receptor CXCR4[J].Semin Cancer Biol,2004,14(3):171-179.
6 Zhao H,Guo L,Zhao H,et al.CXCR4over-expression and survival in cancer:A system review and meta-analysis[J].Oncotarget,2015,6(7):5022-5040.
7 Monica C,Claudia P,Franziska T,et al.Emerging targets in cancer management:Role of the CXCL12/CXCR4axis[J].Onco Targets Ther,2013,6:1347-1361.
8 Furusato B,Rhim J S.CXCR4and cancer.[J].Pathol Int,2010,60(7):497-505.
9 Sun X,Cheng G,Hao M,et al.CXCL12/CXCR4/CXCR7 chemokine axis and cancer progression[J].Cancer Metastasis Rev,2010,29(4):709-722.
10 Porcile C,Bajetto A,Barbieri F,et al.Stromal cell-derived factor-1alpha(SDF-1alpha/CXCL12)stimulates ovarian cancer cell growth through the EGF receptor transactivation[J].Exp Cell Res,2005,308(2):241-253.
11 Dutton SJ,Ferry DR,Blazeby JM,et al.Gefitinib for oesophageal cancer progressing after chemother-blind,placebocontrolled randomised trial[J].Lancet Oncol,2014,15(8):894-904.
12 Meng X,Wang J,Sun X,et al.Cetuximab in combination with chemoradiotherapy in Chinese patients with non-resectable,locally advanced esophageal squamous cell carcinoma:a prospective,multicenter phase II trail[J].Radiother Oncol,2013,109(2):275-80.
13 Jing H,Xi W,Haitao N,et al.Predictive value of EGFR overexpression and gene amplification on icotinib efficacy in patients with advanced esophageal squamous cell carcinoma[J].Oncotarget,2016,17(7)24744-24751.
14 Vela M,Aris M,Llorente M,et al.Chemokine receptorspecific antibodies in cancer immunotherapy:achievements and challenges[J].Front Immunol,2015,6:12.
15 Patrick B,Arlt M J E,Carmen C,et al.CXCR4antibody treatment suppresses metastatic spread to the lung of intratibial human osteosarcoma xenografts in mice[J].Clin Exp Metastasis,2014,31(3):339-349.
16 陆航,刘学政,孙巨峰.RNA干扰沉默CXCR4基因对胃癌细胞SGC7901增殖和侵袭力的影响[J].中国老年学杂志,2012,32(13):2764-2766.
17 沈照华,曾东风,邹仲敏,等.AMD3100阻断SDF-1/CXCR4信号通路对白血病细胞与成骨龛黏附及耐药性的影响[J].中华血液学杂志,2015,36(5):413-417.
18 汪道峰,娄宁,李小东,等.慢病毒介导shRNA静默CXCR4对Eca109细胞转移特性的影响[J].中山大学学报:医学科学版,2010,31(6):761-766.
Mechanism of CXCR4/CXCL12 signaling pathway in invasion and metastasis of esophageal squamous
carcinoma Zhou Yuting1,Tian Hui2.1Department of Thoracic Surgery,Zibo Central Hospital,Zibo 255036,China;2Department of Thoracic Surgery,Qilu Hospital of Shandong University,Jinan 250012,China
Tian Hui,Email:tianhuiql@126.com
Objective To explore the mechanism of chemokine receptor 4(CXCR4)/chemotactic factor 12(CXCL12)signaling pathway in invasion and metastasis of esophageal squamous carcinoma so as to provide theoretical basis for CXCR4as a new target in tumor treatment.Methods Esophageal squamous carcinoma EC9706cells in logarithmic phase were treated with CXCL12,and the invasion,migration and adhesion capabilities of EC9706cells were assessed by the assays of cell adhesion and transwell chamber.RT-PCR and Western Blot were performed to determine the expression of epidermal growth factor receptor(EGFR)mRNA and protein.Results The capabilities of invasion,migration and adhesion of EC9706cells increased with the concentrations of CXCL12(5,10μg/ml)in a dose-dependent manner(P<0.01),and were significantly higher than those of blank controls(P<0.01).The expression of EGFR mRNA and protein in EC9706cells increased with the concentrations of CXCL12in a dose-dependent manner(P<0.01),and was significantly higher than that of controls(P<0.01).Conclusions CXCR4/CXCL12signaling pathway is related to tumor invasion and metastasis,which exhibits a dose-dependent relationship.CXCR4/CXCL12signaling pathway may participate in the invasion and metastasis of esophageal squamous cell carcinoma via regulating the expression of EGFR.
Esophageal squamous cell carcinoma; Chemokine receptor 4; Chemotactic factor 12;Epidermal growth factor receptor; Tumor invasion; Tumor metastasis
2016-03-25)
(本文编辑:周珠凤)
10.3877/cma.j.issn.2095-8773.2016.04.08
255036 淄博市中心医院胸外科1;250012 济南,山东大学齐鲁医院胸外科2
田辉,Email:tianhuiql@126.com
周玉汀,田辉.CXCR4/CXCL12信号途径在食管鳞癌浸润转移中的作用机制[J/CD].中华胸部外科电子杂志,2016,3(4):228-233.

