干旱胁迫对老芒麦DNA表观遗传变化的MSAP分析
闫伟红,马玉宝,陈 云,王 凯,孟庆伟,张晶然
(1.中国农业科学院 草原研究所/农业部牧草资源与利用重点实验室,内蒙古 呼和浩特 010010; 2.曲阜
师范大学 生命科学学院,山东 曲阜 273165; 3.内蒙古商贸职业学院,内蒙古 呼和浩特 010010;
4.呼和浩特职业学院,内蒙古 呼和浩特 010010)
干旱胁迫对老芒麦DNA表观遗传变化的MSAP分析
闫伟红1,马玉宝1,陈云2,王凯1,孟庆伟3,张晶然4
(1.中国农业科学院 草原研究所/农业部牧草资源与利用重点实验室,内蒙古 呼和浩特010010; 2.曲阜
师范大学 生命科学学院,山东 曲阜273165; 3.内蒙古商贸职业学院,内蒙古 呼和浩特010010;
4.呼和浩特职业学院,内蒙古 呼和浩特010010)
摘要:经田间旱作选育发现,老芒麦物候期较长、植株高大、叶量丰富、穗大、牧草产量高、抗逆性较强、适应北方干旱与半干旱气候条件生长。试验采用土壤模拟干旱胁迫方法,处理18号和153号优质老芒麦材料,并对其基因组DNA进行甲基化敏感扩增多态性(MSAP)分析。结果表明:老芒麦基因组中约有58.2%~85.5%的 CCGG位点发生了胞嘧啶甲基化;随着干旱处理强度的增加,基因组DNA发生甲基化变化的位点的比率持续上升;甲基化水平及状态变化存在材料差异性。由此推论,DNA去甲基化是植物耐旱机制的一部分。
关键词:老芒麦;MSAP;干旱胁迫;DNA甲基化
表观遗传指DNA序列不发生变化但基因表达却发生了可遗传的改变,即基因型未发生变化而表型却发生了改变,是一种DNA序列外的遗传方式[1]。DNA甲基化作为其中一种重要方式在外源基因防御、基因表达调控、个别基因表达模式的遗传等途径中起着重要的作用[2]。胁迫条件下,核基因组胞嘧啶和腺嘌呤上可增加或减少甲基基团,修饰并未改变DNA序列,但影响了位点理化性质,形成了“表观座位”,通过改变染色质空间构象、基因表达产生“表观性状”[3]。这种现象虽然具有可逆性,但DNA甲基化比较稳定,一旦形成将可以延续若干个世代。由于其随机性变异较小,因而这种表观遗传改变可能引起胁迫诱导的基因进化[4-6]。
甲基化敏感扩增多态性(MSAP)是改良的AFLP技术[7],由2种对甲基化敏感程度不同的限制性内切酶HpaⅡ和MspⅠ对5′-CCGG位点甲基化特异性切割,因其能够有效检测出样品DNA中大量的甲基化位点,多态性高,引物设计简单,无需知道所分析的DNA序列,即可对全基因组范围内胞嘧啶甲基化程度进行分析,又能检测DNA片段特异性位点甲基化状态的特性[8]。利用该技术,前人研究了多种植物在盐、重金属、干旱、低温胁迫、病原物侵染等逆境条件下的DNA甲基化水平,发现在逆境条件下DNA甲基化的程度和状态均会发生改变[9]。目前,众多国内外学者已经用此技术检测了黑麦、水稻、小麦、棉花、萝卜、银杏、毛竹、高粱、油菜、石斛、辣椒等植物的甲基化状态[9-19]。
老芒麦(Elymussibiricus),别名西伯利亚野麦草,是披碱草属的模式种[20],多年生疏丛型中旱生植物,在年降水量为400~500 mm的地区,可行旱地栽培。大量研究表明,老芒麦具有较高的粗蛋白含量和消化率,较好的适口性,易栽培,适应性强,在建造人工放牧草地方面价值较高;严重旱灾时仍获33.33 kg/hm2干草的高产[21,22]。试验将对经多年田间旱作评价发现物候期较长、植株高大、叶量丰富、穗大、牧草产量高、抗逆性较强、遗传多样性丰富[23]、适应北方干旱与半干旱气候条件生长的老芒麦幼苗种质材料进行抗旱性分子机制研究,进一步探讨干旱胁迫下老芒麦幼苗基因组 DNA甲基化水平和状态的变化及规律,为从 DNA水平上揭示老芒麦对干旱胁迫响应机制提供依据。
1材料和方法
1.1材料培育与干旱处理
供试老芒麦材料18号来源于新疆伊犁州特克斯县城北种牛场,153号来源于山西右玉。
供试材料挑选均匀一致的种子种植到直径18 cm的花盆中。控制条件为光照14 h/26℃,黑暗10 h/18 ℃,相对湿度均为50%,温室正常生长,生长期间按常规进行统一管理,幼苗材料长至8~10 cm时开始处理。采用盆栽法模拟土壤干旱进行处理[24],在处理前3 d对所有材料进行浇水,使每盆土壤处于饱和含水状态,以正常浇水(土壤含水量保持在38.877±2.25%)为对照(处理时间为0 d),干旱处理时间为4、6、8 d。取对照及不同处理的幼苗进行DNA的提取与MSAP分析,取样时间为早晨8∶00~9∶00。
1.2MSAP分析
基因组DNA的提取采用改良的CTAB法[25,26]。基因组DNA的酶切、连接、预扩增及选择性扩增,均采用付胜杰等[27]建立的小麦MSAP反应体系及程序。双酶切组合为EcoRⅠ/MspⅠ和EcoRⅠ/HpaⅡ,接头和预扩增引物序列(表1)。
酶切反应体系( 40 μL)500 ng模板DNA,15U EcoR,10U HpaⅡ(或MspⅠ),4 μL 10× T buff,0.8 μL BSA反应混合液在37℃保温3 h,然后80℃灭活20 min,-20℃保存备用。向上述反应液中,加入连接反应体系(50 μL)70U T4 DNA 连接酶,1.5 μL EcoRⅠ接头,1.5 μL HpaⅡ/ MspⅠ接头,1 μL DNA连接酶Buffer,1 μL BSA,16℃连接过夜,-20℃保存备用。
预扩增反应体系40 μL, 包括酶连产物稀释液4 μL,10× PCR Buffer 4 μL,10 mmol/μL dNTP 1μL,预扩增引物E1和H1(表1)各1.5 μL,1.5 UTaqDNA 聚合酶,以94℃ 30 s,56℃30 s,72℃ 1 min循环29次,扩增产物备用。
选择性扩增反应体系20 μL,为稀释20倍的预扩增产物2 μL,2 μL 10×PCR buff,10 mmol/μL dNTP 0.7 μL,选扩引物E2和HM2均是50 ng,0.5 UTaqDNA聚合酶。PCR 程序为94℃ 30 s, 65℃(每个循环下降0.7℃) 30 s,72℃ 1 min,共11个循环,接着94℃ 30 s,56℃ 30 s,72℃ 1 min,23个循环。变性后的产物采用6%变性聚丙烯酰胺凝胶电泳检测,电泳结束银染显色。
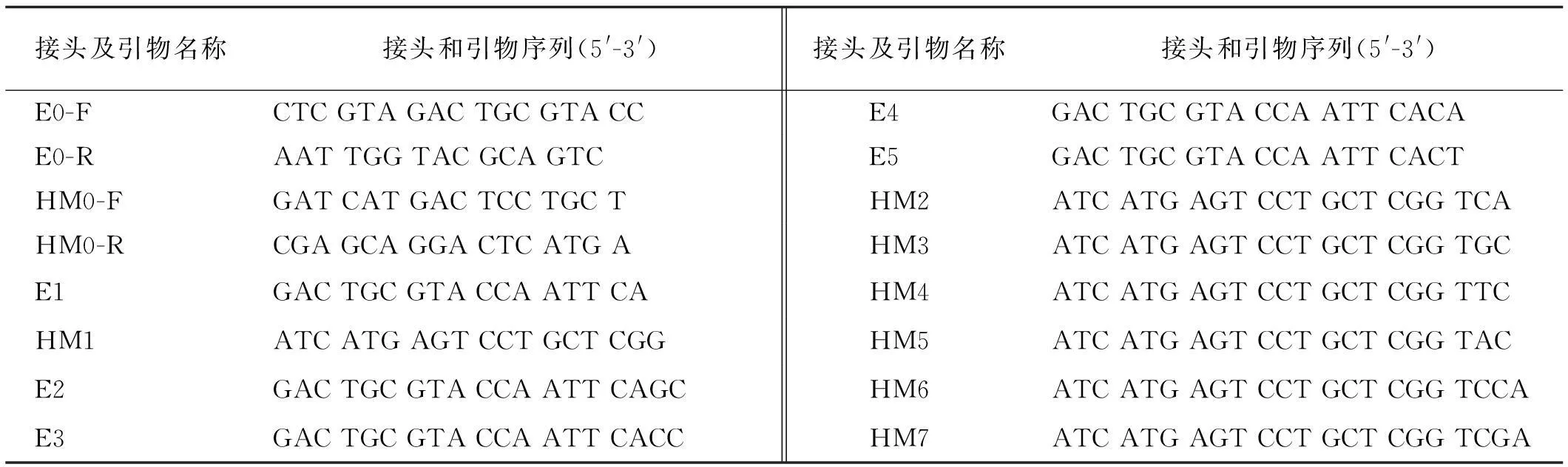
表1 试验所用接头和引物序列
1.3数据处理
基于MSAP方法的原理[28]HpaⅡ和MspⅠ对5′-CCGG-3′位点甲基化特异性切割的反应不同,前者能切割无甲基化和单链DNA甲基化,后者能切割无甲基化和内甲基化(双链DNA内部甲基化)。因此,对酶切片段进行MSAP分析能够反应酶切位点的甲基化状态及程度,根据这一原理以及所做的试验可得出同一DNA分别用 HpaⅡ和MspⅠ酶切后进行选择性扩增,在聚丙烯酰胺凝胶电泳分析胶上能检测出4种甲基化类型(图1),Ⅰ.H、M均无带,即该位点发生了双链外部甲基化;Ⅱ.H无带、M有带,即该位点发生了双链内部甲基化,即为全甲基化;Ⅲ.H有带、M无带,即该位点发生了单链外部甲基化,即为半甲基化;Ⅳ.H、M均有带,即该位点无甲基化发生。通过这些条带的比对,可得出不同样品 DNA甲基化状态的变化情况。
将凝胶上有带的地方标“1”,无带的地方标“0”,将凝胶上的条带转化为“1,0”矩阵后,分析其甲基化水平。
2结果与分析
2.1干旱胁迫对老芒麦DNA甲基化水平变化的影响
MSAP分子标记分析表明,经干旱胁迫后幼苗期的18号与153号材料的总DNA甲基化状态有一定差异,基因组CCGG位点发生的甲基化方式基本同时出现全增或全减的总甲基化和全甲基化(表2、3)。
2.2干旱胁迫后老芒麦基因组DNA甲基化水平变化状况
以24对选择性引物(表2)进行扩增,筛选出多态性丰富、重复性较好的15对引物,共扩增出多态性条带475条(表3),18号和153号材料甲基化总带数介于255~340,平均为304条,MSAP百分率介于58.2%~85.5%,平均为64%,其中,全甲基化百分率介于34.2%~45.5%,平均为39.9%,干旱处理0、4、6、8 d的MSAP(%)均值依次为57.6%,64.1%,69%,77.6%。随着处理时间的增加,土壤干旱胁迫能导致老芒麦幼苗基因组DNA胞嘧啶甲基化水平的增加,但是全甲基化率低于半甲基化率。

图1 选择性扩增的凝胶电泳图谱Fig.1 Gel electrophoresis atlas by selective amplification注:M.100bp DNA ladder;泳道从左往右依次为18号干旱处理0、4、6、8,153号干旱处理0、4、6、8 d;图中的Ⅰ、Ⅱ、Ⅲ、Ⅳ 分别对应表2中的4种条带类型
幼苗期干旱胁迫处理材料的DNA甲基化水平变化结果表明(表 2),与对照相比18和153号的幼苗干旱胁迫处理后甲基化程度(以MSAP%为标准)均有所增加,但增加程度不同,说明干旱胁迫对耐旱老芒麦幼苗甲基化程度有一定影响。2份材料甲基化率有所上升,而全甲基化率是先下降后上升,但是18号半甲基化率一直上升,而153号先上升后下降。18号材料的DNA甲基化水平胁迫前后的增幅大于153号材料,表明干旱胁迫诱导的DNA甲基化水平变化具有材料特异性。
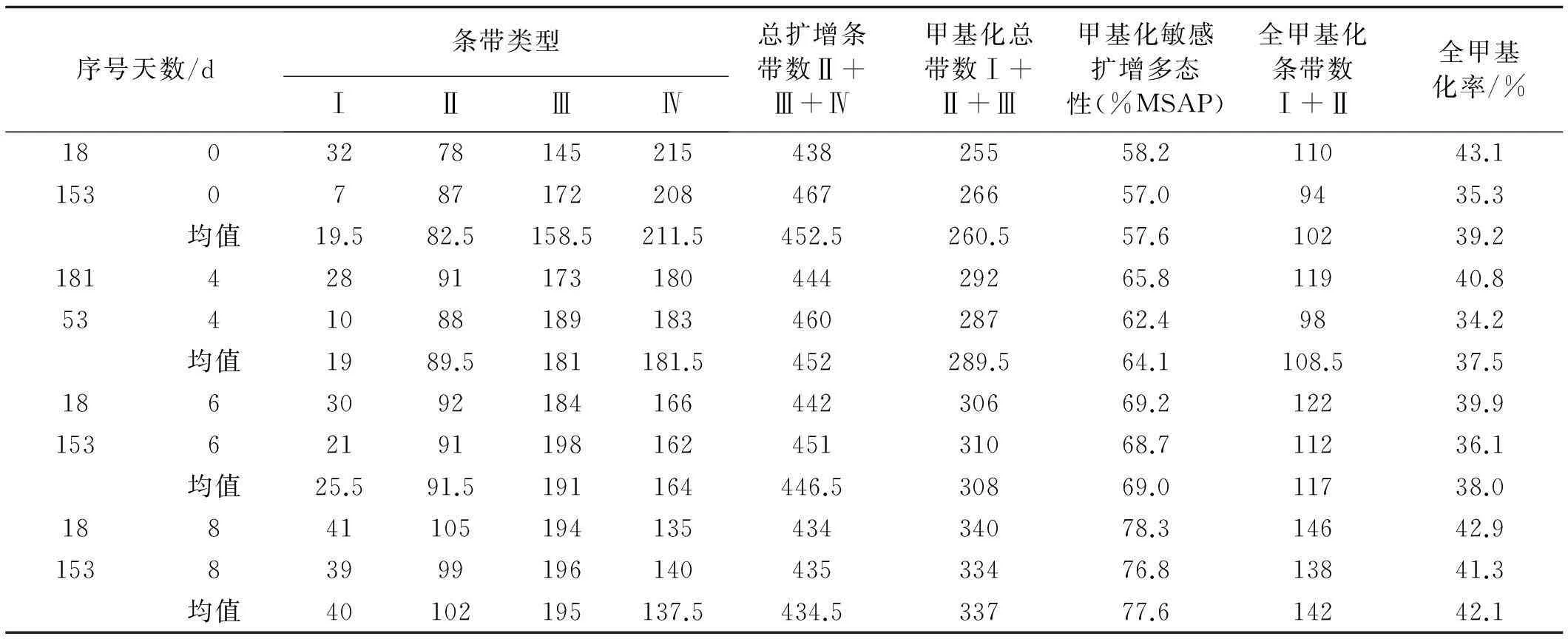
表2 老芒麦干旱胁迫处理下的DNA甲基化水平
2.3干旱胁迫对老芒麦DNA甲基化状态变化的影响
与对照相比,不同时间干旱胁迫的老芒麦幼苗基因组DNA甲基化带型变化有3类共11种带型(表3):A类为单态性条带,即处理与对照具有相同的甲基化位点,表明干旱处理未对这类位点的甲基化状态造成影响;B、C均为多态性条带,即处理组具有与对照组不同的甲基化位点,表明CCGG位点在干旱胁迫后甲基化状态发生了改变,其中,B类为甲基化带,即干旱胁迫导致老芒麦幼苗基因组DNA甲基化水平增加;C类为去甲基化带,即干旱胁迫导致老芒麦幼苗基因组DNA甲基化水平下降(表3)。干旱胁迫4,6和8 d的老芒麦幼苗材料MSAP分析所得的B型位点数分别为33、57、93,分别占总扩增条带数的7.3%,12.8%和21.4%;干旱胁迫4,6和8 d的老芒麦幼苗材料MSAP分析所得的C型位点数分别为3、7、7,分别占总扩增条带数的0.7%,1.6%和1.6%。相较于对照,干旱胁迫4,6和8 d的老芒麦幼苗材料总甲基化多态性分别为8%,14.4%和23%。结果表明,老芒麦幼苗基因组DNA甲基化多态性水平随着干旱胁迫处理时间的增加而增加。其中,发生甲基化的位点数随着干旱胁迫处理时间的增加而升高,但是干旱诱导的去甲基化位点数目先增加之后变化不大。玉米冷胁迫、水稻冷处理、棉花盐胁迫均使其基因组DNA发生了去甲基化[19]。由此证明,去甲基化可能是作为受环境因子调控的许多基因的公共开关,或者去甲基化可能是通过改变染色体的结构,调节基因表达,从而提高植物的耐逆性[19]。
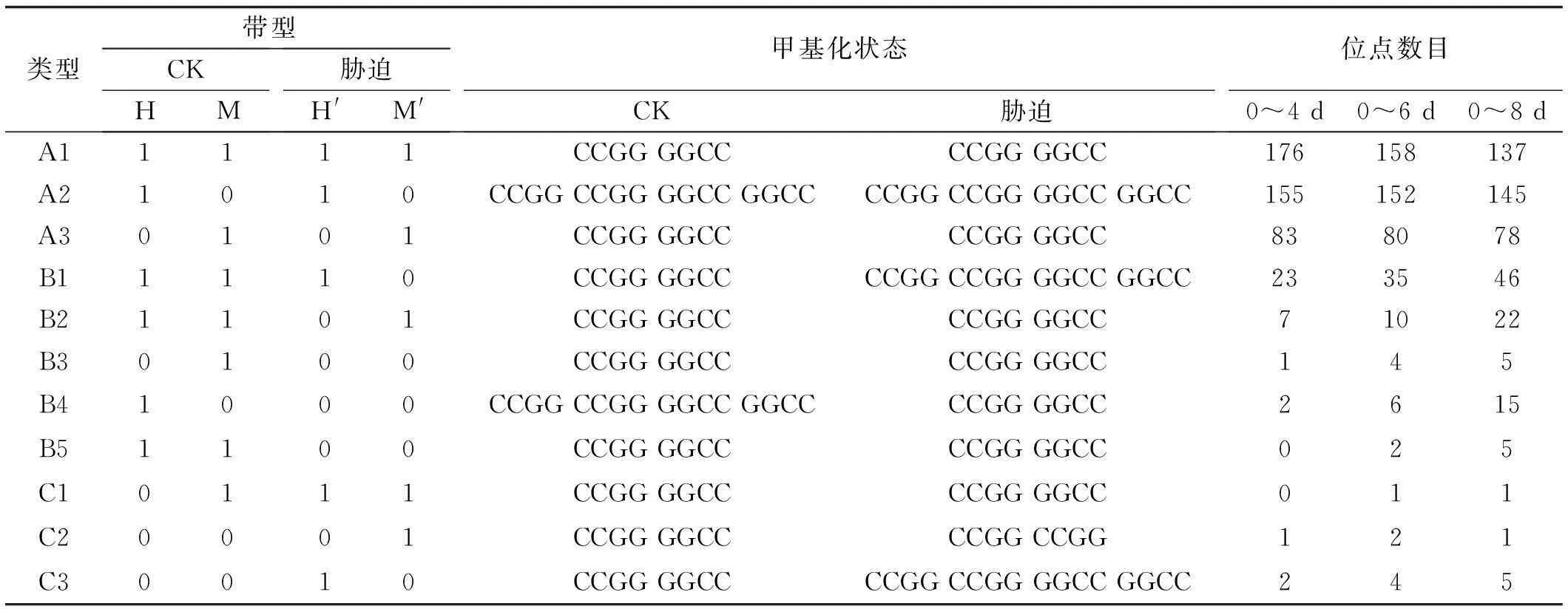
表3 干旱胁迫下老芒麦DNA甲基化状态
3讨论与结论
研究表明,DNA甲基化在植物生长发育中起重要作用,其甲基化状态异常会导致多种植物形态学变异或生理特性变化,可以影响植物株高、花器官发育、生育期、抗病性以及应对环境胁迫等[29-33]。Aina 等[9]的研究发现,重金属(Ni2+、Cd2+、Cr6+) 胁迫处理可诱导植物根部特定DNA 序列发生去甲基化,而小麦幼苗在受到盐害胁迫时,叶片和根的甲基化水平均会上升。杨蓓等[28]通过MSAP 分子标记检测表明,节节麦幼苗期的SL-1 和T-27经干旱处理和对照相比较,干旱处理后都能够引起DNA甲基化的增加;SL-1 的叶片甲基化水平明显提高,而材料T-27的根部甲基化水平增加。研究表明,老芒麦幼苗在土壤模拟干旱胁迫条件下,基因组甲基化水平与模式均发生了明显变化,对照组老芒麦MSAP(%)平均为57.6%,略高于其他高等植物基因组中大约20%~50%胞嘧啶的甲基化状态[34~37];胁迫处理材料甲基化程度较对照组均增加,但增加幅度不同,以此调控某些基因的表达来响应干旱胁迫。
通过对土壤干旱胁迫下老芒麦幼苗基因组DNA甲基化模式的分析,发现干旱处理和对照之间甲基化带型的变化以甲基化带型模式为为主。随着干旱处理强度的增加,基因组DNA发生甲基化变化的位点的比率持续上升,这与其他逆境胁迫下的DNA甲基化模式变化趋势一致[9]。
通过 MSAP分析发现,干旱胁迫后幼苗期的18号与153号2个材料的总DNA甲基化状态有一定差异,18号的DNA甲基化水平胁迫前后的增幅大于153号材料,检测发现基因组CCGG位点发生的甲基化方式基本同时出现全增或全减的总甲基化和全甲基化。不同时间土壤胁迫下老芒麦幼苗基因组中的胞嘧啶甲基化存在差异,由此推测,DNA去甲基化是植物耐旱机制的一部分,为进一步深入研究奠定基础。后续研究中还需要更多包含甲基化修饰的5′- CCGG- 3′序列的分离和基因功能分析,才能更深入地探讨干旱胁迫下老芒麦植物基因组DNA的甲基化及逆境适应的机制。
参考文献:
[1]Wu C T,Morris J R.Genes,genetics and epigenetics:acorrespondence[J].Science, 2001, 293: 1103-1105.
[2]Boyko A,Kovalchuk I.Epigenetic control of plant stress response[J].Environmental and Molecular Mutagenesis,2008,49:61-72.
[3]彭海,席婷,张静,等.胁迫条件下植物DNA甲基化稳定性[J].中国农业科学,2011,44(12):2431-2438.
[4]Kakutani T,Munakata K,Richards E J,etal.Meiotically andmitotically stable inheritance of DNA hypomethylation induced byddm1 mutation of Arabidopsis thaliana[J].Genetic,1999,151:831-838.
[5]Boyko A,Kathiria P,Zemp F J,etal.Transgenerational changes in the genome stability and methylation inpathogen-infected plants:Virus-induced plant genome instability[J].Nucleic Acids Research,2007,35:1714-1725.
[6]Cullis C A.Mechanisms and control of rapid genomic changes in flax[J].Annals of Botany,2005,95:201-206.
[7]Jaligot E,Beule T,Rival A,etal.Methylation-sensitive RFLPs:Characterizationof two oil palm markers showing somaclonal variation-associated polymorphism[J].Theor Appl Genet,2002,104:1263-1269.
[8]李卫国,常天俊,龚红梅,等.MSAP技术及其在植物遗传学研究中的应用[J].生物技术,2008,18(1):83-87.
[9]樊洪泓,李廷春,李正鹏,等.PEG 模拟干旱胁迫对石斛DNA表观遗传变化的MSAP分析[J].核农学报,2011,25(2) :0363-0368.
[10]张勇,邓科君,张韬,等.黑麦基因组DNA甲基化修饰位点的MSAP分析[J].麦类作物学报,2009,29(4):559-564.
[11]潘雅娇,傅彬英,王迪,等.水稻干旱胁迫诱导DNA甲基化时空变化特征分析[J].中国农业科学,2009,42(9):3009-3018.
[12]付胜杰,王晖,冯丽娜,等.叶锈菌胁迫下的小麦基因组MSAP分析[J].遗传,2009,31(3):297-304.
[13]李雪林,林忠旭,聂以春,等.盐胁迫下棉花基因组DNA表观遗传变化的MSAP分析[J].作物学报,2009,35(4):588-596.
[14]杨金兰,柳李旺,龚义勤,等.镉胁迫下萝卜基因组DNA甲基化敏感扩增多态性分析[J].植物生理与分子生物学学报,2007,33(3):219-226.
[15]王聪聪,邢世岩,李际红,等.不同单株叶籽银杏DNA甲基化水平与模式的MSAP分析[J].核农学报,2013,27(4):0399-0407.
[16]郭广平,顾小平,袁金玲,等.不同生理年龄毛竹DNA甲基化的MSAP分析[J].遗传,2011,33(7):794-800.
[17]段永红,王铭,孙毅,等.高粱甲基化连锁群A、B的构建集甲基化位点、甲基化模式的分析[J].中国农业科学,2012,45(18):3699-3708.
[18]孟华兵,杜雪,姜宇晓,等.镉胁迫下二倍体和同源四倍体油菜DNA甲基化差异分析[J].核农学报,2010,24(6):1297-1304.
[19]徐小万,雷建军,张长远,等.高温多湿胁迫下辣椒DNA甲基化分析[J].核农学报,2014,28(7):1175-1180.
[20]陈默君,贾慎修.中国饲用植物[M].北京:中国农业出版社,2002:121-122.
[21]龙兴发,蒋忠荣,李太强,等.康巴老芒麦新品种选育[J].草原与草坪, 2014, 34(1):86-89.
[22]王生文,史静,宫旭胤,等.播量与刈割次数对老芒麦产量及品质的影响[J].草原与草坪, 2014, 34(6):62-67.
[23]陈云,闫伟红,吴昊,等.干旱胁迫下老芒麦遗传多样性分析[J].草原与草坪, 2014,34(2):11-22.
[24]祁娟.披碱草属植物野生种质资源生态适应性研究[D].兰州:甘肃农业大学,2009.
[25]张文妤,曹社会,曹仲华,等.西藏披碱草属野生牧草种质资源的遗传多样性分析与分子聚类研究[J].西北农林科技大学学报(自然科学版),2008,36(6):39-44.
[26]Hewitt G M,Johnston A,Young J,etal.Molecular Techniques in Taxonomy[M].Berlin:Springer-Verlag Press,1991:283-293.
[27]付胜杰,王晖,冯丽娜,等.叶锈菌胁迫下的小麦基因组MSAP分析[J].遗传,2009,31(3):297-304.
[28]杨蓓.干旱胁迫对节节麦DNA甲基化的影响[D].郑州:河南大学,2011.
[29]Cubas P,Vincent C,Coen E,etal.An epigenetic mutation responsible for natural variation in floral symmetry [J].Nature,1999,401(6749):157-161.
[30]Manning k,Tor M,Poole M,etal.A naturally occurring epigenetic mutation in a gene encoding an SBP-box transcription factor inhibits tomato fruit ripening[J].Nat Genet,2006,38(8):948-952.
[31]Santos F,Hendrich B,Reik W,etal.Dynamic reprogramming of DNA methylation in the early mouse embryo[J].Devbiol,2002,241(1):172-182.
[32]Steimer A,Schob H,Grossniklaus U,etal.Epigenetic control of plant development:New layers of complexity[J].Curr Opin Plant Biol,2004,7(1):11-19.
[33]Boyko A,Kovalchuk L.Epigenetic control of plant stress response[J].Environ Mol Mutagen,2008,49(1):61-72.
[34]Chan S W L,Henderson I R,Jacobsen S E,etal.Gardening the genome:DNA methylation Arabidopsis thaliana[J].Nature Reviews Genetics,2005,6:51-360.
[35]Zhang X Y,Yazaki J,undaresan A,etal.Genomewide high-resolution mapping and functional analysis of DNA methylation in Arabidopsis[J].Cell,2006,12:1189-1201.
[36]Zilberman D,Gehring M,Tran R K,etal.Genome wide analysis of Arabidopsis thaliana a DNA methylation uncovers an interdependence between methylation and transcription[J].Nature Genetics,2007,39:61-69.
[37]郑晓国,陈亮,楼巧君,等.干旱驯化后节水抗旱稻苗期不同发育时间DNA甲基化模式变化分析[J].中国水稻科学,2014,28(1):32-40.
MSAP analysis of epigenetic changes ofElymussibiricusunder drought stress
YAN Wei-hong1,MA Yu-bao1,CHEN Yun2,WANG Kai1,MENG Qing-wei3,ZHANG Jing-ran4
(1.InstituteofGrasslandResearchofCAAS/KeyLaboratoryofGrasslandResourcesandUtilization,MinistryofAgriculture,Hohhot010010,China;2.CollegeofLifeScience,QufuNormalUniversity,Qufu273165,China;3.InnerMongoliaBusinessandTradeVocationalCollege,Hohhot010010,China; 4.HohhotVocationalCollege,Hohhot010010,China)
Abstract:The genomes of two Elymus sibiricus materials under simulate drought stress were analyzed by using methylation-sensitive amplified polymorphism (MSAP) technique. Results showed that 58.2% to 85.5% of cytosine methylation were in CCGG sequences in genome. The levels of DNA methylation and methylation polymorphism increased gradually along with the enhancement of drought stress. The level and pattern of DNA methylation were different among materials. It suggested that de-methylation could be a part of the resistant mechanism of plants response to drought-stress and could be used in further research work.
Key words:Elymus sibiricus;MSAP;drought-stress;DNA methylation
中图分类号:Q 945.7
文献标识码:A
文章编号:1009-5500(2016)01-0001-06
作者简介:闫伟红(1979-),女,内蒙古赤峰人,博士,副研究员,研究方向为牧草种质资源评价利用与育种。
基金项目:国家青年自然科学基金“不同纬度黄花苜蓿表观遗传多样性与低温胁迫下DNA表观遗传变化分析(31302017)”,中央级公益性科研院所基本科研业务费项目“黄花苜蓿遗传特性和低温下转录组与小RNA组分析(1610332015007、1610332014014)”资助
收稿日期:2015-06-18; 修回日期:2015-12-30
E-mail:yanweihong7037@163.com

