番茄早疫和晚疫病害病原菌鉴定及室内药剂的筛选
卢钟彦,梁巧兰,何武学
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业
可持续发展研究中心,甘肃 兰州 730070)
番茄早疫和晚疫病害病原菌鉴定及室内药剂的筛选
卢钟彦,梁巧兰,何武学
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业
可持续发展研究中心,甘肃 兰州730070)
摘要:对兰州市皋兰县高山村番茄连作田病害调查发现,其主要病害为早疫病和晚疫病,病原菌鉴定为茄链格孢(Alternaria solani)和致病疫霉菌( Phytophthora infestans);番茄早疫、晚疫病病菌在番茄葡萄糖琼脂培养基上生长最好;接种不同方式、番茄不同品种对晚疫病的抗性都存在一定差异,其中在有伤接种条件下番茄果实病斑扩展速度明显快于无伤接种;巨霸最感病,德富次之;捷美153最抗病;室内药剂筛选结果表明,10%苯醚甲环唑和72%霜脲·锰锌对番茄早疫病菌抑菌效果最好,抑菌率分别为100%和98.35%;10%烯酰吗啉和72%霜脲·锰锌对番茄晚疫病菌抑菌效果最好,抑菌率分别为98.71%和100%。
关键词:茄链格孢;致病疫霉菌;室内药剂筛选
番茄是一种重要的蔬菜作物,其适应范围广,广泛分布于世界各地,被列为全世界产量最高的30种农作物之一,营养丰富,富含维生素和糖类,既可生食又可加工,深受人们喜爱[1-2],番茄是喜温、喜光性蔬菜,对土壤条件要求不太严格,但为获得丰产,促进根系良好发育,应选用土层深厚,排水良好,富含有机质的肥沃壤土。番茄原产南美洲,在中国南北地区均广泛栽培[3-4]。
近年来,随着甘肃省农业产业结构的调整,番茄的栽培面积呈逐年扩大趋势,实现了周年供应。但由于该地相对稳定的土壤条件,加上种植年限延长,重茬、连作现象普遍,田间积累了大量的菌源,为各种病害的发生提供了十分有利的生存环境,加之一些菜农缺乏科学的病害防治知识,防治不及时、不到位,导致病害种类明显增多,病害发生逐年加重[5-7]。
在兰州市皋兰县主要以番茄早疫病、番茄晚疫病为主;番茄早疫病、晚疫病是2种流行性很强的真菌病害,主要为害番茄叶片和果实,严重时叶片脱落,减产30%,不仅影响产量和品质,同时给农户造成巨大的经济损失[8-11]。试验对番茄早疫病(Alternariasolani)和番茄晚疫病(Phytophthorainfestans)病原物进行了分离、纯化、培养、鉴定,并对2种病原菌进行了室内药剂筛选,旨在探明2种病害防治方法,以提高番茄的产量、质量和经济效益。
1材料和方法
1.1试验材料
1.1.1病样采集分别于2013年6~8月,对甘肃省兰州市皋兰县高山村番茄主要病害进行病样采集,采样时选择刚刚发病的叶片,装入一次性塑料袋内,每只塑料袋装一片叶子,用橡皮筋系住口部,置于冰盒内,带回实验室备用。
1.1.2供试药剂72%的霜脲·锰锌可湿性粉剂,中国农业科学院植保所廊坊农药中试厂;10%的苯醚甲环唑微乳剂,中国农业科学院植保所廊坊农药中试厂;722 g/L的霜霉威盐酸盐水剂,中国农业科学院植保所廊坊农药中试厂;10%的烯酰吗啉水乳剂,中国农业科学院植保所廊坊农药中试厂。
1.1.3供试幼苗播种番茄(品种巨霸、感病)于花盆,在实验室条件培养,待幼苗长到3~5片真叶时,备用。
1.1.4供试培养基(1)马铃薯葡萄糖琼脂培养基:200 g马铃薯,18 g琼脂,20 g葡萄糖,1 000 mL蒸馏水;(2)燕麦片琼脂培养基:30 g燕麦片,18 g琼脂,1 000 mL蒸馏水;(3)玉米粉琼脂培养基:30 g玉米粉,17 g琼脂,1 000 mL蒸馏水;(4)番茄葡萄糖琼脂培养基:200 g番茄,18 g琼脂,20 g葡萄糖,1 000 mL蒸馏水。
1.2试验方法
1.2.1病原菌分离纯化将采集到的病叶组织切成1 mm×2 mm正方形小块,先用75%乙醇溶液消毒30 s,然后再浸入15%的次氯酸中漂洗3 min,最后用无菌水冲洗3~4次,经表面消毒的病组织放置在PDA(含链霉素10 μg/1 000 mL)平板培养基,于25℃恒温箱培养,当产生孢子或菌丝时(约4~5 d),用灭菌的接种针挑取菌丝,移到新的PDA平板培养基上,直至菌落生长整齐一致无杂菌出现为止。
1.2.2致病性测定分离物采用赫柯氏法则进行致病性测定,将分离反复纯化好的2种典型分离物在超净工作台上用0.5 cm打孔器在菌落边缘打成菌饼,再回接到实验室种植的番茄幼苗叶片上,然后逐天观察番茄幼苗的发病情况,并且与田间发病症状作对照。
1.2.3病原菌鉴定根据病样分离物在PDA上菌落形态及光学显微镜(Nikon E200)进行形态特征观察,查阅相关文献,结合《真菌鉴定手册》[12]进行鉴定。
1.2.4不同培养基对番茄早疫、晚疫病菌生长的影响观察室将分离得到的番茄早疫、晚疫病菌在PDA上培养5 d后,在超净工作台上用0.5 cm的打孔器在菌落边缘上打取菌饼,分别转接到4种供试培养基中,每皿1块,3次重复,置于25℃恒温下培养,5 d后观察菌落生长情况,用十字交叉法测量培养基平板上的菌落直径,记录数据,并用SPSS软件进行处理。
1.2.5番茄不同品种对番茄晚疫病抗病性测定番茄不同品种巨霸、捷美153、德富各分成9份,其中3份采用无伤接菌,3份采用有伤接菌(用昆虫针刺伤),剩余3份作为对照,重复3次。在室温保湿的条件下培养,观察发病情况,每隔24 h测1次病斑,连测7 d。

1.2.6室内药剂筛选采用生长速率法测定4种杀菌剂对番茄早疫、晚疫病菌的抑菌率。采用各药剂的推荐浓度进行试验,药剂浓度分别为10%苯醚甲环唑0.5 μg/mL、722 g/L霜霉威盐酸盐4.8 μg/mL、72%霜脲·锰锌0.4 μg/mL、10%烯酰吗啉0.65 μg/mL,然后按药剂浓度的50倍用灭菌水分别配制成药液,各取1 mL药液加到灭菌冷却至45℃的49 mL PDA 培养基中,摇匀,分别倒入3个灭菌培养皿中制成含药培养基,以加1 mL无菌水的PDA为对照,用0.5 cm 打孔器分别在预先培养好的番茄早疫、晚疫病菌菌落边缘打取菌饼,置于以上配制的含药PDA平板上,每皿1个菌饼,最后将培养基置于25℃培养箱中培养5 d后,采用十字交叉法测量菌落直径,并按公式计算药剂抑菌率。
2结果与分析
2.1病原菌分离纯化及鉴定
通过致病性测定,表明这2种分离物均能使番茄发病,将分离纯化的分离菌1和2在超净工作台上用0.5 cm打孔器在菌落边缘打成菌饼接种在供试幼苗的健康叶片上,室温下保湿培养5 d,观察发现接种分离菌1、分离菌2的供试幼苗叶片发病,且症状表现(图1A,B)分别与田间早疫病、晚疫病发病症状一致(图1C,D)。对接种发病的叶片进行再分离,获得了与供试病样一致的分离物。
分离菌1在PDA培养基上,菌丝初期生长呈灰白色,随即向培养基呈圆形扩散,成圆后边缘仍为白色,中间颜色逐渐变深最后成褐色、黑色。菌丝生长快,在25℃下培养5 d,菌落直径在6 cm以上(图2 A)。经诱导处理可产生分生孢子,分生孢子梗单生或丛生,分生孢子单生,褐色,倒棍棒形至长椭圆形,大小(150~300) μm×(15~19) μm,一般有多个纵横隔膜,有长喙(一般孢身长度)(如图2 B)。分离菌2在PDA培养基上,菌丝丝状,初无色透明,后变褐色,菌落近圆形(如图2 C)分生孢子为无色透明,鸭梨型或慈姑型。成熟孢子有2~3个隔膜,大小为(17~33)μm×(6.5~11)μm,萌发时两端细胞产生芽管,芽管的顶端产生附着孢,球形或椭圆型,深褐色,壁厚,直径8~12 μm,紧贴在寄主体上产生侵入丝,入侵寄主组织(图2 D)。

图1 致病性测定Fig.1 Pathogenicity test注:A、B分别为接种分离物1、2供试幼苗发病症状;C、D分别为番茄早疫、晚疫病田间发病症状

图2 病原菌鉴定Fig.2 The pathogen identification of tomato early blight and late blight注:分离菌1(A、B)和分离菌2(C、D)菌落培养形状和分生孢子形态
根据病原形态特征、菌落形态及光学显微镜(Nikon E200)下孢子形态,并参考相关文献[13-15],初步鉴定分离菌1为茄链格孢(Alternariasolani),分离菌2为致病疫霉菌(Phytophthorainfestans)。
2.2不同培养基对番茄早疫、晚疫病菌生长的影响
通过不同培养基对番茄早疫、晚疫病菌生长影响试验,结果表明番茄早疫菌和晚疫菌均可在4种供试培养基上生长,但存在一定差异,其中番茄早疫病菌在番茄葡萄糖琼脂培养基上生长最快,玉米粉琼脂培养基上最慢,马铃薯葡萄糖琼脂培养基和燕麦片琼脂培养基上菌落直径介于两者之间(表1)。方差分析表明,该菌在马铃薯葡萄糖琼脂培养基和番茄葡萄糖琼脂培养基、燕麦片琼脂培养基和玉米粉琼脂培养基培养的菌落直径之间差异不显著,但前两种培养基和后两种培养基培养的菌落直径之间差异显著(P<0.05);晚疫病菌在番茄葡萄糖琼脂和玉米粉琼脂培养基上生长最好,3 d后菌落直径均为6.33 cm,燕麦片琼脂培养基生长最慢,菌落直径均为0.53 cm,马铃薯葡萄糖琼脂培养基上的介于这两者之间;该菌除了在玉米粉琼脂和番茄葡萄糖琼脂培养基上的菌落直径差异不显著外,在其他培养基上培养的菌落直径差异极显著(P<0.05)。
2.3番茄不同品种对番茄晚疫病抗病性测定
番茄品种对番茄晚疫病抗病性测定结果表明(表2),不同接种方式和不同番茄品种对晚疫病的抗性都存在一定差异,其中在有伤接种条件下番茄果实上病斑扩展速度明显快于无伤接种方式;同一时间,捷美153在有伤、无伤的接种条件下,病斑扩展速度最慢;不同品种,随着时间的变化病斑扩展速度递增,其中巨霸发病最快,4 d后有伤、无伤病斑直径分别为2.74 cm、1.80 cm;德富次之,4 d后有伤、无伤病斑直径分别为3.23 cm、1.00 cm;捷美153最慢,4 d后有伤、无伤病斑直径分别为2.78 cm、1.40 cm。
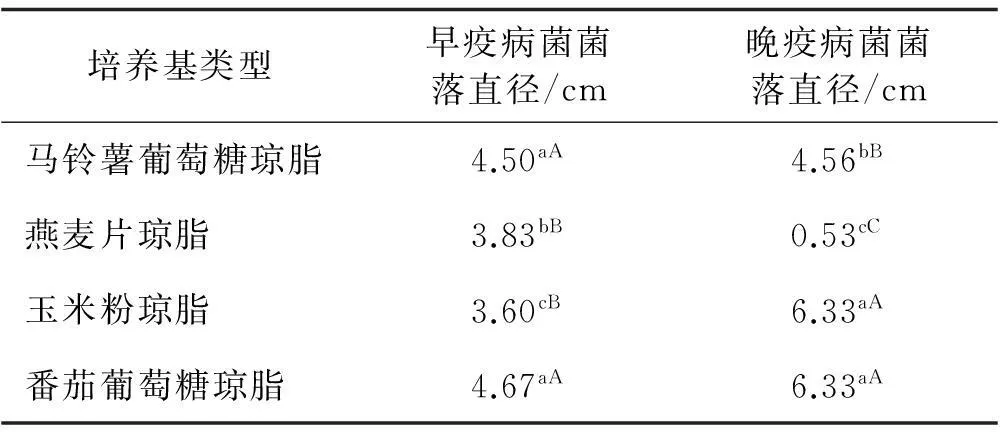
表1 不同培养基处理下的番茄早疫、晚疫病菌生长
注明:同列不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)
通过不同番茄品种接种番茄晚疫病菌果实发病率试验(表3),结果表明同种番茄品种在发病初期有伤接种均比无伤接种发病快,比如德富3 d后有伤接种发病率为100%,3 d无伤接种的发病率为50%;不同番茄品种,在同一种接种方式下,捷美153均比德富、巨霸发病率低,有伤接菌初期(1 d、2 d、3 d),捷美153发病率分别为0、33.33%、50.00%,发病率比德富低50.00%、50.00%、50.00%,比巨霸低100.00%、66.67%、50.00%,在后期均发病。

表2 番茄不同品种接种番茄晚疫病菌后病斑扩展
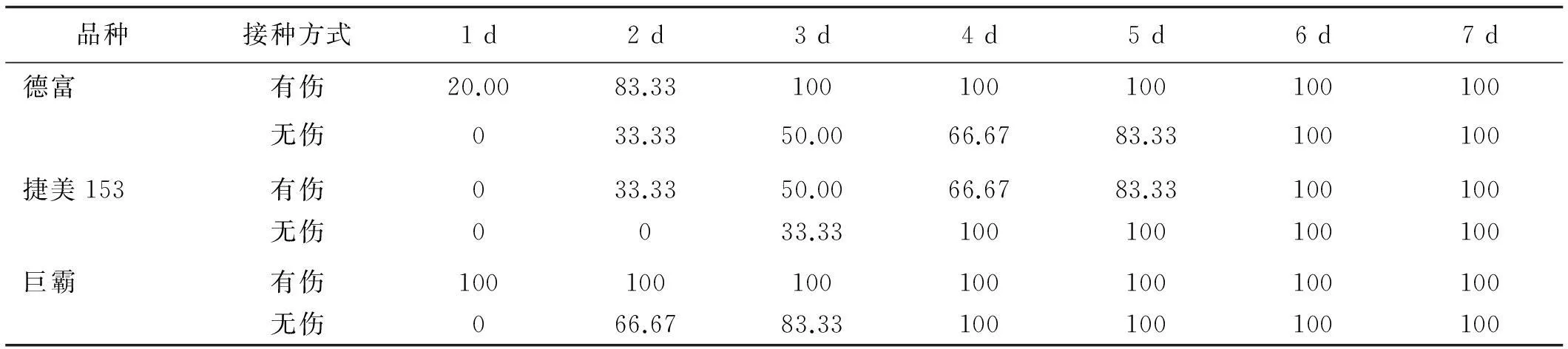
表3 不同番茄品种接种番茄晚疫病菌果实发病率
2.4室内药剂筛选
通过室内药剂筛选试验,结果表明,不同杀菌剂对番茄早、晚疫病均具有一定的抑制作用,其中4种供试药剂在推荐浓度下,10%苯醚甲环唑微乳剂和72%霜脲·锰锌可湿性粉剂对番茄早疫病菌抑菌效果最好,抑菌率都在98%以上,722 g/L霜霉威盐酸盐水剂抑菌率次之,为80.82%,10%烯酰吗啉水乳剂抑菌效果最差,为26.80%(表4,5),方差分析表明,10%苯醚甲环唑ME和72%霜脲·锰锌WP对该病菌的抑菌率之间差异不显著,但2种药剂和其他2种杀菌剂对该病菌的抑菌率之间差异显著(P<0.05);72%霜脲·锰锌可湿性粉剂和10%烯酰吗啉水乳剂对番茄晚疫病菌抑菌效果最好,抑菌率都在98%以上,而722 g/L霜霉威盐酸盐水剂次之,抑菌率为55.67%,10%苯醚甲环唑微乳剂最差,抑菌率为27.84%,10%烯酰吗啉EW和72%霜脲·锰锌WP对该病菌的抑菌率之间差异不显著,但2种药剂和其他2种杀菌剂的抑菌率之间差异极显著(P<0.05)。
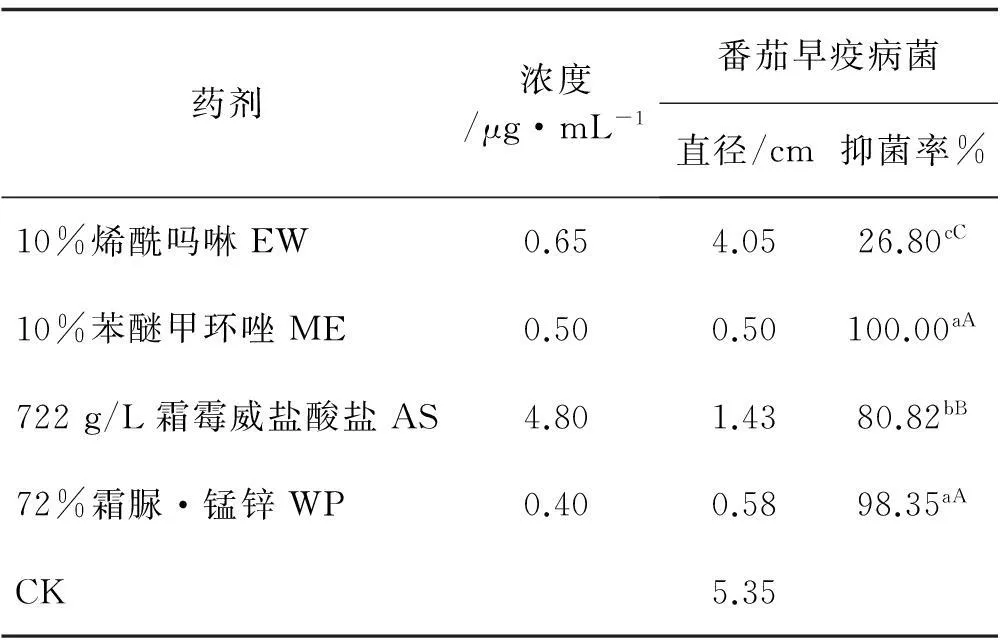
表4 4种杀菌剂对番茄早疫病菌抑菌效果
注:同列不同小写字母表示差异显著(P<0.01),不同大写字母表示差异极显著(P<0.05)
3讨论与结论
对番茄晚疫病菌的分离培养在国内外早有研究,菜豆、燕麦、V8汁、马铃薯等培养基都有培养晚疫病菌的报道,番茄晚疫病菌在这几种培养基上均可生长,在菜豆、V8汁、马铃薯培养基上的生长速度非常缓慢,在燕麦培养基上生长得快一些[16-18]。试验表明,甘肃省兰州市皋兰县高山村连作田中番茄的主要病害为早疫病和晚疫病,其病原菌分别为茄链格孢(Alternariasolani)和致病疫霉菌(Phytophthorainfestans);番茄早疫、晚疫病病菌在番茄葡萄糖琼脂培养基上生长最好;接种不同方式、番茄不同品种对晚疫病的抗性都存在一定差异,其中在有伤接种条件下番茄果实病斑扩展速度明显快于无伤接种;巨霸最感病,德富次之;捷美153最抗病;室内药剂筛选结果表明,10%苯醚甲环唑和72%霜脲·锰锌对番茄早疫病菌抑菌效果最好,抑菌率分别为100%和98.35%;10%烯酰吗啉和72%霜脲·锰锌对番茄晚疫病菌抑菌效果最好,抑菌率分别为98.71%和100%。
番茄早疫、晚疫病是发生普遍而且较严重的病害,生产中对其主要进行综合防治,应用科学栽培管理技术,加强田间管理,及时摘除病叶,尤其搞好田园的卫生、清理工作,创造适宜番茄生育的生态环境,在此基础上应用药剂防治,来提高防效,收到防病、保产的效果[19-21]。试验仅对4种培养基对病原菌的培养情况、3种番茄品种的抗病性和4种药剂对番茄晚疫病的室内抑菌作用进行了测定,对于其他培养基、番茄品种和药剂对病原菌的培养情况、抗病性和抑菌作用等问题及各药剂的田间防效等问题尚未涉及,有关这些问题还有待进一步探讨。
参考文献:
[1]Gardner R G.Greenhouse disease screen facilitates breeding resistance to tomato early blight[J].Hort science,1990,25(2):222-223.
[2]Williame fry.stephen b goodwin Re-emergence of potato and tomato late blight in the United States[J].Plant Disease,1997,81(12):1349-1357.
[3]Vloutoglou I,Kalogerakis S N.Effects of inoculum concentration,wetness duration and plant age on development of early blight(Alternariasolani) and on shedding of leaves in tomato plants[J].Plant Pathology,2000,49:339-345.
[4]Erinile i d,quimv j g.An epiphytotic of late blight of tomato in Nigeria [J].Plant Disease,1998,64(7):701-702.
[5]Schwyn B,Neilands J B.Universal chemical assay for the detection and determination of siderophores[J].Analytical Biochemistry,1987,160:47-56.
[6]Marcelis L F M.Asimulationmodel for dry matter partitioning in cucumber [J].Annals of Botany,1994,74:43-52.
[7]Thornley J H M.Modelling shoot :root relation:the only way forward [J].Annals of Botany,1998,81:163-175.
[8]朱宗源,黄晓敏,吕云华.诱导茄链格孢菌分生孢子形成的新技术[J].真菌学报,1985,4(3):180-183.
[9]刘孝峰,刑国文,徐奇功.番茄早疫病菌分生孢子萌发与环境条件关系的研究[J].河南职技师院学报,1999,27(2):15-16
[10]程法,张松林.番茄晚疫病抗病性鉴定方法[J].中国蔬菜,1985(1):39-43.
[11]张绍松,宋令荣,王芳,等.诱发番茄晚疫病流行的气象条件[J].西南农业学报,1997,18(1):119-122.
[12]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[13]徐秉良,马书智.百合疫病病原菌的鉴定及培养基的筛选[J].植物保护学报,2005,32(3):288-290.
[14]郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1997:82.
[15]陈宇飞,韩桂珍,龚束芳.大棚番茄晚疫病药剂防治[J].北方园艺,2000(5):40-41.
[16]田苗英,冯兰香.番茄晚疫病菌的分离与纯化[J].植物保护,2000,26(5):36.
[17]康立功,姜景彬,李景富,等.番茄晚疫病病原菌生物学特性研究(Ⅱ)[J].东北农业大学学报,2008,39(11):23-27.
[18]冯兰香,杨宇红,谢丙炎,等.中国18省市番茄晚疫病生理种的鉴定[J].园艺学报,2004,16(3) :758-761.
[19]田苗英,冯兰香,龚会芝,等.番茄晚疫病菌的分离与纯化[J].植物保护,2000,26(5):36.
[20]李保聚,朱国仁.番茄灰霉病发展症状诊断及综合防治[J].植物保护,1998,24(6):18-20.
[21]冯东昕,李宝栋.番茄病虫害防治新技术[M].北京:金盾出版社,2009:1.
Identification on pathogen of two main tomato diseases and fungicides screening in laboratory
LU Zhong-yan,LIANG Qiao-lan,HE Wu-xue
(CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China)
Abstract:The main tomato diseases in continuous planting field were early blight and late blight by the field survey in Gaoshan Village,Gaolan County of Lanzhou City. The pathogens were identified as Alternaria solani and Phytophthora infestans. Tomato glucose agar medium was the best to culture tomato early and late blight pathogens. The inoculation methods and tomato varieties showed differences on resistance of tomato to late blight. The disease spot on injury fruit expaned faster than that of no injury fruit. Juba was more susceptible to Phytophthora infestans than Defu and Jiemei 153. Jiemei 153 was the best for resisting Phytophthora infestans.The best fungicdes against early blight were 10% difenoconazole and 72% cymoxanic·mancozeb and the inhibition ratios reached 100% and 98.35% respectively;10% dimethomorph and 72% cymoxanic·mancozeb showed the best inhibitory effect to late blight and the inhibition ratios were 98.71% and 100% respectively.
Key words:Alternaria solani;Phytophthora infestans;fungicides screened in laboratory
中图分类号:S 436.412
文献标识码:A
文章编号:1009-5500(2016)01-0083-06
作者简介:卢钟彦(1989-),男,甘肃武威人,在读硕士。
基金项目:甘肃省农业综合开发项目“皋兰县蔬菜优质高产栽培技术示范与推广(2013)”,皋兰县生物农药示范推广(2014年)资助
收稿日期:2015-03-02; 修回日期:2015-03-23
E-mail:1245376164@qq.com
梁巧兰为通讯作者。

