吲哚-3-甲醇酸性代谢产物辐射防护作用的研究
储小飞 赵舒怡 崔明 路璐 张俊玲 孟庆慧 樊赛军
300192天津,中国医学科学院北京协和医学院放射医学研究所,天津市放射医学与分子核医学重点实验室(储小飞、赵舒怡、崔明、路璐、张俊玲、樊赛军);20097 Washington DC, Department of Oncology,Lombardi Comprehensive Cancer Center,Georgetown University(孟庆慧)
吲哚-3-甲醇酸性代谢产物辐射防护作用的研究
储小飞 赵舒怡 崔明 路璐 张俊玲 孟庆慧 樊赛军
300192天津,中国医学科学院北京协和医学院放射医学研究所,天津市放射医学与分子核医学重点实验室(储小飞、赵舒怡、崔明、路璐、张俊玲、樊赛军);20097 Washington DC, Department of Oncology,Lombardi Comprehensive Cancer Center,Georgetown University(孟庆慧)
目的探讨吲哚-3-甲醇(I3C)酸性代谢产物的辐射损伤防护作用。方法采用细胞克隆形成实验检测细胞的存活分数;采用Western Blot方法检测蛋白表达水平。结果采用正常纤维上皮细胞184A1,发现7种I3C酸性代谢产物表现出不同的辐射损伤防护效果,其中CTET(1 μmol/L)、LTET(1 μmol/L)、HI-IM(1 μmol/L)和3,3'-二吲哚甲烷(DIM)(0.3 μmol/L)4种代谢产物在细胞γ-射线照射前24 h预处理细胞均不同程度地提高了辐照细胞的存活分数,差异均有统计学意义(P<0.05,P<0.01),而CT(1 μmol/L)、LTr-1(1 μmol/L)和ICZ(1 μmol/L)3种代谢产物则对辐照细胞存活分数无影响(P>0.05)。进一步研究发现CTET、LTET、HI-IM和DIM可导致ATM、BRCA1和NBS1蛋白磷酸化水平的改变。同样,CT、LTr-1和ICZ对这些蛋白的磷酸化水平不产生影响。另外,HI-IM可明显降低辐射损伤诱导的细胞坏死和细胞凋亡。结论CTET、LTET、HI-IM和DIM 4种I3C酸性代谢产物可明显降低184A1细胞的辐射敏感性,即具有辐射防护作用,其机制可能与其调节DNA损伤与修复蛋白磷酸化和细胞凋亡有关。
吲哚-3-甲醇酸性代谢产物;辐射损伤;DNA损伤修复;细胞凋亡
Fund program:Research Institute of Technology Development and Research Projects of Special Funds from the Ministry of Science and Technology of China(2014EG150134);National Natural Science Foundation of China (81172127,81572969);Key Technology Research and Development Program of Tianjin(14ZCZDSY00001); Development Fund of Institute of Radiation Medicine,Chinese Academy of Medical Sciences(1559,1549)
0 引言
据世界卫生组织统计,目前恶性肿瘤的治愈率在45%左右,其中通过手术途径治愈者占22%,放射治疗(简称放疗)占18%,化学药物治疗(简称化疗)占5%。在恶性肿瘤治疗过程中,70%~80%的患者在不同程度上均需接受放疗,一部分肿瘤通过放疗达到治愈目的,而相当一部分患者通过放疗减轻症状,延长生存期。因此,放疗是恶性肿瘤治疗中不可缺少的治疗手段之一。
然而,在采用放疗治疗恶性肿瘤的同时,由于电离辐射的非特异性以及目前照射技术和条件的限制,高能量电离辐射照射也导致了肿瘤相关和周边、乃至全身正常组织和器官的急性辐射损伤。例如,在进行肿瘤根治性放疗时,对肿瘤区域给以根治大剂量的照射,由于照射范围较大,照射剂量也高,周边和全身正常组织的损伤也就越大。因此,虽然放疗是一种非常有效的治疗手段,但治疗同时对正常组织和细胞的急性辐射损伤所引起的不良反应也大大限制了放疗在恶性肿瘤治疗中的广泛应用。为了减轻肿瘤放疗中电离辐射对正常组织及人体的危害,研究辐射损伤的防治手段,特别是积极寻找有效的辐射防护药物,提高肿瘤放疗疗效,降低正常组织和细胞的辐射损伤是肿瘤放疗研究中迫切需要解决的问题和热门研究课题之一[1-2]。肿瘤放疗的辐射防护药物是指肿瘤患者受到放疗照射前或照射后早期能防护或减轻电离辐射照射所带来的组织和细胞损伤的化合物(或药物)的总称。针对性的辐射防护药物应用是防护电离辐射造成急性辐射损伤的最有效和直接的手段之一。笔者所在课题组的研究工作发现,吲哚-3-甲醇(indole-3-carbinol,I3C)的一种酸性代谢产物3,3'-二吲哚甲烷(3,3'-diindolylmethane,DIM)表现出非常好的辐射损伤防护效果[3]。本研究旨在探讨I3C的其他酸性代谢产物是否具有同样的辐射损伤防护作用。
1 材料与方法
1.1 主要材料与仪器
人正常纤维上皮184A1细胞(美国Georgetown大学组织细胞服务中心),辣根过氧化物酶(HRP)偶联的羊抗兔IgG和HRP偶联的羊抗鼠IgG(武汉三鹰生物科技有限公司),BCA蛋白定量试剂盒(北京康为生物科技有限公司),细胞裂解液、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)加样缓冲液、封闭液、TBST(Tris缓冲盐溶液+吐温20)(中国医学科学院放射医学研究所自制)。CTET、LTET、HI-IM、DIM、CT、LTr-1和ICZ共7种酸性代谢产物均由美国Georgetown大学化学合成并提供,所有化合物均溶解于二甲基亚砜中,并存于-20℃,使用前用培养液稀释。FACScan流式细胞仪(美国BD公司),细胞辐射照射采用USD Autocell40137Cs γ射线辐射源(加拿大原子能有限公司)产生的射线(250 cGy/min)辐照完成。
1.2 方法
1.2.1 细胞培养
人正常纤维上皮184A1细胞系单层贴壁生长,采用含体积分数为10%血清、105U/L青霉素、质量浓度为100 mg/L链霉素的DMEM培养基,于5%CO2、37℃培养箱内培养。
1.2.2 克隆形成实验
实验组人正常纤维上皮184A1细胞在照射前24 h分别用7种I3C代谢产物预处理(除DIM采用0.3μmol/L浓度处理外,其他代谢产物均采用1μmol/L浓度处理),同时设对照组(不进行预处理)。细胞接受不同剂量(0、2、4、6、8、10 Gy)的γ-射线照射,按不同的照射剂量接种不同数量的细胞到60 mm培养皿中。细胞连续培养3周后用甲醇固定,加姬姆萨应用液染色30 min,流水洗净,计数细胞数≥50的克隆个数。按以下公式计算克隆形成率和存活分数

1.2.3 Western Blot法
收集上述受到照射的实验组细胞与未受到照射的对照组细胞,离心,悬浮于裂解液中,并置冰上裂解细胞2 h,10 000 r/min离心10 min,取上清液。采用BCA蛋白定量试剂盒测定蛋白浓度,调整蛋白至相同浓度。向样品中加入等体积2×SDS加样缓冲液,沸水煮沸5 min,经SDS-聚丙烯酰胺凝胶电泳(PAGE)后转膜;封闭液封闭2 h;加一抗(用封闭液稀释),4℃孵育过夜;TBST洗3次,每次15 min;加相应的二抗(封闭液稀释),室温孵育1 h,TBST洗3次,每次15 min;用ECL发光法检测蛋白表达。
1.2.4 膜联蛋白V-异硫氰酸荧光素/碘化丙啶流式检测法
实验共设4组:空白对照组(不做任何处理),单独γ-射线照组(仅进行γ-射线照射),单独HI-IM处理组(仅采用HI-IM处理)和γ-射线照射+HI-IM组(既进行γ-射线照射,又采用HI-IM处理)。将收集的细胞(0.5~1)×106个用磷酸盐缓冲液(phosphate buffered saline,PBS)洗2次,加入100 μl固定缓冲液和10 μl异硫氰酸荧光素标记的膜联蛋白V(Annexin V-FITC)(20 μg/ml),室温避光30 min;再加入5 μl碘化丙啶(propidium iodide,PI)(50 μg/ml),避光反应5 min后,加入400 μl固定缓冲液,立即用流式细胞术定量检测,同时以不加Annexin VFITC及PI的一管作为阴性对照。
1.3 统计学方法
采用Graphpad Prism 5.0软件作图并进行统计学分析,所有实验至少重复3次,数据以均值±标准差(x±s)表示。多组间比较采用单因素方差分析,两两比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 I3C代谢产物对辐照细胞存活分数的影响
如图1所示,在I3C的7种代谢产物中,CTET、LTET、HI-IM和DIM均不同程度地提高了受照184A1细胞的存活分数,即具有辐射损伤防护作用。其中,与对照组细胞的IC90(导致90%细胞存活分数抑制的照射剂量)(2.8 Gy)相比,CTET(5.4 Gy)(t=2.43,P<0.05)、LTET(5.8 Gy)(t=3.53,P<0.05)、HI-IM(7.4 Gy)(t=2.95,P<0.01)以及DIM(7.6 Gy)(t=2.81,P<0.01)处理组的IC90均明显提高。根据获得的IC90值,可知这4种代谢产物的辐射防护疗效为DIM>HI-IM>LTET>CTET。但是,其余3种代谢产物CT、LTr-1和ICZ则对受照184A1细胞的存活分数不产生影响(P>0.05)。上述结果表明并非所有的I3C代谢产物均具有辐射损伤防护作用。
2.2 I3C代谢产物对DNA损伤与修复蛋白磷酸化水平的影响
采用Western Blot检测了I3C的7种代谢产物对3种已知的DNA损伤与修复蛋白(ATM、BRCA1和NBS1)磷酸化水平的影响。结果如图2所示,CTET、LTET、HI-IM和DIM 4种I3C代谢产物不同程度地诱导了ATM(Ser1981)、BRCA1(Ser1387)和NBS1(Ser343)蛋白磷酸化水平的升高,但对ATM、BRCA1和NBS1总蛋白水平无影响;对细胞存活分数不产生影响的其余3种代谢产物CT、LTr-1和ICZ对上述3种蛋白的表达及磷酸化水平均无明显影响。
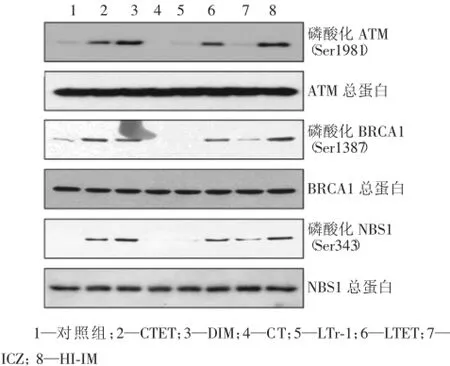
图2 吲哚-3-甲醇代谢产物对DNA损伤与修复相关蛋白及其磷酸化的影响
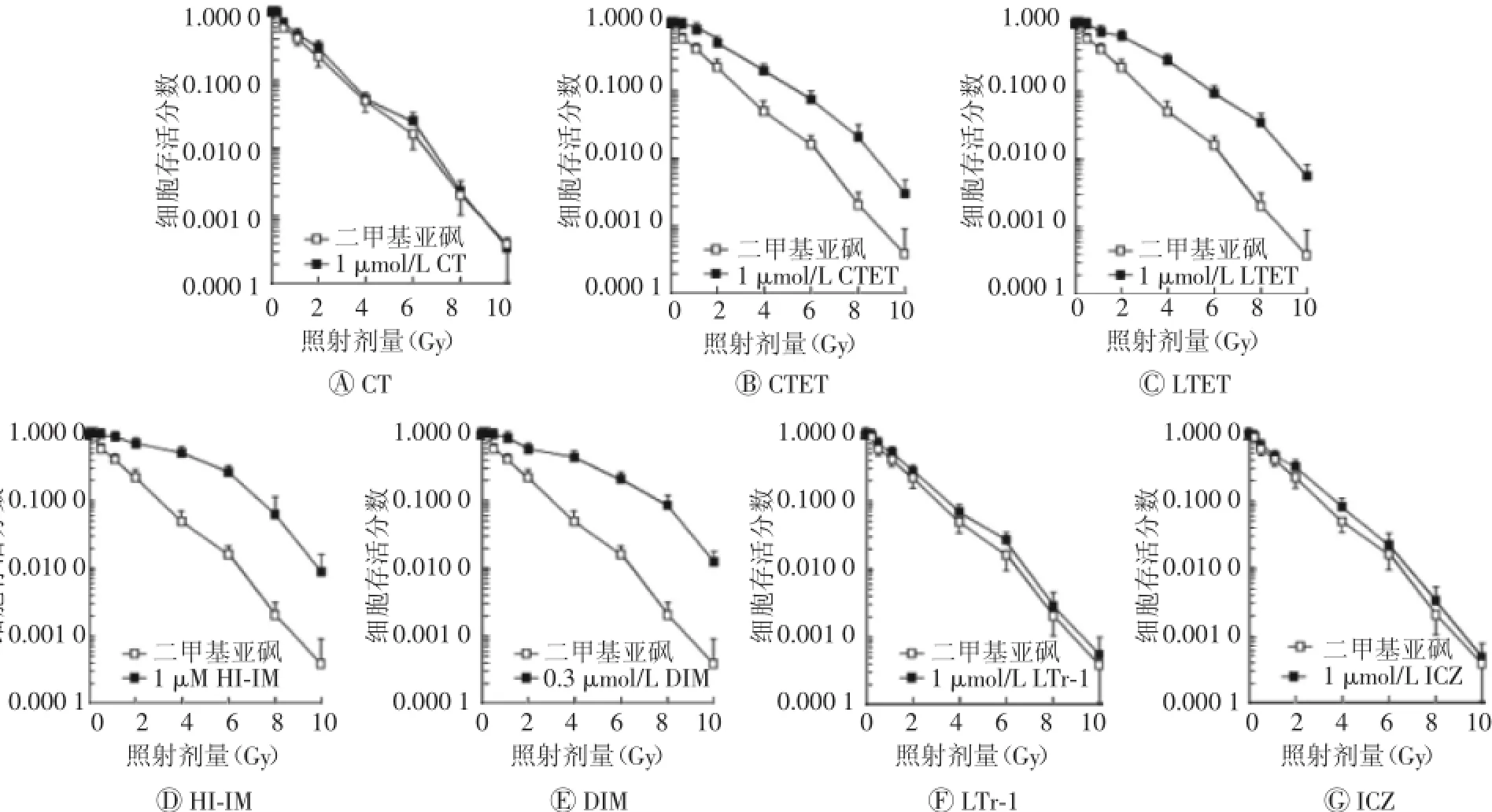
图17 种吲哚-3-甲醇酸性代谢产物与人正常纤维上皮184A1细胞放射敏感性的相关性
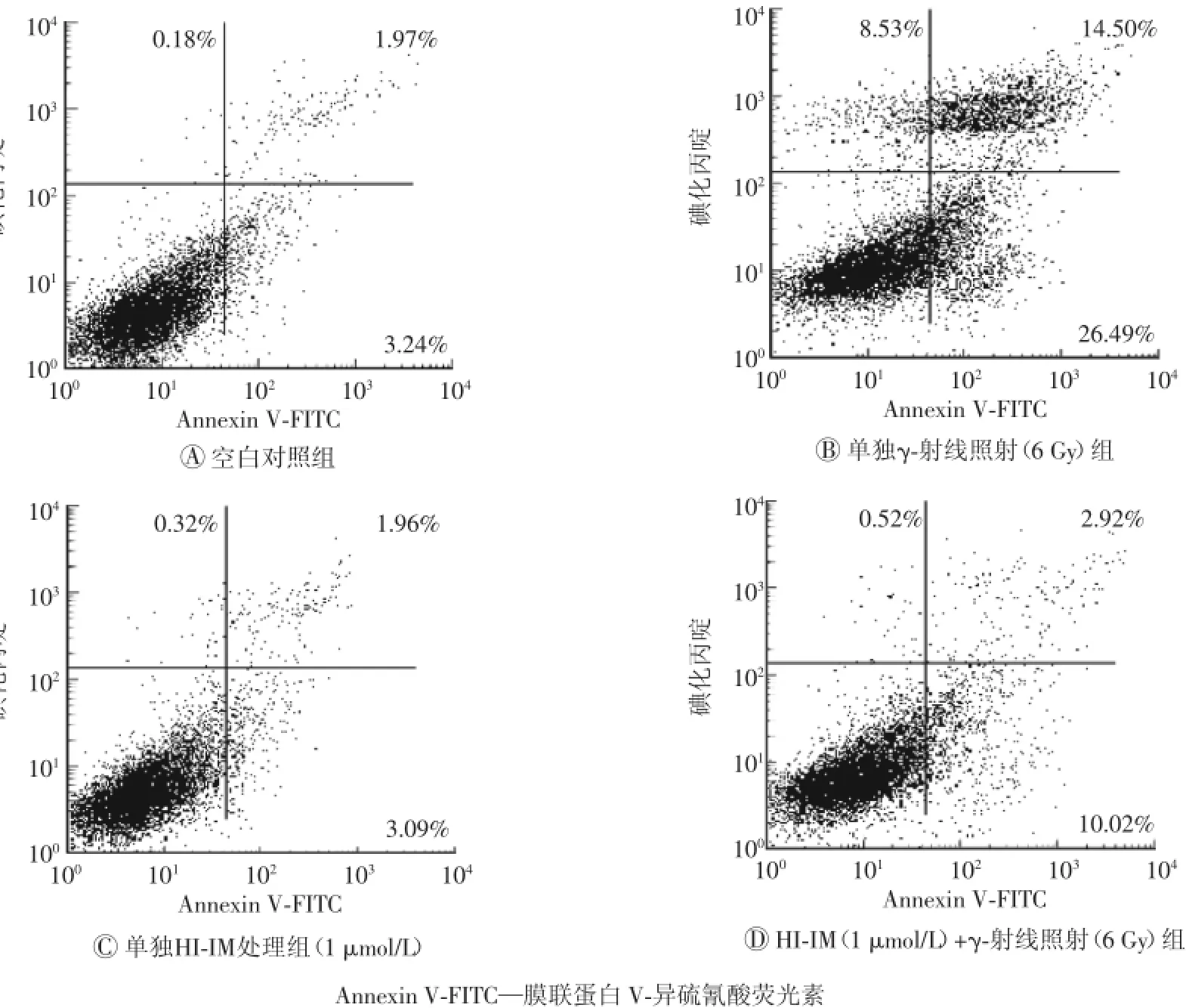
图3HI-IM对辐照诱导的细胞坏死和细胞凋亡的影响
2.3 HI-IM对辐照诱导细胞凋亡的影响
Annexin V-FITC/PI流式检测结果发现受到6 Gy γ-射线照射后24 h的184A1细胞明显出现细胞凋亡和细胞死亡。与空白对照组细胞相比,照射诱导的早期细胞凋亡从3.24%增加到26.49%(t=2.93,P<0.01),晚期细胞凋亡从1.97%增加到14.5%(t=3.21,P<0.01),而坏死细胞从0.18%增加到8.53%(t=3.11,P<0.01)。1 μmol/L HI-IM单独处理24 h并未诱导任何细胞坏死和凋亡,表明1 μmol/L HI-IM并无毒性。但是,与单独γ-射线照射组细胞相比,γ-射线照射+HI-IM组无论是早期细胞凋亡、晚期细胞凋亡还是坏死细胞均明显减少,即早期细胞凋亡下降到10.02%(t=2.77,P<0.01),晚期细胞凋亡下降到2.92%(t=3.36,P<0.01),坏死细胞下降到0.52%(t=3.05,P<0.01)。上述结果清楚地表明HI-IM预处理可明显降低辐射损伤所导致的细胞凋亡和细胞坏死。(图3)
3 讨论与结论
I3C广泛存在于富含芥子油苷的十字花科菜中,人们日常食用的许多蔬菜,包括白菜、水田芥菜、菜花、辣根、卷心菜、萝卜、大白菜、花椰菜以及甘蓝等均属于十字花科菜。现已知道运输、冷冻、切碎和烹调等食物加工处理以及咀嚼过程会使十字花科菜中的细胞受到破坏,导致葡萄糖异硫氰酸盐经黑芥子硫苷酸酶水解后生成I3C及异硫氰酸盐[4]。I3C在胃内酸性环境中极不稳定,发生缩合反应而形成DIM及其他一系列多聚体,包括ICZ和LTr-1等[5]。而DIM和LTr-1是I3C进入体内血清中的主要代谢产物,肝脏中I3C的各种代谢产物中DIM占24%,LTr-1占20%。其他微量代谢物如ICZ的浓度非常低[6]。I3C的生物学效应主要归因于其代谢产物作用,其中DIM的作用尤为重要。
有文献报道,I3C及其代谢产物可能影响电离辐射所导致的辐射损伤,因为:①大剂量电离辐射照射导致免疫功能下降,而I3C可提升免疫功能[7-8]。②I3C具有非常好的抗氧化作用,已证实I3C能降低氧化剂过氧化氢对细胞的损伤作用[9]。③I3C可诱导DNA损伤和修复密切相关的蛋白ATM、BRCA1、BRCA2的表达及其磷酸化等[9-11]。这些间接研究结果均提示抗氧化剂I3C及其代谢产物有可能对电离辐射损伤产生一定影响。笔者的前期研究表明DIM具有良好的辐射损伤防护作用,且发现0.3 μmol/L的浓度则表现出最佳防护效果[3]。本研究进一步证实除DIM以外,CTET、LTET和HI-IM 3种I3C代谢产物均表现出辐射防护作用(图1)。显然,I3C及其部分代谢产物确实可作为辐射损伤防护后选药进行更深入的研究。
已知电离辐射造成损伤信号之一是辐射引起细胞内DNA双链断裂而导致ATM和ATR基因的表达产物ATM-ATR蛋白磷酸化激活,同时ATM和ATR表达上调,然后将DNA损伤信号传递给BRCA1;而BRCA1直接参与DNA的损伤修复或通过不同的基因调节而参与调控电离辐射导致的细胞周期阻滞和细胞凋亡,从而控制细胞的生长和死亡。ATM和BRCA1是调控DNA损伤反应的关键基因,理论和实验均已证实了直接激活ATM蛋白激酶活性能增加ATM蛋白激酶对DNA损伤反应的调控作用,从而可以获得辐射抗性,降低受照细胞对辐射的敏感性。笔者的前期研究工作表明,DIM可直接激活BRCA1蛋白表达,激活BRCA1蛋白磷酸化也可获得辐射抗性,降低受照细胞对辐射的敏感性,这些结果表明BRCA1磷酸化在DNA损伤修复调节中通常被激活,从而在BRCA1参与DNA损伤修复的生物功能中起着重要作用。本研究检测了I3C的7种代谢产物对ATM(Ser1981)、BRCA1(Ser1387)和NBS1(Ser343)蛋白磷酸化水平的影响,并证实其中具有辐射防护作用的3种I3C代谢产物CTET、LTET和HI-IM与DIM一样均可导致ATM(Ser1981)、BRCA1(Ser1387)和NBS1(Ser343)蛋白磷酸化水平不同程度地提高。表明DIM、CTET、LTET和HI-IM所产生的放射损伤防护作用可能与它们调节DNA损伤与修复ATM-BRCA1-NBS1蛋白磷酸化有关。
本研究结果表明,包括CTET、LTET、HI-IM与DIM在内的部分I3C代谢产物均表现出了非常有效的辐射损伤防护作用,且其辐射防护作用与这些代谢产物激活DNA损伤与修复ATM-BRCA1-NBS1信号通路以及抑制辐射诱导的细胞凋亡有着密切的关系。
利益冲突无
[1]Winczura P,J assem J.Combined treatment with cytoprotective agents and radiotherapy[J].Cancer Treatment Reviews,2010,36(3):268-275.DOI:10.1016/j.ctrv.2009.12.001.
[2]Citrin D,Cotrim AP,Hyodo F,et al.Radioprotectors and mitigators of radiation-induced normal tissue injury[J].Oncologist,2010,15(4):360-371.DOI:10.1634/theoncologist.2009-S104.
[3]Fan S,Meng Q,Xu J,et al.DIM(3,3'-diindolylmethane)confers protection against ionizing radiation by a unique mechanism[J].Pro Natl Acad Sci USA,2013,110(46):18650-18655.DOI:10.1073/ pnas.1308206110.
[4]Verhoeven DT,Verhagen H,Goldbohm RA,et al.A review of mechanisms underlying anticarcinogenicity by brassica vegetables [J].Chem Biol Interact,1997,103(2):79-129.DOI:10.1016/S0009-2797(96)03745-3.
[5]Aggarwal BB,Ichikawa H.Molecular targets and anticancer potential of indole-3-carbinol and its derivatives[J].Cell Cycle,2005,4(9):1201-1215.DOI:10.4161/cc.4.9.1993.
[6]Zhang WW,Feng Z,Narod SA.Multiple therapeutic and preventive effects of 3,3'-diindolylmethane on cancers including prostate cancer and high grade prostatic intraepithelial neoplasia[J].J Biomed Res, 2014,28(5):339-348.DOI:10.7555/JBR.28.20140008.
[7]Xue L,Pestka JJ,Li M,et al.3,3'-Diindolylmethane stimulates murine immune function in vitro and in vivo[J].J Nutr Biochem,2008, 19(5):336-344.DOI:10.1016/j.jnutbio.2007.05.004.
[8]Exon JH,South EH.Dietary indole-3-carbinol alters immune functions in rats[J].J Toxicol Environ Health A,2000,59(4):271-279. DOI:10.1080/009841000156934.
[9]Fan S,Meng Q,Saha T,et al.Low concentrations of diindolylmethane,a metabolite of indole-3-carbinol,protect against oxidative stress in a BRCA1-dependent manner[J].Cancer Res,2009,69(15):6083-6091.DOI:10.1158/0008-5472.CAN-08-3309.
[10]Fan S,Meng Q,Auborn K,et al.BRCA1 and BRCA2 as molecular targets for phytochemicals indole-3-carbinol and genistein in breast and prostate cancer cells[J].Br J Cancer,2006,94(3):407-426.DOI:10.1038/sj.bjc.6602935.
[11]Brew CT,Aronchik I,Hsu JC,et al.Indole-3-carbinol activates the ATM signaling pathway Independent of DNA damage to stabilize p53 and induce G1 arrest of human mammary epithelial cells[J].Int J Cancer,2006,118(4):857-868.DOI:10.1002/ijc.21445.
Study on radioprotection of indole-3-carbinol acid condensation products
Chu Xiaofei,Zhao Shuyi,Cui Ming, Lu Lu,Zhang Junling,Meng Qinghui,Fan Saijun
Institute of Radiation Medicine,Chinese Academy of Medical Sciences&Peking Union Medical College,Tianjin Key Laboratory of Radiation Medicine and Molecular Nuclear Medicine,Tianjin 300192,China(Chu XF,Zhao SY,Cui M,Lu L,Zhang JL,Fan SJ);Department of Oncology,Lombardi Comprehensive Cancer Center,Georgetown University,Washington DC 20097,USA(Meng QH)
ObjectiveTo study the radioprotective effect of indole-3-carbinol(I3C)acid condensation products.MethodsCell colony formation assay was used to determine cell survival rate,and Western Blot assay was employed to measure protein expression.ResultsSeven kinds of the I3C acid condensation products showed different radioprotective effect on normal fibrous epithelial cells 184A1,among which 24 h pre-treatment of CTET (1 μmol/L),LTET(1 μmol/L),HI-IM(1 μmol/L)and 3,3'-diindoly methane(DIM)(0.3 μmol/L)showed significant increase of cell survival rate following irradiation with γ-ray,and the difficence was statistically significant(P<0.05, P<0.01).However,CT(1 μmol/L),LTr-1(1 μmol/L)and ICZ(1 μmol/L)showed no effect on cell survival rate caused by radiation(P>0.05).Furthermore,CTET,LTET,HI-IM and DIM activated the phosphorylation of ATM,BRCA1 and NBS1 proteins.HI-IM significantly decreased radiation-caused cell death and apoptosis.ConclusionsCTET, LTET,HI-IM,and DIM can significantly reduce the radiosensitivity in 184A1 cells,and the mechanism may be related to the regulation of DNA damage and the repair of protein phosphorylation.
Indole-3-carbinol acid condensation products;Radiation injuries;DNA damage and repair; Apoptosis
樊赛军,Email:fansaijun@irm-cams.ac.cn
10.3760/cma.j.issn.1673-4181.2016.03.004
科技部科研院所技术开发研究专项(2014EG150134);国家自然科学基金(81172127,81572969);天津科技支撑项目(14ZCZDSY00001);中国医学科学院放射医学研究所发展基金(1559,1549)Corresponding author:Fan Saijun,Email:fansaijun@irm-cams.ac.cn
2016-04-30)

