叶酸靶向载紫杉醇磷脂-聚合物杂化纳米粒的制备及其体外细胞评价
陈卓 王海 肖宝 胡春艳 务圣洁 樊帆 秦玉 朱敦皖 张琳华
300192天津,中国医学科学院北京协和医学院生物医学工程研究所,天津市生物医学材料重点实验室
·论著·
叶酸靶向载紫杉醇磷脂-聚合物杂化纳米粒的制备及其体外细胞评价
陈卓 王海 肖宝 胡春艳 务圣洁 樊帆 秦玉 朱敦皖 张琳华
300192天津,中国医学科学院北京协和医学院生物医学工程研究所,天津市生物医学材料重点实验室
目的制备具有叶酸靶向性的载紫杉醇磷脂-聚合物杂化纳米粒(PTX-FLPNPs),并研究其对乳腺癌细胞EMT-6的细胞毒性及体外细胞吞噬。方法以聚己内酯-聚乙二醇-聚己内酯(PCL-PEG-PCL)、二硬脂酰基磷脂酰乙醇胺-甲氧基聚乙二醇(DSPE-mPEG2000)和叶酸偶联的磷脂(Folate-PEG(2000)-DSPE)为药物载体,通过薄膜水化法自组装制备PTX-FLPNPs,并对其进行表征;使用激光扫描共聚焦显微镜观察比较叶酸受体高表达的乳腺癌细胞EMT-6对叶酸靶向及无靶向杂化纳米粒的吞噬作用;采用MTS法研究PTX-FLPNPs对EMT-6细胞的细胞毒性。结果成功制备了PTX-FLPNPs,其呈球形,粒径均匀,具有明显的“核-壳”结构。投药量为30%的PTX-FLPNPs的平均粒径为(279.9±8.7)nm,多分散系数为0.173±0.021,Zeta电位为(-17.5±1.1)mV,载药量为(27.36±0.91)%,包封率为(91.16±1.12)%。细胞吞噬实验表明,叶酸受体高表达的EMT-6细胞对叶酸靶向的杂化纳米粒的吞噬作用明显强于无靶向的杂化纳米粒(P<0.05)。细胞毒性实验结果表明,PTX-FLPNPs的细胞毒性低于紫杉醇注射剂,且对肿瘤细胞的抑制效果优于无靶向的杂化纳米粒。结论PTX-FLPNPs具有较高载药量及包封率,粒径均匀,可通过主动靶向作用介导肿瘤细胞内吞,并增加药物在肿瘤细胞内的浓度,是一种能有效抑制肿瘤的靶向载药纳米制剂。
紫杉醇;磷脂-聚合物杂化纳米粒;叶酸靶向;细胞吞噬;细胞毒性
Fund program:General Program of National Natural Science Foundation of China(81571793,51373199); Natural Science Foundation of Tianjin(15JCZDJC38300)
0 引言
紫杉醇(paclitaxel,PTX)是从红豆杉科红豆杉属植物紫杉的树皮中分离得到的天然二萜类抗癌药,主要用于卵巢癌、乳腺癌及非小细胞肺癌的临床治疗[1]。由于PTX在水中溶解度极低,临床用聚氧乙烯蓖麻油和乙醇等比例混合的溶剂溶解后给药,但该助溶剂会引发严重过敏反应以及神经毒性和肾毒性等不良反应[2]。因此,设计更易被患者接受的PTX新型制剂以减少传统助溶剂引发的毒副作用成为一个重要的研究方向,如脂质体、微乳、纳米粒及包合物等[3-7]。
磷脂-聚合物杂化纳米粒(lipid-polymer hybrid nanoparticles,LPNPs)是一种同时兼备脂质体及聚合物胶束优点而避免两者缺点的新型药物载体[8]。LPNPs具有能增溶疏水性药物的疏水性聚合物内核;外层被磷脂层包裹,使其具有良好的生物相容性、稳定性以及体内长循环特性;表面还可用具有靶向能力的配体修饰获得主动靶向功能[9-10]。
叶酸(folic acid,FA)是细胞增殖时参与碱基合成的必需维生素,其受体在多种癌细胞表面过度表达[11-12],而在人体正常组织中的表达高度保守。叶酸具有无毒、无免疫原性、稳定性好、与受体亲和力强等优点,且通过叶酸与其受体的特异性结合,可介导细胞内吞作用摄取药物[13]。因此,叶酸也成为目前应用最多的用于主动靶向修饰的配体[14-15]。
本研究采用聚己内酯-聚乙二醇-聚己内酯(PCL-PEG-PCL)、二硬脂酰基磷脂酰乙醇胺-甲氧基聚乙二醇(DSPE-mPEG2000)、偶联叶酸的磷脂(Folate-PEG(2000)-DSPE)为药物载体,通过薄膜水化法使其自组装以制备具有叶酸靶向性的载紫杉醇磷脂-聚合物杂化纳米粒(PTX-FLPNPs),研究肿瘤细胞对其的吞噬效果及其对肿瘤细胞的细胞毒性。
1 材料与方法
1.1 主要材料与仪器
PCL-PEG-PCL聚合物(PCL相对分子质量为4 000 u,PEG相对分子质量为8 000 u)(中国医学科学院生物医学工程研究所基因工程实验室合成),DSPE-mPEG2000、Folate-PEG(2000)-DSPE(美国Avanti Polar Lipids公司),PTX注射剂(6 mg/ml)(北京协和药厂),PTX原料药(纯度>99%)(中国重庆美联制药有限公司),无叶酸的RPMI1640培养基、胎牛血清、胰蛋白酶(美国Gibco公司),尼罗红(Nile Red,NR)(美国Sigma公司),4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染色液、微丝绿色荧光探针(Actin-Tracker Green)、免疫荧光染色二抗稀释液、免疫染色固定液、免疫染色洗涤液(上海碧云天生物技术有限公司),MTS试剂(美国Promega公司),其他试剂均为市售分析试剂。
Eyela N-1001旋转蒸发仪(日本东京理化公司),VCX-130PB超声波细胞破碎仪(美国Sonics& Materials公司),J-25高速冷冻离心机(美国Beckman公司),Nano-ZS粒度分析仪(英国Malvern公司),Tecnai-F20透射电子显微镜(荷兰FEI公司),高效液相色谱仪(high performance liquid chromatography, HPLC)(美国Waters公司),LSM710全光谱型激光扫描共聚焦显微镜(德国Carl ZEISS公司),FTS-3L真空冷冻干燥机(美国US Filter公司),CO2培养箱(日本SANYO公司)。
1.2 方法
1.2.1 PTX-FLPNPs的制备
采用薄膜水化法进行PTX-FLPNPs的制备。具体方法为:将PCL-PEG-PCL、PTX原料药、DSPE-mPEG2000、Folate-PEG(2000)-DSPE(质量比为70∶33∶7∶0.7)加入茄型瓶中,加适量二氯甲烷充分溶解,混合均匀,35℃下使用旋转蒸发仪旋转蒸发除去有机溶剂制成均匀薄膜,吹氮气5 min并抽真空过夜除去残余有机溶剂。向茄型瓶中加入65℃去离子水并置于65℃环境中水化1h,然后冰浴中使用超声波细胞破碎仪对样品超声10 min,即得PTX-FLPNPs的分散液。使用高速冷冻离心机23 000 r/min离心30 min,收集沉淀并用去离子水重悬-离心洗涤3次,除去未包载药物。冷冻干燥后得PTX-FLPNPs冻干粉。采用以上方法,在载体中不加入Folate-PEG(2000)-DSPE制备无靶向修饰的紫杉醇磷脂-聚合物杂化纳米粒(PTX-LPNPs)。
1.2.2 PTX-FLPNPs的表征
(一)平均粒径及分布、Zeta电位的测定
室温下取适量PTX-FLPNPs分散液,加去离子水将聚合物的质量浓度稀释至1 mg/ml,使用粒度分析仪对样品平均粒径及其分布、Zeta电位进行测定,每项测定3次。
(二)形态观察
取少量PTX-FLPNPs分散液滴至铺有膜的铜网上,自然晾干,使用透射电子显微镜观察其形态。(三)载药量和包封率测定
采用HPLC法测定PTX-FLPNPs的载药量和包封率。精密称取PTX-FLPNPs冻干粉5 mg,使用5 ml
乙腈溶解,并加入去离子水定容至10 ml,混合均匀后经0.22 μm滤膜过滤为样品溶液备用。HPLC实验条件:反向C18色谱柱(150.0 mm×4.6 mm,5 μm);流动相为乙腈∶水(体积比为50∶50);流速为1.0ml/min;紫外检测波长为227 nm;进样量为20 μl;柱温为室温。用HPLC测定溶液中PTX的峰面积,结合PTX标准曲线计算载药量与包封率。

1.2.3 细胞培养
乳腺癌细胞EMT-6培养于无叶酸的RPMI1640培养基(含体积分数为10%的胎牛血清,质量浓度为10 g/L的青霉素,10 g/L链霉素)中,在37℃、饱和湿度、5%CO2的细胞培养箱中培养,维持细胞处于对数生长期,备用。
1.2.4 PTX-FLPNPs的体外细胞吞噬研究
(一)荧光标记的LPNPs的制备
(二)荧光显微镜观察纳米粒的摄取
取处于对数生长期的EMT-6细胞接种于激光共聚焦培养皿中,在细胞培养箱中培养24 h,使之贴壁生长。然后吸弃培养基,分别加入用无血清的无叶酸RPMI1640培养基稀释的质量浓度为0.25 mg/ml的NR-FLPNPs和NR-LPNPs。细胞培养箱中培养2 h后,吸弃纳米粒,将细胞固定,用微丝绿色荧光探针对细胞微丝进行荧光染色,细胞核使用DAPI染色。最后,通过激光扫描共聚焦显微镜观察细胞对NR-FLPNPs和NR-LPNPs的吞噬效果。
(三)细胞摄取的定量研究
取处于对数生长期的EMT-6细胞,以每孔约5000个细胞的密度接种于黑色96孔板中,在细胞培养箱中培养24 h使其贴壁生长;然后吸弃培养基,实验组每孔加入上述0.25 mg/ml的NR-FLPNPs或NR-LPNPs分散液,阴性对照组则加入相同浓度的LPNPs分散液,阳性对照组暂时不加任何纳米粒;将96孔板置于细胞培养箱中分别孵育0.5、2、24 h,随后在阳性对照组中加入0.25 mg/ml的NR-LPNPs分散液,并使用RIPA裂解液将各组细胞裂解,用酶标仪于激发波长552 nm、发射波长636 nm下测定其荧光值。计算细胞对纳米粒的吞噬率(%)

1.2.5 PTX-FLPNPs的体外细胞毒性研究
取处于对数生长期的EMT-6细胞,以每孔约5 000个细胞的密度接种于96孔板中,在细胞培养箱中培养24 h后更换培养液。实验组为PTX注射剂组(25 μg/ml)、PTX-FLPNPs组(PTX质量浓度为25μg/ml)、PTX-LPNPs组(PTX质量浓度为25μg/ml)、叶酸靶向的不载药磷脂-聚合物杂化纳米粒(FLPNPs)组;对照组为阴性对照组(有细胞,不加药)和空白对照组(无细胞,不加药)。将细胞培养板移入细胞培养箱中培养24、48、72 h后,小心吸弃孔板内的上清液。然后每孔加入100 μl培养基和20 μl MTS试剂,细胞培养箱中培养2 h后,使用酶标仪震荡10 min,490 nm处测定吸光度(OD)值。按下式计算细胞抑制率(%),并绘制细胞生长抑制曲线。

1.3 统计学方法
采用SPSS13.0统计学软件处理数据,数据以均值±标准差(x±s)表示,样品间比较采用t检验,以P<0.05为差异具有统计学意义。
试验表明,传统RBM算法在迭代次数达到70~80次时,RMSE达到了最低,也就是预测误差率达到了最小,改进的SRBM算法仅仅在迭代次数达到20次时,RMSE就已经达到达到最低。试验结果表明改进的SRBM算法比传统的RBM算法评分预测效果更佳,能很好地提高评分预测准确率,以及大大地降低推荐的工作量,为用户提供更好的推荐。
2 结果与讨论
2.1 PTX-FLPNPs的制备及表征
以PCL-PEG-PCL、Folate-PEG(2000)-DSPE、DSPE-mPEG2000共混物作为药物载体材料,通过薄膜水化法自组装制备了PTX-FLPNPs,并在疏水力作用下使疏水性药物PTX均匀分散于疏水性PCL链段形成的内核结构中,从而将PTX载入FLPNPs。
PTX-FLPNPs的透射电镜图如图1A所示,PTXFLPNPs呈球形,颗粒均匀,具有“蘑菇状”的表面结构。由于疏水性作用力,自组装过程中PCL-PEG-PCL的PCL链段、Folate-PEG(2000)-DSPE和DSPE-mPEG2000的DSPE端以及PTX相互吸附、缠绕、包裹,形成杂化纳米粒的内核结构,而各材料的PEG链段则留在杂化纳米粒表面,形成亲水性的外壳结构。PTX-FLPNPs的这种“核-壳”结构中,疏水性内核起到增溶PTX的作用,亲水性的外壳则可提高杂化纳米粒的空间稳定性,延长其在体内的循环时间且避免被网状内皮系统(RES)吞噬,载药纳米粒通过增强渗透滞留效应(EPR)被动靶向到肿瘤部位累积;与此同时,杂化纳米粒表面修饰的叶酸结构可与叶酸受体特异性结合,将载药纳米粒主动靶向富集叶酸受体过度表达的肿瘤局部,并可介导肿瘤细胞的内吞作用摄取载药纳米粒。
用粒度分析仪对PTX-FLPNPs的平均粒径及其分布、Zeta电位进行测定。如图1B、1C所示,其平均粒径为(279.9±8.7)nm,多分散系数为0.173±0.021,Zeta电位为(-17.5±1.1)mV。PTX-FLPNPs具有较小的多分散系数和较高的Zeta电位,表明采用本研究的制备方法可制备出粒径较均一的载药LPNPs,且杂化纳米粒由于电荷排斥力不易聚集,可稳定地分散于溶液中。
采用HPLC法测定PTX-FLPNPs的载药量及包封率,结果表明,在PTX投药量为30%时,PTX-FLPNPs具有较高的载药量和包封率,其载药量为(27.36± 0.91)%,包封率为(91.16±1.12)%。由此可见,FLPNPs可有效地增溶PTX。
2.2 PTX-FLPNPs的体外细胞吞噬研究
以脂溶性红色染料NR代替PTX制备荧光标记的NR-FLPNPs和无靶向性的NR-LPNPs,并使用激光扫描共聚焦显微镜观察并比较叶酸受体高表达的乳腺癌细胞EMT-6对NR-FLPNPs及NRLPNPs的吞噬作用及杂化纳米粒在细胞中的定位。观察前,对EMT-6细胞进行固定,使用微丝绿色荧光探针(主要荧光物质为异硫氰酸荧光素(FITC))标记细胞微丝,蓝色荧光染料DAPI标记细胞核。
激光扫描共聚焦显微镜照片如图2所示,行1为EMT-6对NR-FLPNPs的吞噬情况;行2为EMT-6细胞对NR-LPNPs的吞噬情况。对比可见,行1中EMT-6细胞内红色荧光强度远高于行2,即叶酸受体高表达的EMT-6细胞对NR-FLPNPs的吞噬作用明显强于NR-LPNPs。
进一步的细胞摄取定量研究结果表明:EMT-6细胞与杂化纳米粒共孵育0.5 h和2 h后,细胞对NR-FLPNPs的吞噬率约是对NR-LPNPs吞噬率的2倍(P<0.05),说明靶向分子明显增强了杂化纳米粒进入靶细胞的能力;而共孵育24 h后,NR-FLPNPs和NR-LPNPs的细胞吞噬率相接近(P>0.05),这可能是由于长时间的培养,通过受体介导的细胞内吞已达到饱和,NR-FLPNPs与NR-LPNPs主要依靠其他非特异性的方式进入细胞,故EMT-6细胞对这两种纳米粒的吞噬间差异无统计学意义。(表1)
由细胞吞噬的定性及定量实验结果可知,FLPNPs可通过EMT-6细胞表面叶酸受体介导而大量被摄取进入肿瘤细胞内部,具有良好的主动靶向性,可增加药物在肿瘤细胞内的浓度,提高疗效,进而降低药物对其他组织的毒副作用。

表1 EMT-6细胞对两种杂化纳米粒的吞噬率(%)
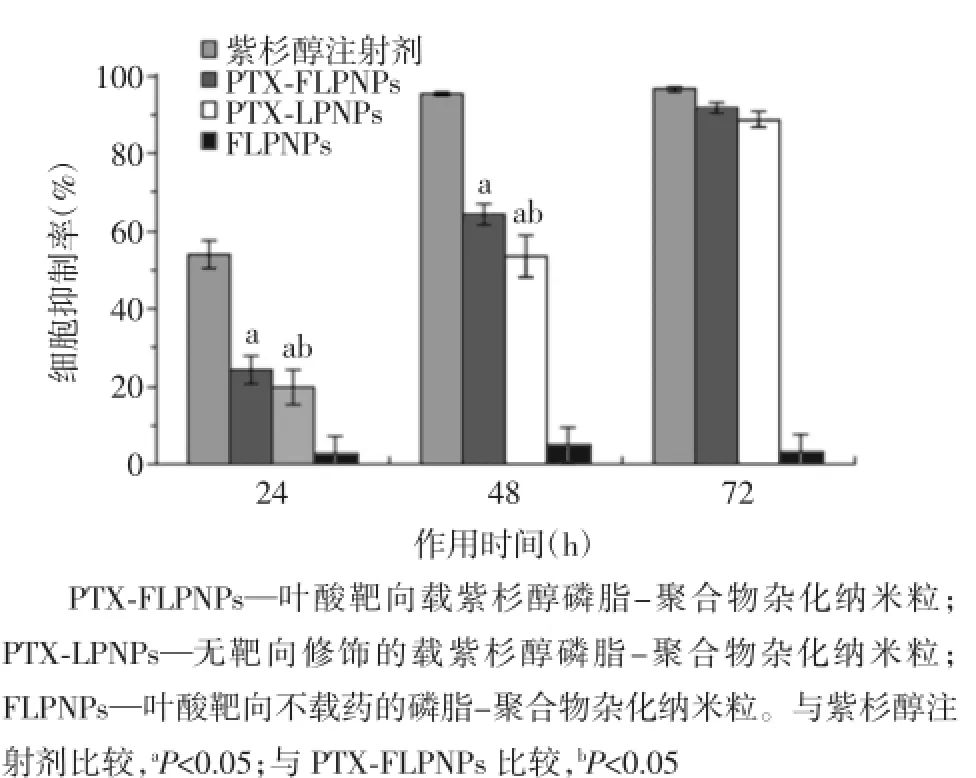
图3 紫杉醇质量浓度均为25 μg/ml的各组在不同作用时间对乳腺癌细胞EMT-6的生长抑制曲线
2.3 PTX-FLPNPs的体外细胞毒性研究
采用MTS法研究PTX-FLPNPs、PTX-LPNPs和FLPNPs对EMT-6细胞的毒性,并与临床使用的PTX注射剂进行比较。MTS试剂是一种用比色法来检测细胞增殖和细胞毒实验中活细胞数量的检测试剂,其可被活细胞生物还原成一种可溶于培养基的有色甲臜产物,且颜色深浅与培养基中的活细胞数量成正比,较传统的噻唑蓝(MTT)法更方便、快捷、灵活、安全。本研究中,各实验组细胞培养液(除FLPNPs组)所含PTX的质量浓度均选为人体血浆中PTX可存在的最大质量浓度[6]——25 μg/ml。各实验组对EMT-6细胞的生长抑制曲线如图3所示。FLPNPs组的细胞抑制率接近于0,表明磷脂-聚合物杂化纳米粒只作为载体,本身对细胞并无毒性,载药后其释放出来的药物对肿瘤细胞具有杀伤作用。培养24 h及48 h后,PTX注射剂组细胞抑制率显著高于杂化纳米粒组(P<0.05)。培养72 h后,PTX注射剂组、PTX-FLPNPs组和PTX-LPNPs组的细胞几乎完全被抑制生长,3组细胞抑制率间差异均无统计学意义(P>0.05)。PTX-FLPNPs组及PTX-LPNPs组细胞抑制率随培养时间的延长而上升,在培养24 h及48 h后,PTX-FLPNPs组的细胞抑制率高于PTX-LPNPs(P<0.05);而在培养72 h后,两组的细胞抑制率差异无统计学意义(P>0.05)。在培养24 h和48 h后,PTX-FLPNPs组及PTX-LPNPs组的细胞抑制率均低于PTX注射剂组,此现象可能因PTX注射剂直接作用于细胞,而杂化纳米粒中PTX需要从载体中释放出来,使得在同一作用时间,培养液中的药物浓度小于PTX注射剂。
3 结论
本研究成功地以PCL-PEG-PCL、DSPE-mPEG2000、Folate-PEG(2000)-DSPE为药物载体,通过薄膜水化法自组装制备了PTX-FLPNPs。研究结果表明,叶酸受体高表达的乳腺癌细胞EMT-6对FLPNPs的吞噬作用明显强于LPNPs;且PTX-FLPNPs对肿瘤细胞有明显的抑制效果,细胞毒性低于相同质量浓度的PTX注射剂。因此,PTX-FLPNPs是一种可通过主动靶向介导肿瘤细胞内吞作用而对其大量摄取,以增加药物在肿瘤细胞内的浓度,从而有效抑制肿瘤生长,并降低药物对其他组织毒副作用的载药纳米制剂。
利益冲突无
(图1、2见插页3-4)
[1]Biganzoli L,Licitra S,Moretti E,et al.Taxanes in the elderly:can we gain as much and be less toxic?[J].Crit Rev Oncol Hematol,2009, 70(3):262-271.DOI:10.1016/j.critrevonc.2008.07.017.
[2]Koudelka S,Turánek J.Liposomal paclitaxel formulations[J].J Control Release,2012,163(3):322-334.DOI:10.1016/j.jconrel.2012. 09.006.
[3]Bajaj G,Kim MR,Mohammed SI,et al.Hyaluronic acid-based hydrogelforregionaldeliveryofpaclitaxeltointraperitonealtumors[J]. J Control Release,2012,158(3):386-392.DOI:10.1016/j.jconrel. 2011.12.001.
[4]Duong HH,Yung LY.Synergistic co-delivery of doxorubicin and paclitaxel using multi-functional micelles for cancer treatment[J].Int JPharm,2013,454(1):486-495.DOI:10.1016/j.ijpharm.2013.06.017.
[5]Larson N,Yang J,Ray A,et al.Biodegradable multiblock poly(N-2-hydroxypropyl)methacrylamide gemcitabine and paclitaxel conjugates for ovarian cancer cell combination treatment[J].Int J Pharm, 2013,454(1):435-443.DOI:10.1016/j.ijpharm.2013.06.046.
[6]Danhier F,Lecouturier N,Vroman B,et al.Paclitaxel-loaded PEGylatedPLGA-basednanoparticles:invitroandinvivo evaluation[J].J Control Release,2009,133(1):11-17.DOI:10.1016/ j.jconrel.2008.09.086.
[7]董霞,刘兰霞,朱敦皖,等.低分子质量壳聚糖修饰多壁碳纳米管的制备及细胞毒性研究[J].国际生物医学工程杂志,2015, 38(1):11-14.DOI:10.3760/cma.j.issn.1673-4181.2015.01.003. Dong X,Liu LX,Zhu DW,et al.Preparation and cytotoxicity study of multi-wailed carbon nanotubes modified with low-molecularweight chitosan[J].Int J Biomed Eng,2015,38(1):11-14.DOI:10.3760/cma.j.issn.1673-4181.2015.01.003.
[8]Gao J,Xia Y,Chen H,et al.Polymer-lipid hybrid nanoparticles conjugated with anti-EGF receptor antibody for targeted drug delivery to hepatocellular carcinoma[J].Nanomedicine(Lond),2014, 9(2):279-293.DOI:10.2217/nnm.13.20.
[9]Yin TJ,Dong LH,Cui B,et al.A toxic organic solvent-free technology for the preparation of PEGylated paclitaxel nanosuspension based on human serum albumin for effective cancer therapy[J].Int J Nanomedicine,2015,10:7397-7412.DOI:10.2147/IJN.S92697.
[10]Hadinoto K,Sundaresan A,Cheow WS.Lipid-polymer hybrid nanoparticles as a new generation therapeutic delivery platform:a review[J].Eur J Pharm Biopharm,2013,85(3 Pt A):427-443.DOI:10.1016/j.ejpb.2013.07.002.
[11]闫真芳,徐希明,余江南.受体介导的靶向药物研究进展[J].药物生物技术,2009,16(05):481-485. Yan ZF,Xu XM,Yu JN.Advances in research of targeting drug delivery systems mediated by receptors[J].Pharm Biotechnol,2009, 16(05):481-485.
[12]王国栋,谭玉珍,王海杰.靶向纳米材料在肿瘤诊断和治疗中的研究进展[J].国际生物医学工程杂志,2014,37(6):371-375.DOI:10.3760/cma.j.issn.1673-4181.2014.06.014. Wang GD,Tan YZ,Wang HJ.Research progress of targeted nanomaterials on cancer diagnose and therapy[J].Int J Biomed Eng, 2014,37(6):371-375.DOI:10.3760/cma.j.issn.1673-4181.2014.06.014.
[13]张琳华,王海,马桂蕾,等.紫杉醇聚合物胶束及其抗肿瘤活性研究[J].国际生物医学工程杂志,2014,37(1):12-17.DOI:10.3760/ cma.j.issn.1673-4181.2014.01.003. Zhang LH,Wang H,Ma GL,et al.Study on antitumor activity of paclitaxel-loaded polymeric micelles[J].Int J Biomed Eng,2014, 37(1):12-17.DOI:10.3760/cma.j.issn.1673-4181.2014.01.003.
[14]Wang AZ,Gu F,Zhang L,et al.Biofunctionalized targeted nanoparticles for therapeutic applications[J].Expert Opin Biol Ther, 2008,8(8):1063-1070.DOI:10.1517/14712598.8.8.1063.
[15]Lazarou C,Kapsou M.The role of folic acid in prevention and treatment of depression:an overview of existing evidence and implications for practice[J].Complement Ther Clin Pract,2010, 16(3):161-166.DOI:10.1016/j.ctcp.2010.01.003.
Preparation and in vitro evaluation of folate-targeted lipid-polymer hybrid nanoparticles loaded with paclitaxel
Chen Zhuo,Wang Hai,Xiao Bao,Hu Chunyan,Wu Shengjie,Fan Fan,Qin Yu,Zhu Dunwan,Zhang Linhua
Institute of Biomedical Engineering,Chinese Academy of Medical Sciences&Peking Union Medical College,Tianjin Key Laboratory of Biomedical Material,Tianjin 300192,China
Zhang Linhua,Email:elley2001@sina.com
ObjectiveTo prepare folate-targeted lipid-polymer hybrid nanoparticles loaded with paclitaxel (PTX-FLPNPs),evaluate its in vitro cellular uptake and cytotoxicity.MethodsPTX-FLPNPs composed of PCLPEG-PCL,DSPE-mPEG2000 and Folate-PEG(2000)-DSPE were prepared by thin-film hydration method,and characterized in terms of morphology,particle size and size distribution,drug loading and encapsulation efficiency. The uptake efficiency of FLPNPs in breast carcinoma cells EMT-6 was evaluated by confocal laser scanning microscopy.The cytotoxicity of PTX-FLPNPs against EMT-6 cells was determined by MTS assay.ResultsPTXFLPNPs showed spherical core-shell morphology with narrow size distribution.The PTX-FLPNPs with 30%drugloading content were found as spherical shape with average particle diameter of(279.9±8.7)nm,polydispersity index of(0.173±0.021),Zeta potential of(-17.5±1.1)mV,drug loading of(27.36±0.91)%and encapsulation efficiency of (91.16±1.12)%.The internalization efficiency of FLPNPs was obviously higher that of LPNPs in EMT-6 cells which overexpress folate receptor(P<0.05).The cytotoxic effect of PTX-loaded FLPNPs was lower than that of PTX injection,but higher than that of PTX-loaded LPNPs(without folate conjugation).ConclusionsThe PTX-FLPNPs exhibits high drug-loading content and drug encapsulating efficiency,uniform size with narrow size distribution,high internalization efficiency in EMT6 cells by active targeting-mediated endocytosis.The PTX-FLPNPs would be a promising nanosized drug formulation for tumor-targeted therapy.
Paclitaxel;Lipid-polymerhybridnanoparticles;Folatetargeted;Cellularuptake;Cytotoxicity
张琳华,Email:elley2001@sina.com
10.3760/cma.j.issn.1673-4181.2016.03.001
国家自然科学基金面上项目(81571793,51373199);天津市自然科学基金(15JCZDJC38300)
2016-03-20)

