四种不同品系大花君子兰的离体组织培养研究
武志文,敖 锋,邹凡雨,郭太君,高 翔,王 丽
(1.吉林农业大学园艺学院,吉林 长春 130118;
2.东北师范大学生命科学学院,吉林 长春 130024)
四种不同品系大花君子兰的离体组织培养研究
武志文1,敖锋2,邹凡雨2,郭太君1,高翔2,王丽2
(1.吉林农业大学园艺学院,吉林 长春 130118;
2.东北师范大学生命科学学院,吉林 长春 130024)
[摘要]以四种不同品系大花君子兰的幼子房为外植体进行了离体组织培养研究.结果表明:大花君子兰幼子房愈伤诱导和分化成苗的能力与品系、外植体时期、光照强度、低温处理时间、植物生长调节剂种类和质量浓度及酸水解酪素质量浓度等有关.愈伤诱导的最佳培养基为MS+蔗糖35 g/L+酸水解酪素0.4 g/L+BA 1.0 mg/L+NAA 1.0 mg/L+2,4-D 2.0 mg/L;分化成苗的最佳培养基为MS+蔗糖35 g/L+NAA 0.5 mg/L+KT 3.0 mg/L;生根的最佳培养基为1/2 MS培养基.
[关键词]大花君子兰;品系;幼子房;离体培养
君子兰(CliviaminiataRegel)为石蒜科君子兰属多年生草本植物,原产于南非;其株型端庄、叶姿挺拔、花姿优美、花色艳丽,是点缀居室厅堂、馈赠的理想花卉.[1-3]目前君子兰主要繁殖方式为种子繁殖和分株繁殖.但君子兰为高度杂合植株,种子繁殖难以保留亲本的优良性状;而分株繁殖速度慢、效率低,无法进行大规模商业化生产.[4-6]因此,许多国内外科研工作者开始探索利用组织离体培养技术快速繁殖君子兰,但研究进展较缓慢[7-8],且大部分研究以单一品系为研究对象,而外植体品系的不同可能导致研究结果出现较大差异.
本研究基于Wang等[9]的幼子房研究结果,以四种不同品系大花君子兰的幼子房为外植体进行了离体组织培养研究,以优化筛选出一套适合大花君子兰不同品系的离体培养技术.
1材料与方法
1.1供试材料
外植体为“和尚”“油匠”“细叶”和“水晶”4种品系的大花君子兰幼子房,依次编号为1,2,3和4号品系.
1.2试验方法
1.2.1外植体制备及接种培养方法
分别取1—4号品系的幼子房,将单个子房取下,在超净工作台中,用75%的酒精浸泡1 min后,再用0.1%氯化汞溶液处理8 min,无菌蒸馏水冲洗5遍,用无菌滤纸吸干多余水分.将每个幼子房平均切成4块,接种于诱导愈伤培养基中.
1.2.2培养条件的优化
取不同时期的外植体,通过不同时间的低温处理、不同的光照强度处理和不同质量浓度的酸水解酪素处理,筛选出最佳的培养条件.
1.2.3不同品系君子兰愈伤诱导、分化出苗和生根
以4种不同品系君子兰绿色花苞的幼子房为外植体进行24 h 4℃的低温处理,然后将消毒后的外植体接种于愈伤培养基中,每个品系接种80个外植体(20瓶×4块),接种后放入光照培养箱中,23℃,2 000 lx光照8 h,40 d继代一次,2个月后统计愈伤组织的诱导情况.愈伤诱导率=形成愈伤组织的外植体数/存活外植体数×100%.待愈伤组织长到2 cm×2 cm大小时,转到分化培养基.每个品系分化40块愈伤组织(20瓶×2块),23℃,2 000 lx光照10 h,40 d继代一次.统计转分化培养基4个月时的分化率及平均每块愈伤组织的出芽率,分化率=分化的愈伤组织数/存活愈伤组织数×100%.当再生叶片数达到两片时即可诱导生根:将苗分成单株转入生根培养基中诱导生根,用2 000 lx的日光灯光照14 h/d,40 d继代一次.统计两个月时的生根情况.生根率=生根植株/接种存活苗数×100%.
愈伤培养基:以MS为基础培养基,添加不同质量浓度的BA,NAA和2,4-D;酸水解酪素0.4 g/L,蔗糖35 g/L,琼脂5 g/L;pH=5.8.
分化培养基:以MS为基础培养基,添加不同质量浓度的NAA和KT;蔗糖35 g/L,琼脂5 g/L;pH=5.8.
生根培养基:以1/2 MS为基础培养基,添加蔗糖35 g/L和琼脂粉5 g/L;pH=5.8.
1.2.4离体再生植株的移栽
对诱导生根后的再生植株进行练苗,移栽到经过消毒的掺有腐叶和细沙的混合土中.移栽培养2个月左右,植株开始长出新根,可正常生长.
2结果与分析
2.1培养条件的优化
2.1.1不同取材时期对愈伤组织诱导的影响
根据幼子房上部花开的不同状态,可将幼子房分为3个时期(绿色花苞期、半开花苞期、盛开花苞期),将消毒后的幼子房接种于愈伤培养基上,统计不同开花时期幼子房的愈伤诱导率(见表1).
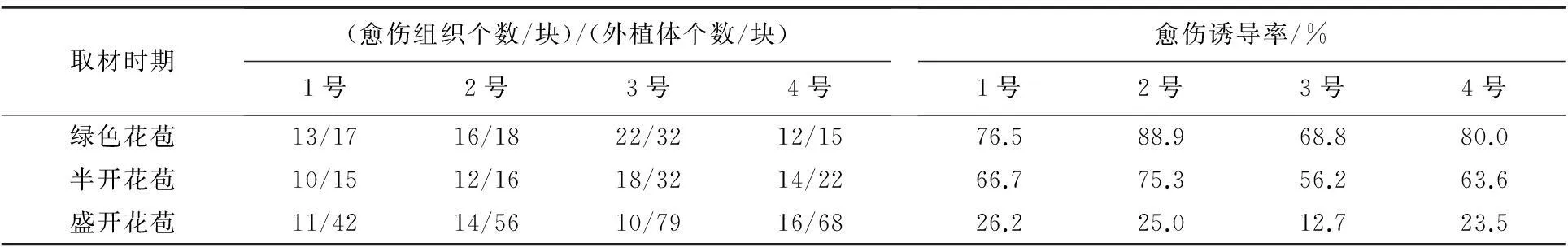
表1 不同取材时期对愈伤组织形成的影响
结果显示,利用绿色花苞期的幼子房为外植体愈伤组织的诱导率最高,开花时间与愈伤诱导率呈负相关变化.因此,尽管大花君子兰的花期很长,但不同时期的幼子房对愈伤组织的诱导发生有明显的影响,故最好采用绿色花苞期的幼子房为外植体.
2.1.2低温处理对愈伤诱导率、分化率和污染率的影响
将外植体在4℃条件下进行低温预处理,设置0,1,2,3,4,5 d 6个时间梯度.消毒后接种于愈伤培养基上,统计不同时间低温处理的愈伤诱导率、分化率和污染率(见表2).

表2 低温处理对君子兰幼子房愈伤诱导率、分化率和污染率的影响
结果显示,低温处理外植体对愈伤诱导和污染有较大的影响.低温处理1 d左右,愈伤诱导率最高且污染率较低,随着处理天数的增加诱导率逐渐降低、污染率随之升高,但低温处理对分化率影响不大,因此,最好不要将外植体低温处理过长时间.
2.1.3光照强度对愈伤形成的影响
将外植体接种到培养基后,分别放在500,1 000和2 000 lx强度的日光灯下照射培养,每个处理50块.两个月后统计愈伤诱导情况(见表3).

表3 不同光强对诱导愈伤的影响
结果显示,在500~2 000 lx范围内随着光照强度的增加,愈伤诱导率呈上升趋势,但在1 000~2 000 lx范围内增加幅度有所降低.有研究显示,君子兰离体培养时喜弱光,但很少给出弱光的具体范围,因此,以实验结果2000 lx作为较佳的光照强度.
2.1.4酸水解酪素的浓度对愈伤诱导的影响
酸水解酪素是多种氨基酸的混合物,可以提供丰富的有机氮素营养,是良好的组织培养添加物.培养基上添加一定浓度的酸水解酪素可以增加愈伤诱导,减少褐化的出现.[10]实验设置了3个质量浓度(200,400和600 mg/L)梯度和空白对照,以筛选出最适宜的质量浓度(见图1).
结果显示,与空白对照相比,随着水解络蛋白质量浓度的增加,愈伤诱导率有所增加,400 mg/L处理效果最佳,当质量浓度达到600 mg/L时,诱导率有所降低且大部分愈伤呈现玻璃化状态.
2.2不同品系君子兰愈伤诱导、分化出苗和生根结果
将幼子房消毒后接种于愈伤培养基中,几天后外植体开始膨胀并产生白色绒毛,2个月时产生黄绿色、表面致密呈颗粒状、有光泽的愈伤组织,不同品系的愈伤组织状态不同.转入分化培养基后,愈伤组织生长迅速,表面出现绿色芽点,通过4个月的分化诱导产生大量丛生芽(见图2).

a—d依次为1—4号品系接种1 d的外植体;e—h依次为1—4号品系诱导60 d后的愈伤组织;
2.2.1愈伤诱导阶段
采用优化后的培养条件,以MS为基本培养基,设计10种不同激素组合配比(C1—C10),2个月后观察愈伤组织诱导情况(见表4).

表4 不同植物生长调节剂种类及浓度对愈伤组织形成的影响
从表4可以看出,植物调节剂2,4-D对君子兰愈伤诱导的形成至关重要;C3为4种品系幼子房最佳愈伤诱导培养基,同一培养基不同品系之间愈伤诱导率差异较大.
2.2.2分化出苗阶段
以MS为基础培养基,设计8种不同激素组合配比(D1—D8),转入分化培养基4个月后统计其分化率和出芽数(见表5).

表5 不同植物生长调节剂种类及浓度对分化成芽的影响
从表5可以得出,D3和D7分化率较高,但D7出苗数较D3多,因此选D7为最佳分化培养基.同一培养基不同品系之间分化率和出苗率均有明显差异;在D7培养基下,2号品系平均分化率高于其他品系,达到88.3%,平均出芽数为20.5个.
2.2.3不同植物生长调节剂种类及浓度对诱导生根的影响
诱导产生的丛生芽一部分可在分化培养基中就开始生根,不能在分化培养基上生根的再生苗转入生根培养基两个月后大多数都会出根.生根培养基以MS为基础培养基,加入适当的NAA和KT,2个月后统计生根率(见表6).

表6 不同植物生长调节剂种类及浓度对生根的影响
结果表明,激素的加入与空白对照没有显著差异,而且减少碳源的供应可以加速自身的光合作用,对试管苗没有影响.因此,我们选用R4作为最佳生根培养基,其中3号品系的生根率高于其他品系达到100%.
2.3再生植株的移栽

图3 2号品系的再生植株
君子兰再生植株的移栽以2号品系为例.诱导生根3个月后,将再生植株进行3~5 d的练苗,然后移栽到经过消毒的掺有腐叶和细沙的混合土中,给予适应的光照和湿度等进行培养.移栽培养2个月左右,植株开始长出新根,正常生长;再生苗移栽成活率高达95%以上,再生植株之间相似度很高(见图3).
3讨论
在君子兰的组织培养中,常以成熟胚为外植体,其遗传稳定性较差,不能良好继承亲本的优良性状;选用叶片作外植体,一般需要获得无菌植株后进行培养,否则不同状态的叶片需要的消毒时间差异较大,比较烦琐.选用幼子房为外植体能保持亲体优良的性状,且能直接取外界材料进行培养,消毒时间差异较小.通过对4种大花君子兰幼子房的培养,我们优化了一套比较理想的培养体系,即愈伤诱导的最佳培养基为MS+蔗糖35 g/L+酸水解酪素0.4 g/L+BA 1.0 mg/L+NAA 1.0 mg/L+2,4-D 2.0 mg/L;分化成苗的最佳培养基为MS+蔗糖35 g/L+NAA 0.5 mg/L+KT 3.0 mg/L;生根的最佳培养基为1/2 MS培养基.
不良的培养条件也会导致君子兰离体培养时出现褐化、老化和玻璃化等现象,因此,筛选适宜的外植体时,取材时间和部位以及光照强度、低温处理时间等外界条件对君子兰的离体培养尤为重要.本实验对影响离体培养的条件进行了优化,筛选出了较佳的培养条件:开花1~3 d的绿苞期幼子房为较佳的取材时间和部位;对外植体进行24 h的低温处理;光照强度为2 000 lx;愈伤诱导期加入一定量的酸水解络素,适宜质量浓度为400 mg/L.本文同时也进行了暗处理实验,结果显示暗处理对愈伤诱导和分化影响不大.
随着组织培养技术的发展,影响其普遍适用性的因素也逐渐显现,其中品系对组织离体培养的影响尤为重要.在其他很多物种中,已有大量的研究显示由于外植体品系的不同,组织离体培养的条件差异较大.[11-13]Ran等[14]人曾利用不同品系的大花君子兰进行了体外离体培养,结果并不理想.本文对大花君子兰的4个优良品系进行了离体培养的实验研究,结果表明,在相同的培养情况下,不同品系对愈伤诱导率和分化率影响较大.一般认为,不同品系之间存在再生率差异,可能受某种基因显性或部分显性控制.本实验为君子兰大规模工业化生产及其进一步的离体培养研究提供了资料.
[参考文献]
[1]WANG QIN-MEI,WANG YU-ZHANG,SUN LI-LI,et al.Direct and indirect organogenesis ofCliviaminiataand assessment of DNA methylation changes in various regenerated plantlets[J].Plant Cell Rep,2012,31:1283-1296.
[2]刘福平,林丽仙,郑明琼,等.君子兰组织培养[J].亚热带植物通讯,2000,29(3):50-51.
[3]郑玉红,贾春,顾永华,等.君子兰及其研究进展[J].北方园艺,2012(9):189-195.
[4]陈宣耀.君子兰名家精品集萃[M].沈阳:辽宁科学技术出版社,2008:20-32.
[5]郭文场,杨伯明,张亚兰,等.中国君子兰资源与开发利用[J].特种经济动植物,1998,1(1):41-44.
[6]刘敏,舒金生.垂笑君子兰的组织培养[J].园艺学报,1984,11(1)47-49.
[7]FINNIE J F.In vitro culture ofCliviaminiata[J].Clivia Yearbook,1998(1):7-11.
[8]邢桂梅,吴海红,徐兴伟,等.君子兰花器官离体培养[J].园艺学报,2007,34(6):1563-1568.
[9]WANG QIN-MEI,GAO FENG-ZHANG,GAO XIANG,et al.Regeneration ofCliviaminiataand assessment of clonal fidelity of plantlets[J].Plant Cell Tiss Organ Culture,2012,109:191-200.
[10]谢志兵.水解酪蛋白和不同碳源在猕猴桃组织培养的作用[J].农业与技术,2003,23(4):56-59.
[11]梁计南,谭中文,谭志勇,等.甘蔗不同基因型组织培养特性的研究[J].华南农业大学学报,2002,23(4):37-40.
[12]张东武,刘辉,赵惠贤.小麦成熟胚组织培养再生体系的优化及高再生率基因型的筛选[J].麦类作物学报,2011,31(5):847-852.
[13]赵鸿飞,周延清,姚换灵,等.不同基因型怀地黄组织培养及植株再生研究[J].安徽农业科学,2011 39(2):673-674.
[14]YIDONG RAN,SANDRA SIMPSON.In vitro propagation of the genusClivia[J].Plant Cell Tiss Organ Culture,2005,81:239-242.
(责任编辑:方林)
Research on tissue culture for four strains ofCliviaminiata
WU Zhi-wen1,AO Feng2,ZOU Fan-yu2,GUO Tai-jun1,GAO Xiang2,WANG Li2
(1.College of Horticulture,Jilin Agricultural University,Changchun 130118,China;2.School of Life Sciences,Northeast Normal University,Changchun 130024,China)
Abstract:A tissue culture system responsible for four strains of Clivia miniata Regel was developed using young ovaries as explants.The results showed that callus induction and differentiation rate was influenced by cultivar background,status of explant,light intensity,temperature treatment,components and concentration of plant growth regulators as well as concentration of casein hydrolysate.The best callus induction medium was MS+sucrose 35 g/L+hydrolysis casein 0.4 g/L+BA 1.0 mg/L+NAA 1.0 mg/L+2,4-D 2.0 mg/L,the optimum regeneration medium was MS+sucrose 35 g/L+NAA 0.5 mg/L+KT 3.0 mg/L,and 1/2 MS was showed to be the best rooting medium.
Keywords:Clivia miniata Regel;cultivar;young ovary;tissue culture
[中图分类号]S 682.1+3[学科代码]210·4060
[文献标志码]A
[作者简介]武志文(1989—),男,硕士研究生;通讯作者:王丽(1957—),女,博士,教授,博士研究生导师,主要从事植物花色和花香代谢的分子机制研究.
[基金项目]吉林省科技发展计划项目(20140307021NY;20130604037TC).
[收稿日期]2015-06-12
[文章编号]1000-1832(2016)01-0115-06
[DOI]10.16163/j.cnki.22-1123/n.2016.01.024

