同浓度NaHCO3溶液和CH3COONa溶液pH的比较研究
谢 雕唐 娅
(1重庆第三十七中学 重庆 400084;2重庆育才中学 重庆 400050)
同浓度NaHCO3溶液和CH3COONa溶液pH的比较研究
谢雕1唐娅2
(1重庆第三十七中学重庆400084;2重庆育才中学重庆400050)
摘要:在高中阶段,同浓度的NaHCO3溶液和CH3COONa溶液的pH比较在高中习题和各地高考题中都多次涉及,但笔者经过多方面实验和计算,发现两者比较存在很多问题,教师编制练习题时应审慎处理。
关键词:NaHCO3溶液;CH3COONa溶液;pH值;比较
“电离平衡”相关知识作为选修四《化学反应原理》中的重要章节,对学生的思维和理解能力要求较高,是学生学习时的难点内容。在笔者多年的高中教学中,时常遇到同浓度的NaHCO3和CH3COONa溶液pH大小的比较问题,各地模拟及高考试题中均有涉及。例如:
【2014全国新课标卷II第11题】在一定温度下,下列溶液的离子浓度关系正确的是( )
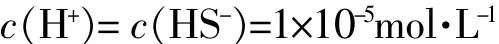
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)=c(OH-)+ c(HC2O4-)
D.pH相同的①CH3COONa②NaHCO3③NaC1O三种溶液的c(Na+):①>②>③
正确答案:D
对于D选项在高中教学中我们很多教师通常会这样处理:常见酸的酸性强弱关系为CH3COOH>H2CO3>HC1O相同浓度盐的水解程度为CH3COO-<HCO3-<C1O-,因此,同浓度时pH大小关系为CH3COONa<NaHCO3<NaC1O。现三种盐的pH相同,故浓度关系为CH3COONa>NaHCO3>NaC1O。
但整个分析过程中,我们似乎忽略了碳酸氢钠溶液中HCO3-电离的影响,那么HCO3-的电离能否忽略呢,这是一个值得探究的问题。
首先,如果仅从水解知识分析,因为酸性强弱:CH3COOH>HCO3-,则水解程度:HCO3->CH3COO-,NaHCO3的碱性强于CH3COONa。但实际上NaHCO3较为复杂,因为HCO3-既能水解又能电离,电离和水解过程相互抑制,相互影响,也就是说由于HCO3-的电离会减弱HCO3-水解的碱性。综合考虑,二者的碱性不能简单的比较,忽略HCO3-电离的思考是不严谨的。因此,笔者从实验及理论分析等多个方面进行了研究。
一、初步实验
实验方案:分别配制1.00mo1·L-1、0.10 mo1·L-1、0.010 mo1·L-1、0.0010 mo1·L-1的NaHCO3溶液和1.00mo1·L-1、0.10 mo1·L-1、0.010 mo1·L-1、0.0010 mo1·L-1的CH3COONa溶液,用广泛pH试纸测试。
实验结果见图(1):

图1 NaHCO3溶液和CH3COONa溶液pH的测定
从测试结果可以看出:相同浓度的NaHCO3溶液的pH明显大于CH3COONa溶液。但是pH试纸的测试结果毕竟是不够精确的。因此,笔者又查阅大学教材从理论计算角度分析。
二、理论计算
1.不同浓度NaHCO3溶液的pH计算过程:
碳酸的电离常数:Ka1=4.2×10-7Ka2=5.6×10-11,当c(HCO3-)≥0.010 mo1·L-1时,cKa2>25Kw c>25Ka1
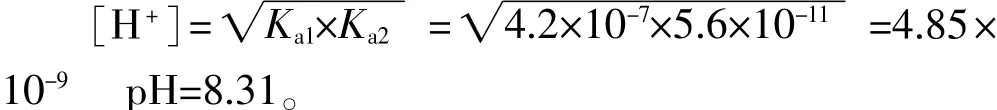
当c(HCO3-)=0.0010 mo1·L-1时,c Ka2<25Kwc>25Ka1

2.不同浓度NaHCO3溶液的pH计算过程:
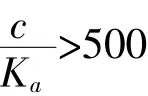

当c(CH3COO—)=1.00mo1·L-1pH=9.37
当c(CH3COO—)=0.10mo1·L-1pH=8.88
当c(CH3COO—)=0.010mo1·L-1pH=8.37
当c(CH3COO—)=0.0010mo1·L-1pH=7.87
结论:(1)NaHCO3溶液的pH随溶液浓度减小基本不变,只要其浓度大于0.010 mo1·L-1时,其pH都为8.31,因此NaHCO3溶液有抗稀释的能力,可形成缓冲体系。
(2)CH3COONa溶液的pH随溶液浓度减小而减小。
(3)在溶液的浓度都不小于0.01 mo1·L-1时,CH3COONa溶液的pH大于NaHCO3溶液;而在同浓度的极稀溶液中CH3COONa溶液的pH小于NaHCO3溶液。
由此可见,理论计算和pH试纸测试结果有较大出入。从pH试纸测试结果来看:相同浓度的NaHCO3溶液的pH明显大于CH3COONa溶液。而根据计算结果来看:在溶液的浓度都不小于0.010 mo1·L-1时,相同浓度的CH3COONa溶液的pH大于NaHCO3溶液。
由于理论计算与实验结果出现了较大的差异,所以笔者进行了更精确的实验研究。
三、精确实验
笔者先后两次找到了当地环保局,在监测站老师的帮助下,用新校正好的pH计测试,平行做了三次实验,其结果见表1:室温:20℃。
四、结果分析
1. pH计测试结果与理论计算值基本符合而与pH试纸测试结果不相符合。当然用pH计测试结果比pH试纸测试结果应更具有说服力。
2.同浓度的NaHCO3溶液和CH3COONa溶液的pH比较是较为复杂的,不能一概而论,如果两者浓度比较大时(大于0.010 mo1·L-1)CH3COONa溶液的pH应比NaHCO3溶液大;如果两者浓度比较小时(小于0.010 mo1·L-1)CH3COONa溶液的pH应比NaHCO3溶液小。因此,高中阶段应该避开两者的比较。
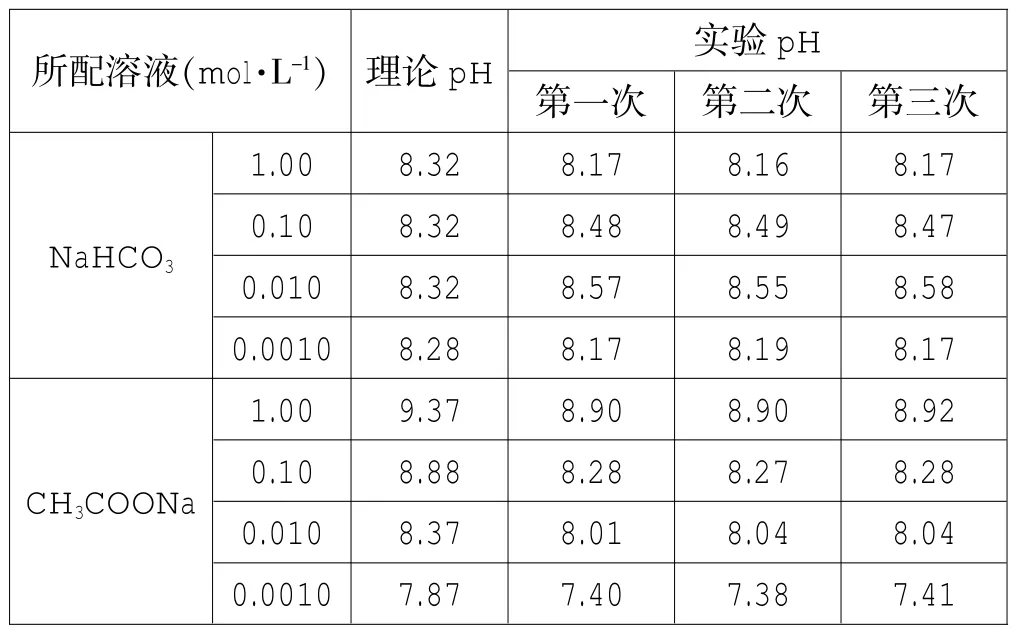
表1 NaHCO3溶液和CH3COONa溶液pH的测定
五、问题探讨
笔者在实验过程中发现了一些新的问题提出来与各位读者共同探讨:一是用pH计测出NaHCO3溶液的pH值与浓度的关系不合常理,从上面表格可以看出用pH计测得NaHCO3溶液的pH随浓度的减小呈先增大后减小的趋势,这与理论计算结果是不符合的,笔者检查了各个实验环节,结果和上表还是一样,笔者也没有查到相关文献的解释。二是从pH试纸测试结果看,相同浓度的NaHCO3溶液的pH明显大于CH3COONa溶液,这其中的原因又该如何解释。
通过本次研究,我深深地感受到了科研中的乐趣和挑战的激情。我们在教学中去发现,去质疑,去研究。在研究中,也许我们又会发现新的问题,产生新的疑问,但这就是教学研究的魅力,充满惊喜和神秘,让我们一起享受教科研,享受教学带给我们的惊喜!
参考文献
[1]华中师范大学等编.分析化学(第2版)[M].北京:高等教育出版社,1986,10

doi:10.3969/j.issn.1008-0546.2016.02.027
文章编号:1008-0546(2016)02-0084-02
中图分类号:G633.8
文献标识码:B

