对氯化钙鉴别碳酸钠和碳酸氢钠方法的再认识
王冬
(浙江省宁海中学 浙江宁海 315600)
对氯化钙鉴别碳酸钠和碳酸氢钠方法的再认识
王冬
(浙江省宁海中学浙江宁海315600)
摘要:通过对CaC12与NaHCO3溶液反应的逆向分析以及实验证实,在常量范围内,往CaC12溶液中滴加Na2CO3和NaHCO3溶液,会出现明显不同的实验现象,因此,在中学阶段完全可以用CaC12鉴别Na2CO3和NaHCO3溶液。
关键词:CaC12;Na2CO3;NaHCO3;鉴别
一、问题的背景
对于“能否用CaC12鉴别Na2CO3和NaHCO3溶液”这个问题,同行、专家进行了许多相关的研究[1-5],分别从浓度、气泡、压强、pH等角度提供了鉴别的依据。在浓度方面,得出的较为一致的认识是:用常量范围内的浓度即CaC12和NaHCO3溶液的浓度都大于0.01mo1/L时,两者会生成CaCO3沉淀,无法鉴别;用微量范围内的浓度即CaC12和NaHCO3溶液的浓度都小于0.0001mo1/L时,两者不会产生明显的浑浊,可以鉴别。对该结果的理论分析如下[6-7]:
若把0.01 mo1·L-1的氯化钙溶液与0.01 mo1·L-1的碳酸氢钠溶液等体积混合,首先计算混合后溶液中H+的浓度。已知:c(HCO3-)=0.01 mo1·L-1,Ka1=4.2× 10-7,Ka2=5.6×10-11,由于c(HCO3-)≥Ka1,所以
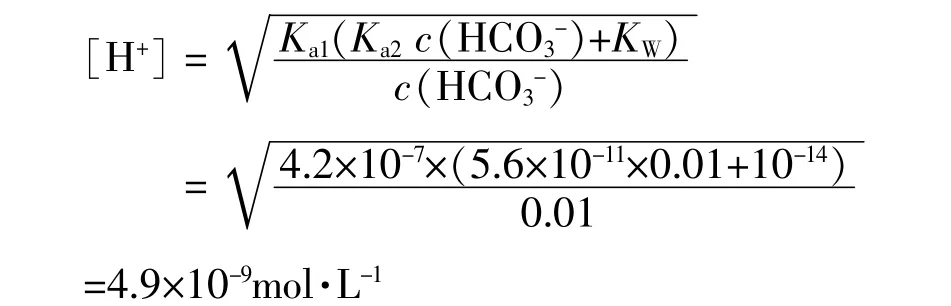
再求溶液中碳酸根离子的分布分数:
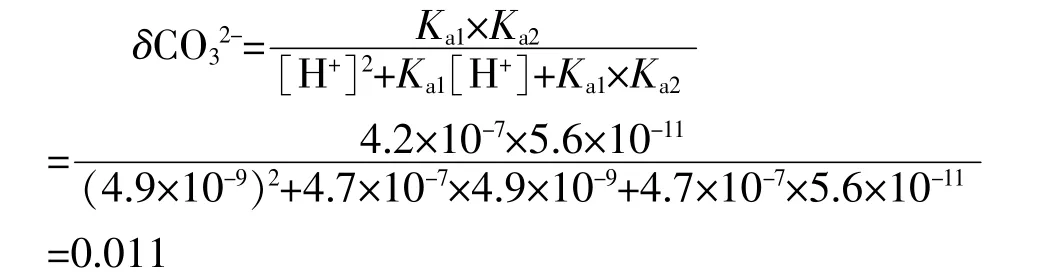
所以,碳酸根离子的平衡浓度c(CO32-)=δCO32-× c(HCO3-)=0.011×0.01 mo1·L-1=1.1×10-4mo1·L-1,又知碳酸钙的Ksp(CaCO3)=2.8×10-9,在混合后,0.01 mo1·L-1氯化钙与0.01 mo1·L-1碳酸氢钠溶液中Q =[Ca2+][CO32-]= 0.01×1.1×10-4= 1.1×10-6>Ksp(CaCO3)=2.8×10-9。
2.对CaC12与NaHCO3溶液反应的再思考

按照这个想法,笔者进行逆向分析,如果往CaC12溶液中滴加少量的NaHCO3溶液,此时,没有大量HCO3-的存在促进平衡向右移动,应该就不会产生白色沉淀。
3.实验证实
(1)配制0.01 mo1·L-1、0.1 mo1·L-1、1.0 mo1·L-1的CaC12溶液。
(2)分别取各浓度的CaC12溶液约1mL于两支试管中,分别滴加0.1 mo1·L-1的Na2CO3和NaHCO3溶液。结果如表1所示。
4.实验结论
通过对CaC12与NaHCO3溶液反应的逆向分析以及实验证实,在常量范围内,往CaC12溶液中滴加Na2CO3和NaHCO3溶液,会出现明显不同的实验现象,因此,在中学阶段完全可以用CaC12鉴
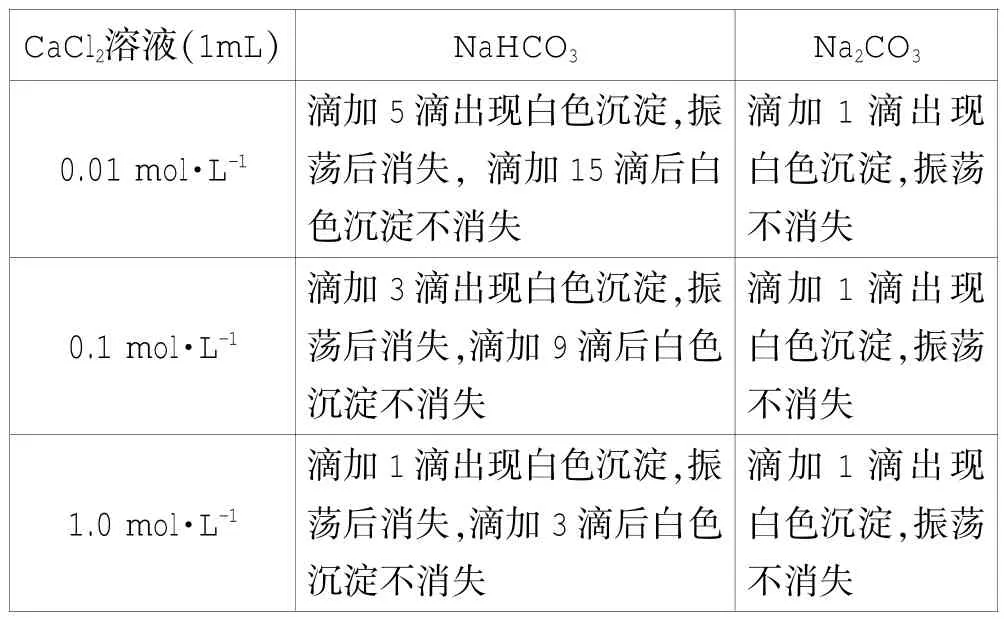
表1 0.1 mo1·L-1的Na2CO3和NaHCO3与不同浓度的CaC12溶液的作用情况
别Na2CO3和NaHCO3溶液。该方法相比较其他同行、专家的鉴别方法更简洁、方便、易行、更适合课堂教学。
参考文献
[1]李大塘.氯化钡不能鉴别碳酸钠和碳酸氢钠的理论分析[J].化学教学,2010,(10):76
[2]吴全胜,诸全头.碳酸氢钠与氯化钙真的不反应吗[J].化学教育,2008,(2):65-67
[3]肖中荣,陈进前.让学生理解碳酸氢钠与氯化钙能反应[J].中学化学教学参考,2015,(1-2):46-48
[4]杨飞,马宏佳.用氯化钙或氯化钡鉴别碳酸钠与碳酸氢钠溶液的再认识[J].化学教育,2014,(11):82-84
[5]孙红文.不能用加氯化物来鉴别Na2CO3和NaHCO3[J].化学教学,2003,(4):47-48
[6]武汉大学.分析化学(第三版)[M].北京:高等教育出版社,1995:68
[7]华中师范大学,东北师范大学,陕西师范大学.分析化学(第二版)[M].北京:高等教育出版社,1994:207
doi:10.3969/j.issn.1008-0546.2016.02.010
文章编号:1008-0546(2016)02-0038-01
中图分类号:G633.8
文献标识码:B

