pH依赖型黄芩苷纳米晶体结肠靶向微丸的制备及体外释药研究
程 玲, 郑 娟, 沈 刚, 邱 玲, 李娟娟, 张利红, 武 娜, 韩 晋,袁海龙 *
(1.成都中医药大学药学院,四川成都611137;2.中国人民解放军第302医院,北京100039)
pH依赖型黄芩苷纳米晶体结肠靶向微丸的制备及体外释药研究
程 玲1,2, 郑 娟1,2, 沈 刚1,2, 邱 玲1,2, 李娟娟1,2, 张利红2, 武 娜2, 韩 晋2,袁海龙2 *
(1.成都中医药大学药学院,四川成都611137;2.中国人民解放军第302医院,北京100039)
摘要:目的 制备PH依赖型黄芩苷纳米晶体结肠靶向微丸,并对影响其体外释药行为的包衣处方进行优化。方法采用探头超声联合高压均质技术制备黄芩苷纳米混悬剂,用流化床干燥法固化成纳米晶体微丸,并考察其再分散后的粒径、Zeta电位和多分散指数。然后,将上述纳米晶体微丸进行流化床包衣,以微丸体外释放度为评价指标,对包衣处方进行优化。结果 黄芩苷纳米晶体微丸再分散后,平均粒径为(281.90±10.56)nm,多分散指数(PI)为(0.195 1±0.043 2),Zeta电位为(-31.7±2.1)mV。最优包衣处方为以EudragitS100为包衣材料,8%的柠檬酸三乙酯(TEC)为增塑剂,50%的滑石粉为抗黏剂,包衣增重量为15%。所制得的黄芩苷纳米晶体结肠靶向微丸在人工胃液2 h、小肠液4 h中的累积释药率小于13%,而在人工结肠液4 h中达93%。结论 该制剂具有良好的结肠靶向释药性能。
关键词:黄芩苷;纳米晶体;PH依赖;结肠靶向;体外释放
dol:10.3969/j.issn.1001-1528.2016.02.014
KEY W 0RDS: baica1in;nanocrysta1;PH-dePendent;co1on targeting;re1ease in vitro
黄芩苷(baica1in)是唇形科植物黄芩的主要药效成分,具有解热、降压、抗菌、保肝、抗肿瘤等作用[1]。现代研究证实,黄芩苷对实验性结肠炎小鼠具有一定的保护作用[2-3],其通过介导雷帕霉素靶蛋白(target of raPamycin,mTOR)信号通路的转导来抑制人结肠癌细胞增殖[1],但其水溶性差,体内溶出速率较低,限制了药效的发挥。纳米混悬剂为解决中药难溶性成分溶解度差的问题提供了新的途径[4],岳鹏飞[4]、张秋菊[5]等采用不同制备工艺将黄芩苷制成纳米制剂,使药物的溶出显著增强。针对黄芩苷对结肠部位疾病的确凿疗效,本实验试图将其纳米制剂开发为口服结肠靶向制剂。
结肠靶向微丸是一种新型的口服给药形式,因微丸表面修饰的差异,可实现时滞型、酶触型、PH依赖型等释药特性,能有效地将药物送至结肠病变部位,提高病灶部位药物浓度,降低不良反应[6-7]。而且,微丸作为多剂量分散型给药制剂,可避免片剂、胶囊剂受胃空速率的影响,即使个别微丸破损,也不会造成整个释药行为的改变,又因其体积小,与黏膜接触面积大,可延长在结肠的滞留时间[7],作为制剂中间体,能根据需要进一步制成其他剂型,应用范围广阔。
本实验拟采用探头超声-高压均质技术制备黄芩苷纳米混悬剂,借用流化床技术,将其干燥固化为纳米晶体微丸,表面再包以PH敏感型材料,以期实现结肠靶向和快速释药的目的,为黄芩苷结肠靶向制剂的研究提供参考。
1 材料与仪器
JHBE-20A探头超声仪(河南金鼐科技发展有限公司);GYB40 -10S高压均质机(上海华东高压均质机厂);NanoZS90粒径分析仪(英国Ma1vern公司);RC-3溶出度测试仪(天津市新天光技术平台开发有限公司);LC-20A岛津液相色谱仪(日本岛津公司);流化床(MINI型,德国G1att公司)。
黄芩苷原料药(批号110608,纯度95%,陕西永健制药有限公司);黄芩苷对照品(批号110715 -201016,中国食品药品检定研究院);Eudragit S100(批号B060303014,德国Deggusa公司);药用微丸丸芯(蔗糖型,杭州高成生物营养技术有限公司);泊洛沙姆188(Po1oxamer-188)、聚维酮K30(PVP K30)、十二烷基硫酸钠(SDS)、柠檬酸三乙酯(TEC)、滑石粉(北京凤礼精求商贸有限责任公司);甲醇为色谱纯;其他试剂均为分析纯。
2 方法与结果
2.1 黄芩苷纳米晶体微丸的制备[8]分别称取5%黄芩苷原料药、0.25%十二烷基硫酸钠、0.5% Po1oxamer-188,置于适量的蒸馏水中,充分搅拌混匀,8 000 r/min探头超声10 min后,先在50 MPa条件下高压乳匀10圈,再在100 MPa下继续乳匀20圈,得到平均粒径为(265.13±7.12)nm的黄芩苷纳米混悬剂。将5%PVP K30黏合剂分别加到黄芩苷纳米混悬剂和由上述处方组成的黄芩苷物理混合液中,取蔗糖空白丸芯适量,按进风温度50℃,物料温度33℃,进液体积流量1.0 mL/min,流化压力0.029 MPa,雾化压力0.157 MPa的工艺参数进行流化床上样干燥,上样完毕后,继续干燥30 min,即得大小为(0.9±0.1)mm的黄芩苷纳米晶体微丸和黄芩苷物理混合微丸,两者含有量均为(6.5±0.3)%。
2.2 黄芩苷纳米晶体微丸再分散后的粒径测定[8]取黄芩苷纳米晶体微丸适量,加蒸馏水振摇,直至出现黄色半透明状,并且无可见大颗粒为止,再取适量稀释至合适浓度,测定粒径及Zeta电位。结果显示,黄芩苷纳米晶体微丸再分散后的平均粒径为(281.90±10.56)nm,多分散指数(PI)为(0.195 1±0.043 2),Zeta电位为(-31.7±2.1)mV,表明该纳米晶体微丸的再分散性良好。
2.3 黄芩苷HPLC分析方法建立
2.3.1 色谱条件 色谱柱为Arcus EP-C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.2%磷酸溶液(59∶41);检测波长276 nm;柱温为室温;体积流量1.0 min/mL;进样量10 μL。
2.3.2 专属性 按“2.3.1”项下色谱条件进行测定,3种释放介质中的供试品溶液与黄芩苷对照品在相同保留时间处出现色谱峰。而在相同条件下,仅缺黄芩苷的阴性对照则无色谱峰,表明专属性良好。色谱图见图1。
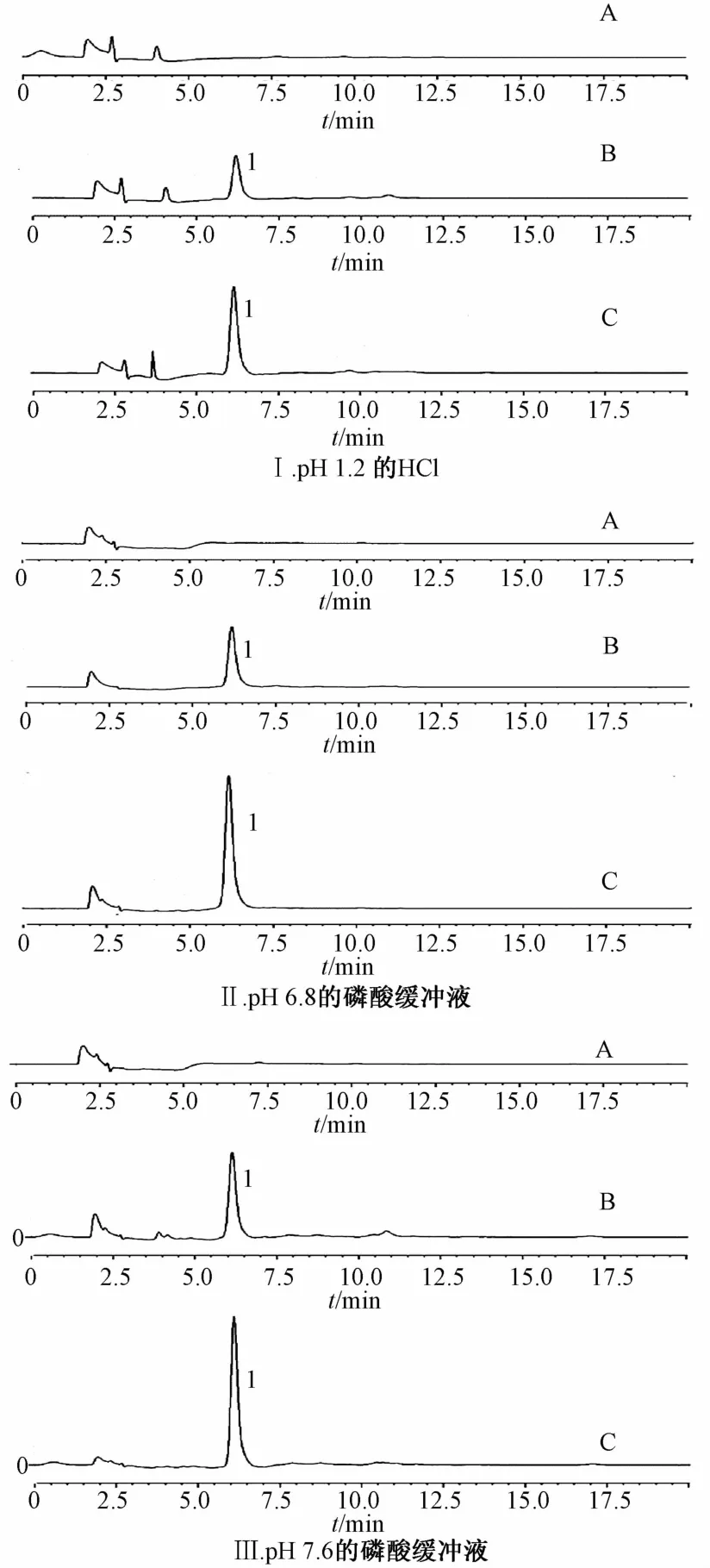
A.阴性样品 B.样品 C.黄芩苷对照品 1.黄芩苷A.negative samP1e B.samP1e C.baica1in reference substance 1.baica1in图1 黄芩苷在p H 1.2的HC l、p H 6.8的磷酸缓冲液、pH 7.6的磷酸缓冲液中的HPLC色谱图Flg.1 HPLC chromatograms of balcalln ln HCl(pH 1.2),PBS(pH 6.8)and PBS(pH 7.6)
2.3.3 线性关系考察 精密称取黄芩苷对照品12.50 mg,置于25 mL量瓶中,加甲醇超声溶解并稀释至刻度,配制成质量浓度为500 μg/mL的黄芩苷贮备液。分别用PH 1.2的稀盐酸按不同比例,稀释成质量浓度为0.5、1、2、4、5、10 μg/mL的系列对照品溶液;PH 6.8的磷酸缓冲液按不同比例,稀释成质量浓度为1、2、5、10、20、40 μg/mL的系列对照品溶液;PH 7.6的磷酸缓冲液按不同比例,稀释成质量浓度为5、10、20、40、50、100 μg/mL的系列对照品溶液。分别取续滤液10 μL,按“2.3.1”项下色谱条件进样分析,以黄芩苷质量浓度(X)对峰面积(Y)进行线性回归,得PH 1.2的HC1溶液回归方程为Y= 34.08X-5.33(r2=0.999 8),PH 6.8的磷酸缓冲液为Y=29.50X+18.40(r2=0.999 6),PH 7.6的磷酸缓冲液为Y=29.32X +36.16(r2= 0.999 7)。结果表明,三者分别在0.5~10、1~40、5~100 μg/mL范围内线性关系良好。
2.3.4 稳定性试验 分别精密吸取3种释放介质中的供试液适量,于0、2、4、8 h取样10 μL,注入高效液相色谱仪,测定黄芩苷的含有量。结果,3种供试液在8 h内,黄芩苷的含有量均没有显著变化,其RSD均在0.95%~2.4%之间,表明8 h内三者的稳定性较好。
2.3.5 方法回收率[6]精密称取黄芩苷对照品3份,分别加入PH 1.2的HC1、PH 6.8及7.6的磷酸缓冲液,分别稀释成高、中、低3种质量浓度(PH 1.2的HC1 10.00、5.00、2.00 μg/mL;PH 6.8的磷酸缓冲液38.00、19.00、9.50 μg/mL;PH 7.6的磷酸缓冲液96.00、48.00、19.20 μg/mL)的供试品溶液,按“2.3.1”项下色谱条件进样,分别记录峰面积,并代入标准曲线方程计算黄芩苷质量浓度,以测定量与加入量之比计算回收率。结果,黄芩苷在上述3种释放介质中,高、中、低3种质量浓度的平均回收率均在96.8%~102.3%之间。
2.4 黄芩苷纳米晶体微丸的包衣[6,9]取Eudragit S100(约占溶液总体积的20%)适量,加95%乙醇浸泡使其充分溶胀,作为A相;在剩余95%乙醇中加入TEC、滑石粉,匀浆机匀化10 min后,充分搅拌,作为B相。将B相缓缓倒入A相中,室温搅拌过夜,过200目筛,滤过,即得。称取载药微丸适量,置于流化床中,开启风机,使载药微丸呈流化状态,调节按钮,按“2.1”项下流化床工艺参数进行包衣,然后取出微丸,加入1%滑石粉,60℃热处理2 h,以使包衣膜融合完整。最终,所得的包衣微丸无花斑、均匀、光滑、不粘连。
2.5 包衣微丸的体外释放度测定[10-11]鉴于微丸属于多分散体系,实验中不易更换释放介质,故参照《中国药典》2010年版二部附录XD中第二法的方法1测定。为模拟微丸在胃肠道中的释药情况,依次进行PH 1.2的稀盐酸(2 h)、PH 6.8的磷酸缓冲液(4 h),PH 7.6的磷酸缓冲液(4 h)的体外释药性能考察。精密称取包衣微丸(约相当于含黄芩苷80 mg)适量,(37±0.5)℃下置于600 mL PH 1.2的稀盐酸溶液中(2 h),然后加入同温的0.2 mo1/L磷酸钠溶液150 mL(用2 mo1/L氢氧化钠溶液调节PH至6.8,4 h),最后加入同温的0.2 mo1/L磷酸钠溶液150 mL(用2 mo1/L氢氧化钠溶液调节PH至7.6,4 h),转速100 r/min。各取样点定时取样2 mL(同时补加同温同体积的释放介质),滤过,取续滤液,按“2.3”项下方法进样分析,计算黄芩苷累积释放率。
2.6 包衣处方对黄芩苷纳米晶体微丸体外释药的影响
2.6.1 增塑剂用量 分别将相当于聚合物量5%、8%、12%的TEC,50%的滑石粉及约占溶液总体积20%的Eudragit S100加入包衣液中,制备包衣微丸,使其增重15%,测定其累积释放率,各组体外释药曲线结果见图2。由图可知,随着增塑剂用量的增加,释药时间延迟,当增塑剂用量为5%时,包衣微丸6 h内的累积释放率达29.25%;当用量8%或12%时,6 h内分别为11.94%和8.90%,而10 h内分别为92.93%和90.29%。但当TEC用量为12%时,枪头易堵塞,微丸易互相黏结,包衣效率低;当用量为8%时,释药过程符合结肠靶向要求,而且包衣效果较好,故选择增塑剂用量为8%。
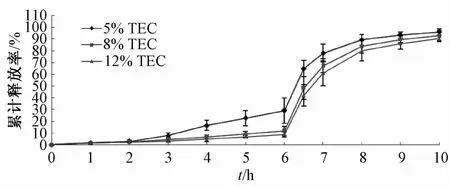
图2 不同用量TEC包衣微丸的释药曲线(n=5)Flg.2 Release curves of coated pellets w lth d lfferent amounts of TEC consumptlon(n=5)
2.6.2 抗黏剂用量 分别将相当于聚合物量20%、50%、100%的滑石粉,8%的TEC及约占溶液总体积20%的EudragitS100加入包衣液中,制备包衣微丸,使其增重15%,测定其累积释放率,各组体外释药曲线结果见图3。由图可知,不同用量滑石粉所得包衣微丸的释药曲线基本一致,但在包衣过程中发现,当滑石粉用量为20%时,微丸易黏连,衣膜表面不均匀,影响药物释放;当用量为100%时,枪头易堵塞;用量为50%时,衣膜表面光滑圆整,释药平稳,故最终选择滑石粉用量为50%。
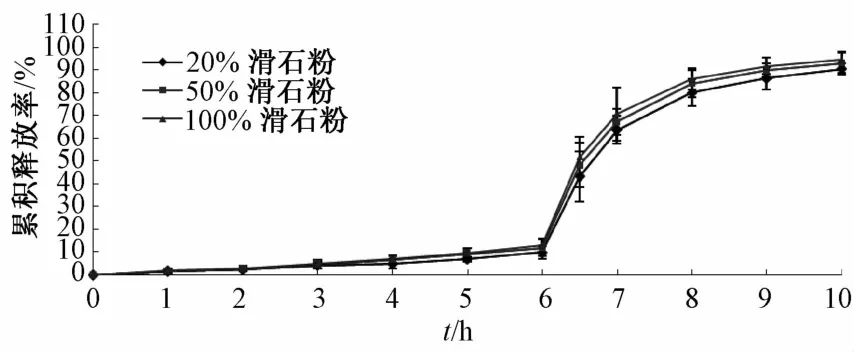
图3 不同用量滑石粉包衣微丸的释药曲线(n=5)Flg.3 Release curves of coated pellets w lth dlfferent amounts of talcum consum ptlon(n=5)
2.6.3 包衣增重 以约占溶液总体积20%的Eudragit S100为包衣材料,分别加入相当于聚合物量8%的TEC及50%的滑石粉,制备包衣增重分别为10%、15%、20%的包衣微丸,测定累积释放率,绘制释药曲线,结果见图4。由图可知,当微丸包衣增重为10%时,药物在2、6 h内的累积释放较多,表明连续完整,且具有一定机械强度的衣膜尚未形成。随着包衣增重的增加,包衣微丸释药逐渐减慢,这是因为衣膜厚度增加,其抗张强度增加,介质向衣膜内的渗透速率降低,当包衣增重为15%时,微丸2、6 h内的累积释放率分别为2.42%、11.94%,而10 h为92.93%,整个释药过程符合结肠靶向要求。因此,选择PH依赖层包衣增重为15%。
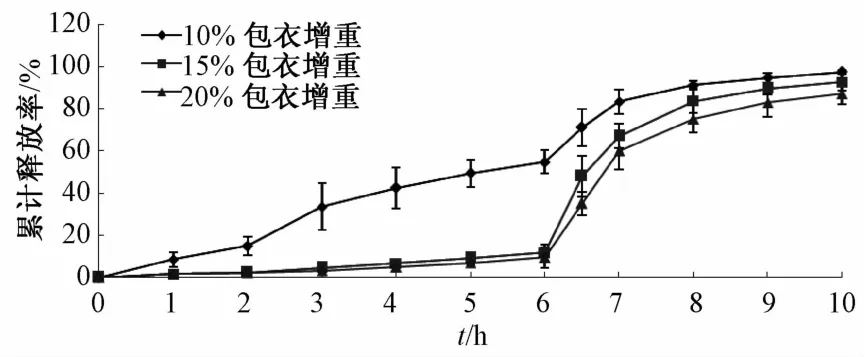
图4 不同包衣增重包衣微丸的释药曲线(n=5)Flg.4 Release curves of coated pellets w lth d lfferent welght galns ln coatlng levels(n=5)
2.7 包衣微丸重复性试验 以最佳包衣处方制备3批PH依赖型黄芩苷纳米晶体微丸,按“2.5”项下方法测定其累积释放率,结果见图5。由图可知,3批微丸在模拟人工胃液PH环境下2 h的累计释放率分别为2.42%、2.43%、2.39%;在模拟人工小肠液PH环境下4 h时,分别为11.94%、12.01%、11.97%;在模拟人工结肠液PH环境下30 min时,分别为48.21%、48.17%、48.25%,而4 h时分别为92.93%、92.87%、92.99%,表明3批微丸靶向释药性能良好,工艺稳定。
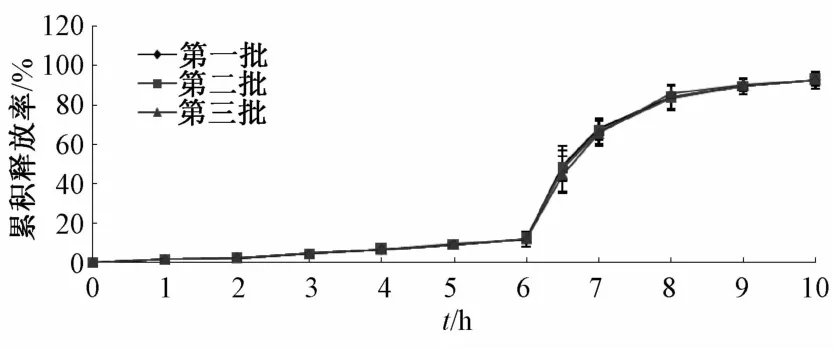
图5 3批结肠靶向微丸的释药曲线(n=5)Flg.5 Release curves of three batches of colon targetlng coated pellets(n=5)
2.8 包衣微丸体外释放度比较 按“2.5”项下方法,对最优包衣处方制备的黄芩苷纳米晶体微丸和物理混合微丸进行体外释放度测定,结果见图6。由图可知,在PH 1.2的稀盐酸溶液和PH 6.8的磷酸缓冲液中,两者累积释放度均小于13%,并且无显著性差异;在PH 7.6的磷酸缓冲液中,各取样点黄芩苷纳米晶体包衣微丸的累积释放率均明显高于物理混合包衣微丸,10 h内纳米晶体包衣微丸的累积释放率高达93%,具有良好的结肠靶向释药特性。
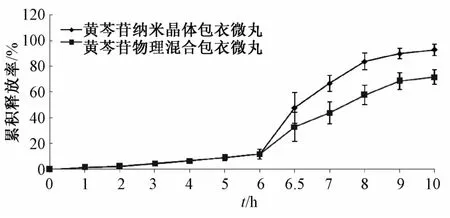
图6 黄芩苷纳米晶体包衣微丸和物理混合包衣微丸的释药曲线(n=5)Flg.6 Release curves of pH-dependent colon targetlng pellets of balcalln nanocrystal and physlcalm lxture of balcalln(n=5)
2.9 纳米晶体包衣微丸的再分散性测定 精密称取黄芩苷纳米晶体包衣微丸(约相当于含黄芩苷10 mg)适量,置于200 mL PH 7.6的磷酸缓冲液中,充分振摇,直至出现黄色半透明状,而且无可见大颗粒为止,取适量稀释至合适浓度,测定粒径及Zeta电位。结果显示,包衣微丸再分散后的平均粒径为(317.93±17.43)nm,多分散指数(PI)为(0.201 1±0.037 1),Zeta电位为(-30.9±1.3)mV,表明该包衣微丸再分散性良好。
3 讨论
黄芩苷为难溶性药物,直接制成微丸药物溶出困难。本实验将其制备成纳米混悬剂,借用流化床干燥技术,制备载药微丸,初步解决了纳米混悬剂长期放置不稳定的问题。另外,选用流化床进行上样、包衣,可充分利用其集干燥及包衣于一体、一次成型的优良特性,大大地提高了生产效率。
然后,体外对载药微丸和包衣微丸再分散特性分别进行了评价,发现再分散后,两者粒径稍有增大,但无显著性差异,表明其再分散性良好。体外释放度结果表明,纳米晶体载药微丸的释药能力显著优于物理混合载药微丸,查阅文献[12],分析可能的原因有:(1)药物制备成纳米混悬剂后粒径减小,表面积增大,渗透性增强,药物的饱和溶解度和溶出率增大;(2)药物制备成纳米混悬剂后,晶型部分或全部发生改变,使无定型态晶型的比例增加,药物溶解度提高。另外,本实验未开展SEM和XRD的测定,故释药性能的增加基本以前者作解释,后期将进一步完善其体外表征的研究。
Eudragit S100和FS 30D都是在PH>7的条件下溶解,是常用的PH依赖型结肠包衣材料。其中,后者成膜后的膜柔韧性较强,包衣时微丸易黏结,但衣膜的完整性较差,药物易提前泄露,加之易堵塞喷头,影响包衣效率,故最终选用前者作为包衣材料[11]。单用Eudragit S100时,包衣膜玻璃化转变温度(Tg)较高,脆性较大,故包衣时通常加入增塑剂以提高改善衣膜的柔韧性和机械性能[13],常用的增塑剂有三乙醇甘油酯、邻苯二甲酸二乙酯、聚乙二醇6000和TEC。文献[13-14]报道,TEC与Eudragit S100的相容性较好,加入TEC膜的Tg最小,膜的透湿性影响也最低,而且其机械性能和成膜性均较好,故最终选用TEC作为增塑剂。同时,为进一步减少包衣微丸的黏结,通常加入抗黏剂滑石粉。
文献[15]报道,一个良好的结肠靶向制剂应在服药后约5 h内释放,并在10 h内释放完全,使药物能分布到升结肠和横结肠。本实验制备的微丸在模拟胃肠道PH的介质中5 h后,开始缓慢释药,10 h内释药量基本达到93%,大致符合结肠靶向制剂特性,可为黄芩苷口服结肠靶向制剂的研究提供参考,但该制剂的体内靶向性和治疗结肠炎的机理有待作进一步考察。
参考文献:
[1] 吴登艳,宋 娇,董海良,等.mTOR信号通路介导黄芩苷抑制人结肠癌细胞的增殖[J].第三军医大学学报,2012,34(23): 2399-2402.
[2] 刘 萍,程 虹,吴东方.黄芩苷对小鼠实验性结肠炎的保护作用[J].中国医院药学杂志,2010,30(19): 1623-1625.
[3] 邹 颖,迟宏罡,欧阳霖芮,等.黄芩苷对实验性结肠炎小鼠TLRs/MyD88通路的作用研究[J].天然产物研究与开发,2014,26(6): 952-956.
[4] Yue P F,Li Y,Wan J,etal.Process oPtimization and eva1uation of nove1baica1in so1id nanocrysta1s[J].Int JNanomedine,2013,8: 2961-2973.
[5] 张秋菊,洪彤彤,魏世杰,等.黄芩苷纳米结晶的制备工艺[J].中国实验方剂学杂志,2014,20(2): 14-18.
[6] 叶晓莉,王选深,王彬辉,等.PH依赖-时滞型大黄素结肠定位微丸的制备及体外释药研究[J].中草药,2011,42 (10): 1956-1962.
[7] 张玉霞,贾运涛,田 睿,等.新型载姜黄素结肠定位胶囊的制备及其体外释药行为研究[J].中草药,2014,45(1): 42-45.
[8] 靳世英,袁海龙,靳士晓,等.黄芩苷纳米晶体微丸的制备及其药代动力学初步研究[J].中国中药杂志,2013,38 (8): 1156-1159.
[9] 谢兴亮,杨 明,韩 丽,等.PH敏感型苦参结肠靶向微丸的处方筛选及其释药性能评价[J].中国实验方剂学杂志,2011,17(4): 1-4.
[10] 国家药典委员会.中华人民共和国药典: 2010年版二部[S].北京:中国医药科技出版社,2010:附录XD 87-88.
[11] 陈振华,管咏梅,朱卫丰,等.白头翁总皂苷-羟丙基-环糊精包合物结肠靶向微丸的制备[J].中国中药杂志,2013,38(24): 4292-4297.
[12] 郭静静,李仙义,袁海龙,等.波棱甲素纳米混悬剂胶囊的制备及体外溶出度测定[J].中草药,2012,43(3): 467-470.
[13] 张国松,封传华,江 魏,等.增塑剂及膜材比例对游离膜机械性能和透湿性的影响[J].药学学报,2011,46(9): 1144-1149.
[14] 王英婷,韩 勇,王宏丽.PH敏感结肠宁靶向微丸的制备及体外释药性能评价[J].中国药业,2014,23(7): 36-37.
[15] Basit A W.Advances in co1onic drug de1ivery[J].Drugs,2005,65(14): 1991-2007.
Preparatlon and in vitro release evaluatlon of pH-dependent colon targetlng pellets of balcalln nanocrystal
CHENG Ling1,2, ZHENG Juan1,2, SHEN Gang1,2, QIU Ling1,2, LI Juan-juan1,2, ZHANG Lihong2, WU Na2, HAN Jin2, YUAN Hai-1ong2*
(1.College of Pharmacy,Chengdu University of Traditional Chinese Medicine,Chengdu 611137,China;2.302 Military HosPital of China,Beijing 100039,China)
ABSTRACT:AIM To PrePare PH-dePendent co1on targeting Pe11ets of baica1in nanocrysta1(BC-NC)and inves-book=299,ebook=77tigate the PrescriPtion factor of coated Pe11ets' re1ease behaviors in vitro.METH0DS The high Pressure homogenization combined with u1trasonic techno1ogywere emP1oyed to PrePare baica1in nanosusPensions to be so1idified into targeting Pe11ets by f1uid-bed drying.The redisPersib1e ProPerties of Pe11etswere investigated in terms of Partic1e diameter,Zeta Potentia1,and Po1ydisPersity index(PI).Then these Pe11ets were coated by G1att f1uid-bed,whose re1ease behaviors in vitro were taken into consideration for the PrescriPtion oPtimization.RESULTS The PrePared Pe11ets demonstrated fine redisPersib1e ProPertieswith the average Partic1e diameter of(281.90±10.56)nm,PI of(0.195 1±0.043 2),Zeta-Potentia1of(-31.7±2.1)mV.The oPtima1 formu1a for the coated Pe11ets was determined to be Eudragit S100 as the coatingmateria1,8% TEC as the P1asticizer,and 50% ta1cum Powder as the anti-adherent.Both of the accumu1ated drug re1eases of these Pe11ets in artificia1gastric juice for 2 h and artificia1 intestina1 juice for 4 h were 1ess than 13%,whi1e that in artificia1co1on juice for 4 h wasmore than 90%.C0NCLUSI0N The PH-dePendent co1on targeting Pe11ets of baica1in nanocrysta1exhibit a good co1on-targeted drug re1ease in vitro.
*通信作者:袁海龙,男,博士,博士生导师,研究方向为中药新型给药系统。Te1:(010)66933367,E-mai1: yh1Pharm@126.com
作者简介:程 玲(1989—),女,硕士,研究方向为中药新制剂、新剂型、新技术。E-mai1: 1073662674@qq.com
基金项目:国家新药创制重大专项(2012ZX09J12108-04C);北京市科委重点项目(Z141100002214007)
收稿日期:2015-05-28
中图分类号:R944
文献标志码:A
文章编号:1001-1528(2016)02-0298-06

