慢性高原病患者骨髓CD71+、CD235a+有核红细胞增殖及凋亡变化
冯婷婷,冀林华,刘芳,韩园芳,任荣,胡一博,李建平,熊华,尹启超,崔森
(青海大学附属医院,西宁810001)
慢性高原病患者骨髓CD71+、CD235a+有核红细胞增殖及凋亡变化
冯婷婷,冀林华,刘芳,韩园芳,任荣,胡一博,李建平,熊华,尹启超,崔森
(青海大学附属医院,西宁810001)
目的 观察慢性高原病(CMS)患者骨髓CD71+、CD235a+有核红细胞增殖、凋亡变化。方法 提取16例CMS患者(CMS组)及16例单纯陈旧性骨折患者(对照组)骨髓单个核细胞(BMMNCs),用免疫磁珠法分选CD71+、CD235a+有核红细胞。用CCK-8法检测骨髓CD71+、CD235a+有核红细胞增殖能力,Annexin V-FITC/PI双标记流式细胞术测算细胞凋亡率,集落形成实验测算骨髓CD71+、CD235a+有核红细胞及BMMNCs克隆形成率。结果 与对照组比较,CMS组骨髓CD71+、CD235a+有核红细胞增殖能力升高,凋亡率降低(P均<0.05)。培养第7、14天,两组骨髓CD71+、CD235a+有核红细胞克隆形成率比较,P均>0.05;两组BMMNCs克隆形成率比较,P均<0.05。结论 CMS患者骨髓CD71+、CD235a+有核红细胞增殖增加、凋亡减少。
高原病,慢性;CD71+有核红细胞;CD235a+有核红细胞;细胞增殖;细胞凋亡
慢性高原病(CMS)是高原常见疾病。在海拔2 500 m以上地区,机体进行自我调节以适应高原环境。但CMS是机体对高原低氧环境代偿功能失调而引起红细胞的过度积累,进而导致整个机体损害。目前有关CMS患者红细胞增殖与凋亡失衡的报道较少。2014年3月~2015年10月,本研究对16例CMS患者骨髓CD71+、CD235a+有核红细胞的增殖与凋亡情况进行检测,以进一步了解红细胞过度积累的机制。
1 资料与方法
1.1 临床资料 本院收治的CMS患者16例(CMS组),符合第六届国际高原医学和低氧生理学术大会的CMS诊断标准[1]。均为汉族男性,年龄(46.43±7.1)岁;血红蛋白(Hb)(224.87±10.6)g/L,动脉血氧饱和度(SaO2)(82.28±9.8)%,血细胞比容(Hct)(66.94±3.8)%。单纯陈旧性骨折患者16例作为对照组,均为汉族男性,年龄(43.61±6.1)岁;Hb(145.50±10.1)g/L,SaO2(97.26±8.7)%,Hct为(44.51±3.1)%;血象及骨髓象均正常,与健康人骨髓涂片无差别。两组居住海拔均为2 500~4 000 m;均排除感染、恶性肿瘤及其他系统系疾病。两组年龄比较差异无统计学意义。研究获得青海大学附属医院伦理委员会同意。患者知情同意。
1.2 骨髓CD71+、CD235a+有核红细胞分选 CMS组与对照组均于髂后上棘处采集骨髓液10 mL,肝素抗凝。采用密度梯度离心法提取骨髓单个核细胞(BMMNCs),将分离好的BMMNCs制成单细胞悬液,台盼蓝染色后进行细胞计数;根据细胞计数加入CD71抗体10~20 μL,4 ℃孵育15 min后进行磁珠分选,取CD71+细胞,剩余CD71-细胞。磁珠buffer重悬CD71-细胞进行细胞计数,根据计数加入CD235a抗体,4 ℃孵育15 min后进行磁珠分选,取CD235a+细胞,将分选后的CD71+、CD235a+细胞混匀后进行细胞计数。磁珠分选后以流式细胞术进行细胞纯度分析,单次分选后纯度均在85%以上。
1.3 骨髓CD71+、CD235a+有核红细胞增殖能力检测 采用CCK-8法。取分选好的CD71+、CD235a+有核红细胞按1×104/孔接种于96孔板内,37 ℃、5% CO2、3% O2、饱和湿度三气培养箱培养72 h;加CCK-8 10 μL孵育4 h,用酶标仪检测450 nm波长处吸光度值(OD值)作为骨髓CD71+、CD235a+有核红细胞生长情况。实验设3个平行孔,取平均值。
1.4 骨髓CD71+、CD235a+有核红细胞凋亡率测定 采用Annexin V-FITC/PI双标记流式细胞术。取分选好CD71+、CD235a+有核红细胞(1×106),PBS洗涤2次,重悬后移入流式管,加入Annexin V-FITC 5 μL、PI 5 μL避光反应15 min后上机检测,采集10 000个细胞进行分析。Annexin V+PI-细胞为早期凋亡细胞,Annexin V+PI+细胞为晚期凋亡细胞,以二者总和计算细胞凋亡率。
1.5 骨髓CD71+、CD235a+有核红细胞、BMMNCs克隆形成率测算 采用集落形成实验。选取分选好的CD71+、CD235a+有核红细胞接种于含有0.9%甲基纤维素、30% FBS、4 mol/L 2-巯基乙醇及1%双抗的IMDM培养体系中,加入重组人促红细胞生成素(EPO)3 IU、重组人白细胞介素3 20 ng,接种于6孔板,调整细胞为1×104/孔。实验设2个复孔。孔板周围加PBS,保持湿度。于37 ℃、5%CO2、3%O2、饱和湿度三气培养箱中培养,培养第7、14天观察并计算克隆形成率。BMMNCs接种、培养同上,调整细胞为1×105/孔,培养第7天观察红细胞集落生成单位(CFU-E)数量,计算克隆形成率;培养第14天观察CFU-E及红细胞爆裂型集落生成单位(BFU-E)数量,计算克隆形成率。克隆形成率=克隆数/接种细胞数×100%。
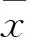
2 结果
2.1 两组骨髓CD71+、CD235a+有核红细胞增殖比较 CMS组、对照组OD值分别为1.037±0.276、0.499±0.158,两组比较,P<0.05。
2.2 两组骨髓CD71+、CD235a+有核红细胞凋亡率比较 CMS组、对照组CD71+、CD235a+有核红细胞凋亡率分别为(5.00±2.76)%、(14.25±11.76)%,两组比较,P<0.05。
2.3 两组骨髓CD71+、CD235a+有核红细胞克隆形成率比较 培养第7天 CMS组、对照组克隆形成率分别为(7.82±4.93)%、(4.88±3.57)%,两组比较,P>0.05。培养第14天,CMS组、对照组克隆形成率分别为(8.93±6.47)%、(6.67±3.50)%,两组比较,P>0.05。
2.4 两组BMMNCs克隆形成率比较 培养第7天,CMS组、对照组BMMNCs克隆形成率分别为(19.02±1.95)%、(15.89±4.34)%,两组比较,P<0.05。培养第14天,CMS组、对照组BMMNCs CFU-E克隆形成率分别为(22.89±3.81)%、(17.89±3.18)%,两组比较,P<0.05;CMS组、对照组BMMNCs BFU-E克隆形成率分别为(2.42±0.70)%、(1.96±0.53)%,两组比较,P<0.05。
3 讨论
CMS是近年研究的热点,对其发病机制的研究取得较大进展。细胞增殖、信号途径、造血调控因子[2]、微血管密度、肾素-血管紧张素系统、其他细胞调控因子[3~6]及细胞凋亡[7]等均对CMS的发病有一定影响。有研究发现,缺氧可能通过提高缺氧诱导因子1α(HIF-1α)及HIF-2α水平促使机体产生EPO和血管内皮生长因子(VEGF),而EPO和VEGF可促进红细胞生成[8]。另有研究表明,CMS的发生亦与基因有关,儿童时期HIF-1α及HIF-2α基因表达高的个体,成年后在高海拔地区易发生CMS[9]。同时CMS患者亦会表现为轻度睡眠呼吸暂停和氧化应激[10],从而加重患者的缺氧状态。CD71在红系前体细胞阶段表达较高,随着红系发育成熟,表达逐渐降低[11];而CD235a表达与CD71的表达相反,随着红系发育成熟其表达逐渐升高[12]。CD71+、CD235a+有核红细胞可作为骨髓有核红细胞群体的代表。本研究结果显示,与对照组比较,CMS组细胞凋亡率降低,CMS组BMMNCs凋亡减少,细胞增殖比例增加,有核红细胞产生累积效应。蔡玉亮等[7]研究表明,CMS的主要发病机制与BMMNCs凋亡减少、增殖增加有关;血红蛋白与BMMNCs增殖并无明显相关性。与本研究结果相符。
CD71+、CD235a+有核红细胞属于造血干细胞所分化出来的有核红细胞,到成熟细胞分裂次数仅为3~5次,不易形成集落,仅形成集簇。进行集簇计数,在第7、14天时两者并无明显差异。采用BMMNCs进行集落培养,第7天时CFU-E、第14天时CFU-E及BFU-E克隆形成率,与对照组相比均明显增高。说明CMS组有核红细胞增殖能力增高。低氧环境可能活化了红细胞信号转导通路[13],由于信号通路的作用而导致有核红细胞生成增加。本研究中细胞培养第7、14天时两组有核红细胞克隆形成率比较无统计学意义,这可能与有核红细胞成熟有关。在观察时部分有核红细胞已经成熟,形成成熟红细胞,无法观察集簇的形成。红细胞生成信号通路是个复杂的通路[14],CMS组在长期缺氧的环境中可能导致数条信号通路增强,进而导致红细胞累积。提示CMS组增殖能力高于对照组。CD71+、CD235a+有核红细胞凋亡减少,亦可能与红细胞信号通路转导增强有关。
因此,CMS发生机制可能与有核红细胞的增殖与凋亡失衡有关,未来可进一步深入研究红细胞信号通路,对红细胞信号通路与CMS的关系进行进一步探究。
[1] León-Velarde F, Maggiorini M, Reeves JT, et al. Consensus statement on chronic and subacute high altitude diseases[J]. High Alt Med Biol, 2005,6(2):147-157.
[2] 颜金花,李占全,冀林华,等.慢性高原病血清血管生成因子的变化[J].中国应用生理学杂志,2009,25(4):457-460.
[3] 冀林华,李占全,崔森,等.JAK2基因V617F点突变在高原红细胞增多症患者中的临床意义研究[J].中华血液学杂志,2012,33(4):319-320.
[4] 苏娟,贾乃镛,李占全,等.高原红细胞增多症患者骨髓单个核细胞磷酸化STAT5和p38-MAPK水平研究[J].中华血液学杂志,2008,29(12):836-837.
[5] 李建平,贾乃镛,李占全,等.高原红细胞增多症患者骨髓单个核细胞GATA-1和GATA-2的表达研究[J].中华血液学杂志,2007,28(8):537-540.
[6] 邹成林,崔森,冀林华,等.慢性高原病骨髓细胞环氧化酶2和热休克蛋白70表达及细胞凋亡研究[J].广东医学,2010,31(11):1409-1412.
[7] 蔡玉亮,崔森,李占全,等.慢性高原病患者骨髓造血细胞凋亡及caspase-8和caspase-9表达研究[J].中华血液学杂志,2011,32(11):762-765.
[8] Souvenir R, Flores JJ, Ostrowski RP, et al. Erythropoietin inhibits HIF-1α expression via upregulation of PHD-2 transcription and translation in an in-vitro model of hypoxia ischemia[J]. Transl Stroke Res, 2014,5(1):118-127.
[9] Huicho L, Xing G, Qualls C, et al. Abnormal energy regulation in early life: childhood gene expression may predict subsequent chronic mountain sickness[J]. BMC Pediatr, 2008,8(1):47.
[10] Julian CG, Vargas E, Gonzales M, et al. Sleep-disordered breathing and oxidative stress in preclinical chronic mountain sickness (excessive erythrocytosis)[J]. Respir Physiol Neurobiol, 2013,186(2):188-196.
[11] Dong HY, Wilkes S, Yang H. CD71 is selectively and ubiquitously expressed at high levels in erythroid precursors of all maturation stages: a comparative immunochemical study with glycophorin A and hemoglobin A[J]. Am J Surg Pathol, 2011,35(5):723-732.
[12] Sadahira Y, Kanzaki A, Wada H, et al. Immunohistochemical identification of erythroid precursors in paraffin embedded bone marrow sections: spectrin is a superior marker to glycophorin[J]. J Clin Pathol, 1999,52(12):919-921.
[13] Ingley E. Integrating novel signaling pathways involved in erythropoiesis[J]. IUBMB Life, 2012,64(5):402-410.
[14] 高赛君,叶铁真.红细胞分化发育过程中的细胞信号转导通路[J].国际输血及血液学杂志,2009,32(2):145-148.
基金项目:广西壮族自治区卫生厅自筹经费科研课题(Z2014146);广西科技攻关计划项目(桂14124004-1-5)。
通信作者:何升(E-mail: 963890708@qq.com)
青海省科技厅国际合作项目(2014-HZ-808)。
冀林华(E-mail:13997244508@163.com)
10.3969/j.issn.1002-266X.2016.37.018
R594.3
B
1002-266X(2016)37-0056-03
2016-02-20)

