多苯并咪唑锌配合物抑制蛋白酪氨酸磷酸酶(PTPs)的活性
陈青 卢丽萍
(山西大学分子科学研究所,化学生物学与分子工程教育部重点实验室,太原030006)
多苯并咪唑锌配合物抑制蛋白酪氨酸磷酸酶(PTPs)的活性
陈青 卢丽萍*
(山西大学分子科学研究所,化学生物学与分子工程教育部重点实验室,太原030006)
本文报道了5种多苯并咪唑锌配合物,即[Zn(TDB)2]Cl2(1)、[Zn(NTB)Cl]Cl(2)、[Zn(EDTB)]Cl2(3)、[Zn2(EGTB)Cl2]Cl2(4)和[Zn2(DTPB)Cl3]Cl(5),其中TDB=1,2-二(2-苯并咪唑)-1,2-二羟基乙烷、NTB=N,N,N-三(2-甲基苯并咪唑)胺、EDTB=N,N,N′,N′-四(2-苯并咪唑亚甲基)-1,2-乙二胺、EGTB=N,N,N′,N′-四(2-苯并咪唑甲基)-1,4-二乙胺基乙二醚以及DTPB=N,N,N′,N″,N″-五(2-苯并咪唑甲基)-二乙三胺,对5种蛋白酪氨酸磷酸酶(PTP1B、TCPTP、PTP-MEG2、SHP-1和SHP-2)的抑制作用,结果显示这些配合物强烈抑制PTP1B的活性,其IC50值在0.15~0.28 μmol·L-1范围内,但对PTP-MEG2和SHP-1抑制较弱,几乎不抑制SHP-2,而配合物1、3、5对与PTP1B高度同源的TCPTP的抑制明显强于2和4,因而2和4对PTP1B表现较强的选择性,对PTP1B抑制活性是TCPTP的7~12倍、PTP-MEG2的10~15倍、SHP-1的20~40倍,大约是SHP-2的1 000倍,表明配合物的结构影响其对PTP1B的选择性。酶促动力学实验显示2和4对高度同源的PTP1B和TCPTP抑制类型不同,对PTP1B的抑制为竞争型,而对TCPTP的抑制为非竞争型,推测其选择性可能与其抑制方式有关。荧光滴定表明2和4与PTP1B和TCPTP发生了1∶1结合作用。结合常数分别为1.12×106、5.47×105、1.19×106和4.95×105L·mol-1,表明它们与PTP1B的结合能力强于TCPTP,与它们对这两种酶的抑制能力一致。
锌配合物;蛋白酪氨酸磷酸酶;抑制;选择性
蛋白酪氨酸磷酸酶(PTPs)是一类广泛存在于生物体内的不含金属的酶,与蛋白酪氨酸激酶(PTKs)共同调控细胞内酪氨酸的磷酸化水平,在生物体内细胞信号转导和调节过程中发挥着重要作用。研究表明酪氨酸磷酸化水平的异常与糖尿病、肥胖、癌症和免疫性缺陷等多种人类疾病的发生和发展密切相关[1-5],其中有些PTPs,如PTP1B通过使胰岛素受体去磷酸化,负向调节胰岛素信号传导,已经成为当前公认的抗糖尿病药物研究的作用靶点,寻找和开发针对PTP1B的高效特异性抑制剂成为近年来该领域研究的热点[2]。
锌是生物体内仅次于铁、含量第二丰富的微量金属元素,具有胰岛素样活性,其作为潜在的抗糖尿病药物引起了生物无机化学研究者的广泛兴趣[6-7]。最近的研究显示锌离子具有抑制PTP1B、TCPTP、SHP-1和SHP-2的作用[8-9],但至今未见锌配合物抑制PTPs活性的研究报道。我们对钒、铜配合物抑制PTPs的研究结果表明,配合物的结构能影响其对PTPs的抑制效果和选择性[10-27]。锌配合物能否选择性抑制PTPs,进而探索锌配合物抗糖尿病药物?为此,本文报道了5种不同结构的多苯并咪唑锌配合物对5种PTPs的抑制作用,发现2种配合物对PTP1B表现较好的选择性。
1 实验部分
1.1 试剂和仪器
对硝基苯磷酸二钠盐(p-NPP)购自上海西宝生物有限公司;MOPS[3-(N-morpholino)propanesulfonic acid]购自北京华美生物有限公司;所用其它试剂均为国内市售分析纯,购回直接使用。红外测定使用Shimadiu-FTIR-8300型傅立叶变换红外仪(KBr压片),4 000~400 cm-1范围测谱;元素分析使用Vario Micro型微量元素分析仪;电喷雾质谱分析使用Quattro Micro API型电喷雾质谱仪;紫外光谱用Hewlett-Packard 8453 UV-Vis型吸收光谱仪记录;酶活性测试使用BIO-RAD550 USA型酶标仪,pH测试使用PHS-3TC型pH计(装配有复合玻璃电极)。
1.2 实验材料
PTP1B、TCPTP、PTP-MEG2、SHP-1和SHP-2的表达与纯化按文献[23]进行。5种酶的重组表达质粒菌株由吉林大学生命科学院Edmond H.Fischer信号传导实验室付学奇教授提供。具体表达和纯化步骤大同小异,以PTP1B为例说明如下:挑取单个克隆菌接种于5 mL Luria-Bertani(LB)液体培养基中(含100 μmol·L-1Amp,34 μmol·L-1Cam,下同),置于37℃振荡培养过夜。扩大培养于1 000 mL LB液体培养基中至OD550=0.6,加入IPTG(Isopropyl β-D-thiogalactopyranoside),使其终浓度为100 μmol·L-1,在37℃培养6 h后离心收集菌体。取10 g菌体用PBS洗涤,加100 mL提取缓冲液[25 mmol·L-1Tris-HCl,10 mmol·L-1EDTA,10 mmol·L-12-mercaptoethanol(2-ME),0.002%phenylmethanesulfonyl fluoride(PMSF)],超声波破碎,13 000 r·min-1离心45 min,收集上清液。将其上样于用Buffer Q(25 mmol· L-1Tris-HCl,pH 7.5,2 mmol·L-12-ME,1 mmol·L-1EDTA)平衡过的FFQ柱,用含0.1 mmol·L-1NaCl的Buffer Q洗涤,除去杂蛋白,然后用含0.2 mol·L-1NaCl的Buffer Q洗脱,得到活性组分。再用Buffer Q平衡S-100层析柱,将洗脱得到的活性组分除盐、浓缩后,经S-100柱,收集活性峰部分,浓缩,用MOPS buffer(20 mmol·L-1MOPS,500 mmol·L-1NaCl,pH 7.2)透析,Bradford法以牛血清白蛋白为标准测定蛋白浓度。
1.3 锌配合物的合成与表征
5种配体1,2-二(2-苯并咪唑)-1,2-二羟基乙烷(TDB),N,N,N-三(2-甲基苯并咪唑)胺(NTB),N,N,N′,N′-四(2-苯并咪唑亚甲基)-1,2-乙二胺(EDTB),N,N,N′,N′-四(2-苯并咪唑甲基)-1,4-二乙胺基乙二醚(EGTB)以及N,N,N′,N″,N″-五(2-苯并咪唑甲基)-二乙三胺(DTPB)的合成和表征见文献[23]。锌配合物1~5的合成参考相应的铜配合物的合成方法[23]。具体步骤如下:按适量的物质的量配比将氯化锌溶液逐滴加入到热的TDB、NTB、EDTB、EGTB和DTPB甲醇溶液中,搅拌数小时得到白色沉淀,静置、抽滤、洗涤、干燥后得到相应的锌配合物粉末,表征如下:
1.3.1 [Zn(TDB)2]Cl2(1)
配合物1,产率:45%。元素分析(C32H28Cl2N8O4Zn,1,%):理论值C 53.02,H 3.89,N 15.46;实验值C 53.29,H 3.87,N 15.38。IR(KBr,cm-1):3 420s(O-H,NH),1 627m(C=N),1 542w,1 456s(苯环C=C),1 323 w,1 275m(C-N),1 107s(O-H),734m,618m,569m。ESIMS(VCH3OH/VH2O=9∶1,正离子模式,下同):峰295.50 (100%)为[TDB+H]+(295.12),峰651.42(24%)为[1-2Cl-H]+(651.14),峰326.50(23%)为[1-2Cl]2+(326.08)。
1.3.2 [Zn(NTB)Cl]Cl(2)
配合物2,产率:54%。元素分析(C24H21Cl2N7Zn· H2O,2·H2O,%):理论值C 51.31,H 4.13,N 17.45;实验值C 51.43,H 4.30,N 17.26。IR(KBr,cm-1):3 560 br(N-H,C-H),1 611s(C=N),1 541w,1 448s(苯环C= C),1 385w,1 348w,1 278m(C-N),1 138s(C-H),757s,626 w,563m。ESI-MS:峰508.58(100%)为[2-Cl]+(508.31)。
1.3.3 [Zn(EDTB)]Cl2(3)
配合物3,产率:46%。元素分析(C34H32Cl2N10Zn· H2O,3·H2O,%):理论值C 55.56,H 4.66,N 19.06;实验值C 55.34,H 4.53,N 18.82。IR(KBr,cm-1):3 560~3 273s(N-H),1 619m(C=N),1 541w,1 456s(苯环C= C),1 385w,1 323w,1 278w(C-N),1 122s(C-H),726m,626w,571m。ESI-MS:峰322.50(100)%为[3-2Cl]2+(322.10),峰679.17(10%)为[3-Cl]+(679.18),峰643.25 (6%)为[3-2Cl-H]+(642.20)。
1.3.4 [Zn2(EGTB)Cl2]Cl2(4)
配合物4,产率:54%。元素分析(C38H40O2N10Cl4Zn2,4,%):理论值C 48.48,H 4.28,N 14.88;实验值C 48.21,H4.41,N14.55。IR(KBr,cm-1):3490br,s,1627m (C=N),1 541w,1 456s(苯环C=C),1 386w,1 339w,1 270 m,1 115s,750s,626w,567m。ESI-MS:峰869.17(100%)为[4-2Cl-H]+(869.45),峰435.33(36%)为[4-2Cl]2+(435.23),峰417.33(22%)为[4-3Cl-H]2+(417.01)。
1.3.5 [Zn2(DTPB)Cl3]Cl(5)
配合物5,产率:42%,元素分析(C44H43N13Cl4Zn2·H2O,5·H2O,%):理论值C 50.60,H 4.34,N 17.43;实验值C 50.49,H 4.46,N 17.38。IR(KBr,cm-1):3 531 (N-H),3 055br,1 623m(C=N),1 602w,1 455m(苯环C =C),1 387w,1 272w(C-N),1 121s(C-H),853w,746m,617m,567m。ESI-MS:峰460.00(100%)为[5-3Cl-H]2+(459.55),峰949.83(27%)为[5-2Cl-H]+(950.16),峰918.33(14%)为[5-3Cl-2H]+(918.10)。
1.4 电位滴定分析
为了确定配合物在水溶液中的物种,以配合物2为代表进行了pH电位滴定分析。由于NTB及它的锌配合物在水溶液中的溶解性不好,pH电位滴定分析在25%甲醇的水溶液中氮气保护下进行,pH测量使用PHS-3TC型pH计带复合玻璃电极。滴定条件为:室温,离子强度为0.2 mol·L-1NaCl,初始体积40 mL 25%甲醇的水溶液,NTB的浓度为0.025 mmol·L-1,ZnCl2浓度为0.025 mmol·L-1,HCl浓度为0.175 mmol·L-1,用除二氧化碳的0.009 08 mol·L-1氢氧化钠滴定。平行滴定3次,记录滴定结果。对实验数据用SUPERQUAD2000软件拟合[28],分别得到配体的质子离解常数pKa及锌配合物的逐级稳定常数。
1.5 锌配合物对蛋白酪氨酸磷酸酶的抑制作用
酶活性抑制实验基于底物对硝基苯磷酸二钠盐(p-NPP)被磷酸酶水解的产物对硝基苯酚(p-NP)在405 nm处有强吸收峰[11,18],其摩尔吸光系数为1.78×104L·mol-1·cm-1。配合物对PTP1B、TCPTP、PTP-MEG2、SHP-1和SHP-2的抑制作用在pH 7.20缓冲液(20 mmol·L-1MOPS,50 mmol·L-1NaCl)体系中进行;即将不同浓度的配合物10 μL加入82 μL的酶溶液中,37℃反应30 min,加入2 μL 100 mmol·L-1p-NPP启动酶反应,20 min后用6 μL 2 mol·L-1NaOH终止反应。根据反应体系对p-NPP水解产生p-NP在405 nm处的光吸收变化计算半数抑制浓度IC50值,半数抑制浓度IC50的计算见文献[10,24]。
酶促动力学实验研究配合物对PTPs的抑制类型和抑制常数。固定酶浓度,分别选取不同浓度的抑制剂和底物,测定不同抑制剂浓度下,随着底物浓度的增加初始反应速率的变化值,根据Lineveaver-Bruk方程分析配合物的抑制类型,并计算抑制常数Ki值[20,23]。
荧光光谱滴定实验在pH 7.20的MOPS缓冲溶液中进行。取2 mL一定浓度的PTP1B或TCPTP溶液加入到1 cm的石英比色皿中,控制温度为37℃。设定激发和发射狭缝均为10 nm,以280 nm为激发波长,扫描PTP1B或TCPTP的发射峰。待酶溶液的荧光强度稳定后,用一定浓度的配合物滴定酶溶液。每次滴加4 μL,吸打均匀,静置5 min扫描。依次进行,直到荧光强度不再发生变化。根据荧光猝灭方程计算配合物与PTP1B或TCPTP的相互作用位点和结合常数[24]。
2 结果与讨论
2.1 配合物的合成与表征
本文所用配合物按文献类似方法合成。红外光谱显示配体TDB、NTB、EDTB、EGTB和DTPB的C= N键伸缩振动位于1 642~1 619 cm-1,而在配合物中吸收峰为1 627~1 604 cm-1,发生了一定的位移,说明苯并咪唑上的N与锌离子发生了配位作用。位于563~571 cm-1的吸收峰可归属于Zn-N的伸缩振动。尽管多种方法尝试了5个配合物的结晶试验,但均未获得适合X射线衍射的单晶样品。根据元素分析得到它们的组成分别是[Zn(TDB)2]Cl2(1)、[Zn(NTB)Cl]Cl(2)、[Zn(EDTB)]Cl2(3)、[Zn2(EGTB)Cl2] Cl2(4)、[Zn2(DTPB)Cl3]Cl(5)。结合类似锌或铜与同类配体的晶体结构文献[28-33],推测锌的可能配位环境见图1,锌离子处于五或六配位环境中。
2.2 Zn/NTB体系溶液中的物种分布
5种锌配合物对PTPs的抑制作用主要在pH= 7.20条件下进行。由于配合物的水溶性较差,通过电喷雾质谱仪的正离子方式进行配合物样品检测,归属见合成部分。在甲醇和水(9:1,V/V)的溶液中,配合物分子离子峰的实验值与计算值一致,证明锌配合物也存在于溶液中。
为进一步研究配合物在溶液中的形式,本文以Zn/NTB体系为代表进行了pH值电位滴定分析。研究其在不同pH值下的物种分布,实验获得的pH值电位滴定数据用SUPERQUAD 2000[28]软件拟合。25%甲醇水溶液中的离子常数按文献校正值pKM/W=-lg(cH+·cA-)=14.10[34],此处A-代表OH-和
CH3O-。配合物的累积结合常数定义为:
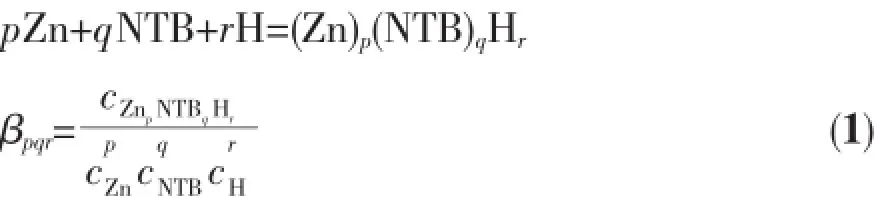

图1 配合物1~5中Zn的可能配位环境Fig.1Coordinated environments of complexes 1~5

图2 (左)Zn/NTB配合体系的滴定曲线;(右)Zn/NTB配合体系的物种分布曲线,NTB浓度为0.025 mmol·L-1Fig.2(Left)Titration and fitted curves of Zn/NTB system;(Right)species distribution as a function of pH value for the Zn/NTB system
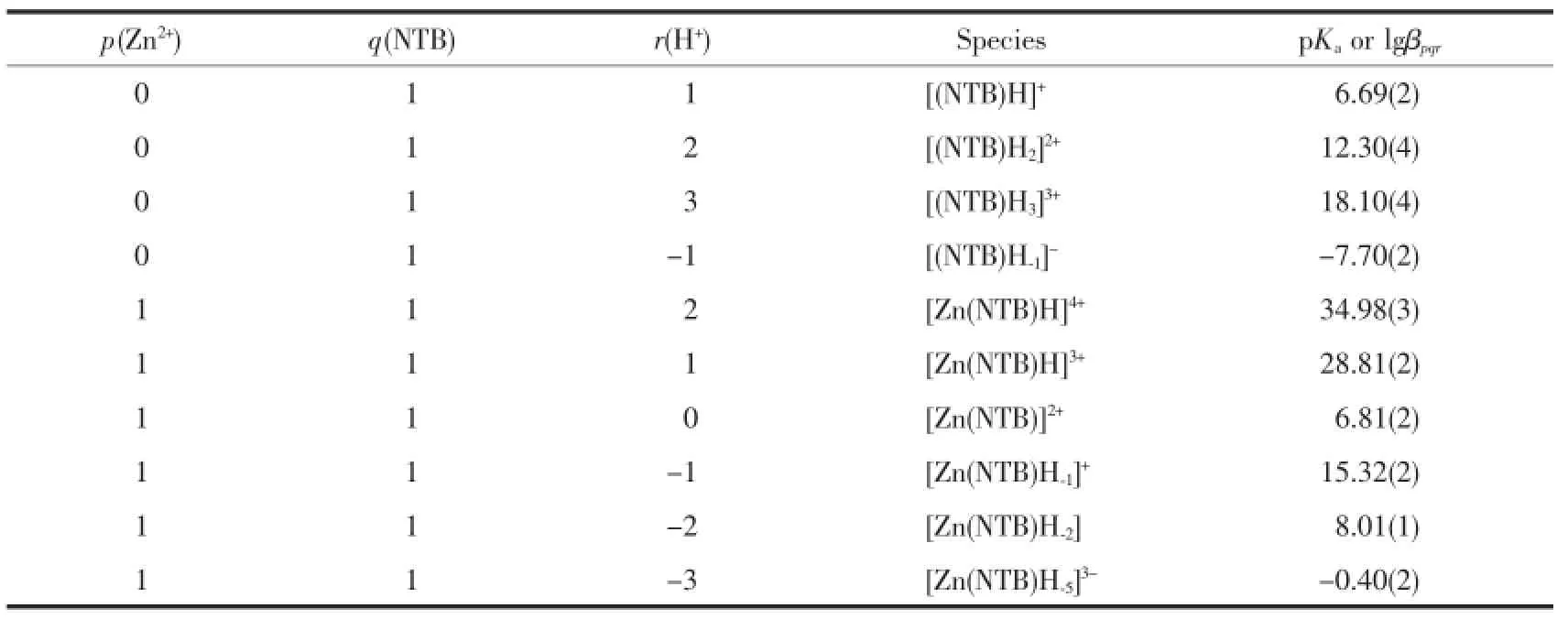
表1 NTB的质子化常数和Zn/NTB配合体系的稳定常数Table 1Stoichiometry,notation,pKaof the ligand NTB and lgβ of Zn/NTB species
其中p,q,r分别代表Zn2+、NTB、H+的化学计量数。拟合结果见图2和表1,实验曲线与拟合曲线能很好的吻合(见图2左图)。物种分布曲线(见图2右图)给出在pH=7.2溶液下,Zn/NTB体系的物种主要以
2.3 配合物对PTPs的抑制作用及选择性
5种多苯并咪唑锌配合物对PTP1B、TCPTP、PTP-MEG2、SHP-1和SHP-2的抑制作用的评估结果见表2和图3。这些结果表明锌配合物对5种PTPs的抑制作用不同。5种锌配合物对PTP1B都表现出强烈的抑制作用,其IC50值在0.15~0.28 μmol· L-1范围内。但对PTP-MEG2、SHP-1和SHP-2抑制作用较弱,特别是对SHP-2几乎不产生抑制作用。值得注意的是配合物1、3、5对与PTP1B高度同源的TCPTP的抑制效果明显强于2和4。锌配合物2和4对PTP1B的抑制表现出较强的选择性,其对PTP1B抑制活性是TCPTP的7~12倍、PTP-MEG2的10~15倍、SHP-1的20~40倍,大约是SHP-2的1 000倍。可见,配合物的结构差异不仅影响它们对不同PTPs的抑制活性也对不同PTPs的抑制具有选择性。但是单核(1和2)与双核配合物(3~5)对五种PTPs的抑制没有表现出明显的区别。其结构与活性的关系,有待进一步研究探讨。金属离子不同也存在差异,与相应配体的铜配合物比较,锌配合物对PTP1B的选择性明显较强[23],或许是锌配合物具有胰岛素样活性[6-7]的原因之一。
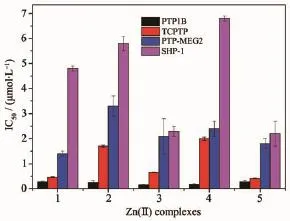
图3 配合物1~5对PTP1B、TCPTP、PTP-MEG2和SHP-1的抑制作用Fig.3Inhibition of zinc(Ⅱ)complexes 1~5 against PTP1B,TCPTP,PTP-MEG2 and SHP-1
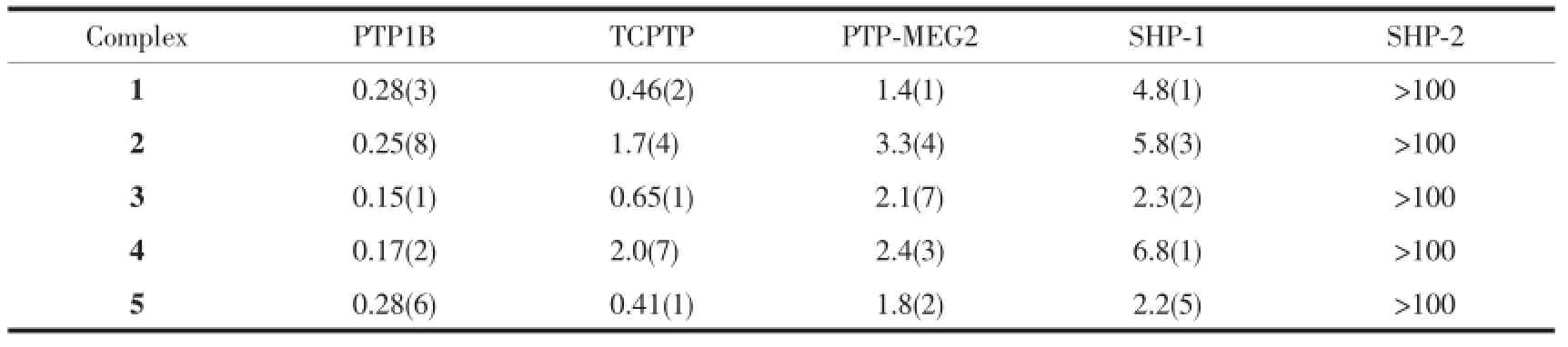
表2 锌配合物对PTPs的抑制作用Table 2PTPs inhibition of zinc(Ⅱ)complexes(IC50(S.D.))
2.4 配合物2和4对PTP1B和TCPTP抑制类型研究
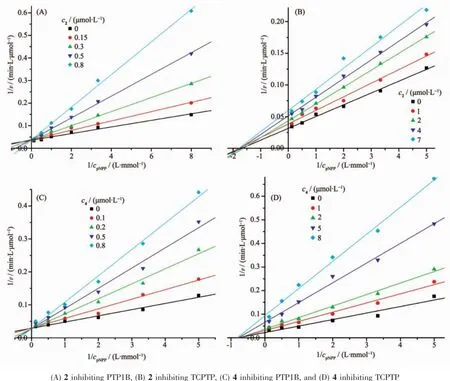
图4 配合物2、4对PTP1B和TCPTP的抑制类型图(5个抑制剂浓度下1/v对1/cpNPP的Lineweaver-Burk作图)Fig.4Inhibition modes of the complexes 2 and 4 on PTP1B&TCPTP,Lineweaver-Burk plot of 1/v versus 1/cpNPPat five fixed concentrations of complexes:
生物学上PTP1B与TCPTP高度同源,但配合物2和4对它们表现出一定的抑制差异。为了探讨这种差异的来源,本文通过酶促动力学实验研究了配合物2和4对PTP1B和TCPTP的抑制类型和抑制常数,结果如图4。不难看出,配合物2和4对PTP1B抑制的L-B(Lineweaver-Burk)方程交于y轴上,属于典型的竞争性抑制。说明配合物2和4与PTP1B的结合在酶的活性部位,求得抑制常数Ki值分别为0.15、0.32 μmol·L-1。而对TCPTP抑制的L-B方程交于x负轴上,属于非竞争性抑制。提示配合物2和4与TCPTP的结合发生在非活性中心部位,导致酶结构发生变化,从而抑制酶的活性,计算得到抑制常数Ki值分别为1.98、2.52 μmol·L-1。由此得出配合物2和4对PTP1B和TCPTP的抑制差异可能源于抑制方式的不同。
2.4 配合物2和4与PTPs的结合作用
为了进一步研究锌配合物与PTP1B、TCPTP作用,以对PTP1B选择性较好的单核配合物2和双核配合物4为例进行了荧光滴定实验,结果如图5。图5A中,随着2的加入,335 nm处的荧光峰迅速减弱,且逐渐位移到340 nm,表明配合物2与PTP1B之间发生了相互作用。以335 nm处的荧光强度值为纵坐标,c2/cPTP1B为横坐标作图。从图5B可看出2与PTP1B的结合比1∶1,即配合物2与PTP1B只有一个结合位点。通过Stern-Volmer方程作图(图5C)得到一条直线,求得kq值为1.02×1014L·mol-1·s-1远大于2.0×1010L·mol-1·s-1,属于静态猝灭[24]。根据荧光猝灭方程计算配合物与PTP1B的结合位点数为1.01,结合常数为1.12×106L·mol-1。
同样的方法得到配合物2对TCPTP以及4对PTP1B、TCPTP的结合常数和结合比等,结果列于表3。2和4对PTP1B的结合常数大于TCPTP,表明其对PTP1B的结合能力强于TCPTP,与其对两者的抑制能力一致。
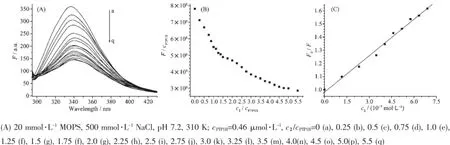
图5 配合物2对PTP1B作用的荧光分析:(A)荧光猝灭曲线;(B)配合物2滴定PTP1B的拟合曲线; (C)配合物2对PTP1B作用的Stern-Volmer图Fig.5Fluorescence emission spectra of the titration of PTP1B by 2,(A)fluorescence quenching curves;(B)a plot of the intensities of emission at 331 nm against the ratio c2/cPTP1Bat 310 K;(C)Stern-Volmer plots for the quenching of PTP1B by 2 at 310 K
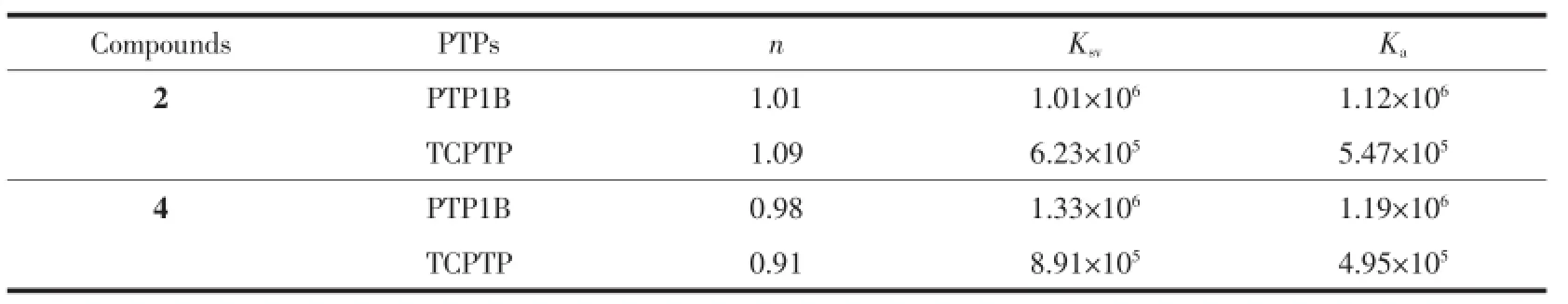
表3 配合物2、4与PTP1B及TCPTP的结合数n,荧光猝灭常数Ksv和结合常数KaTable 3Interaction parameters of complexes 2 and 4 with PTP1B and TCPTP
3 结论
本文研究了5种多苯并咪唑锌配合物对5种蛋白酪氨酸磷酸酶的抑制作用,结果显示这些配合物强烈抑制PTP1B的活性。其中2种配合物对PTP1B表现出较强的选择性,表明配合物的结构影响其对PTP1B的选择性。进一步研究显示其选择性可能与其抑制方式有关。荧光滴定表明锌配合物与蛋白酪氨酸磷酸酶发生了结合作用。这些结果提示进一步深入研究锌配合物对蛋白酪氨酸磷酸酶的抑制作用,或许能筛选出对PTP1B具有较好选择性的低毒高效的锌配合物抗糖尿病药物。
参考文献:
[1]Andersen J N,Jansen P G,Echwald S M,et al.FASEB J., 2004,18:8-30
[2]Zhang S,Zhang Z Y.Drug Discovery Today,2007,12:373-381
[3]Stuible M,Doody K M,Tremblay M L.Cancer Metast.Rev., 2008,27:215-230
[4]Blaskovich M A T.Curr.Med.Chem.,2009,16:2095-2176
[5]Rhee I,Veillette A.Nat.Immunol.,2012,13:439-447
[6]Haase H,Maret W.Biometals,2005,18:333-338
[7]Maret W.Biometals,2013,26:197-204
[8]Haase H,Maret W.Exp.Cell Res.,2003,291:289-298
[9]Haase H,Maret W.J.Trace Elem.Med.Biol.,2005,19:37-42
[10]Yuan C,Lu L,Gao X,et al.J.Biol.Inorg.Chem.,2009,14: 841-851
[11]Lu L,Wang S,Zhu M,et al.Biometals,2010,23:1139-1147
[12]Yuan C,Lu L,Wu Y,et al.J.Inorg.Biochem.,2010,104: 978-986
[13]Lu L,Yue J,Yuan C,et al.J.Inorg.Biochem.,2011,105: 1323-1328
[14]Han H,Lu L,Wang Q,et al.Dalton Trans.,2012,41:11116-11124
[15]Lu L,Gao X,Zhu M,et al.Biometals,2012,25:599-610
[16]GAO Xiao-Li(高晓丽),LU Li-Ping(卢丽萍),ZHU Miao-Li (朱苗力),et al.Acta Chim.Sinica(化学学报),2009,67:929-936
[17]LI Peng-Yu(李鹏宇),LU Li-Ping(卢丽萍).Chinese.J.Inorg. Chem.(无机化学学报),2013,9:1830-1834
[18]Lu L,Zhu M.Anti-Cancer Agents Med.Chem.,2011,11:164-171
[19]Ma L,Lu L,Zhu M,et al.Dalton Ttrans.,2011,40:6532-6540
[20]Wang Q,Lu L,Yuan C,et al.Chem.Commun.,2010,46: 3547-3549
[21]Wang Q,Zhu M,Lu L,et al.Dalton Trans.,2011,40:12926-12934
[22]Yuan C,Zhu M,Wang Q,et al.Chem.Commun.,2012,48: 1153-1155
[23]Li Y,Lu L,Zhu M,et al.Biometals,2011,24:993-1004
[24]Ma L,Lu L,Zhu M,et al.J.Inorg.Biochem.,2011,105: 1138-1147
[25]Zhu R,Lu L,Zhu M,et al.Inorg.Chim.Acta,2013,405:91-97
[26]Lu L,Zhu M.Antioxid.Redox Signaling,2014,20:2209-2224
[27]YUAN Cai-Xia(袁彩霞),LAN Shu-Fen(兰淑芬),LU Li-Ping (卢丽萍).Chinese.J.Inorg.Chem.(无机化学学报),2015, 31:915-922
[28]Gans P,Sabatini A,Vacca A.J.Chem.Soc.Dalton Trans., 1985,38:1195-1200
[29]Isele K,Broughton V,Matthews C J,et al.Dalton Trans., 2002:3899-3905
[30]Quiroz-Castro E,Bernes E,Barba-Behrens N.Polyhedron, 2000,19:1479-1484
[31]Liu Y C,Ma J F,Hu N H,et al.Acta Crystallogr.,Sect.E, 2003,59:m361-m362
[32]ZHU Li(朱莉),LIAO Zhan-Ru(廖展如),LONG Yun-Fei(龙云飞),et al.Chinese.J.Inorg.Chem.(无机化学学报),2004, 20:399-402
[33]Birker P J M W L,Schierbeek A J,Verschoor G C,et al. Chem.Commun.,1981:1124-1125
[34]Woolley E M,Tomkins J,Hepler L G.J.Solution Chem., 1972,1:341-351
PTPs Inhibition by Zinc(Ⅱ)Complexes with Multi-benzimidazole Derivatives
CHEN QingLU Li-Ping*
(Institute of Molecular Science,Key Laboratory of Chemical Biology and Molecular Engineering, Ministry of Education,Shanxi University,Taiyuan 030006,China)
The inhibitory effects against human protein tyrosine phosphatase 1B(PTP1B),T-cell protein tyrosine phosphatase(TCPTP),megakaryocyte protein tyrosine phosphatase 2(PTP-MEG2),srchomology phosphatase 1 (SHP-1)and srchomology phosphatase 2(SHP-2)of five zinc(Ⅱ)complexes with multi-benzimidazole derivatives, [Zn(TDB)2]Cl2(1),[Zn(NTB)Cl]Cl(2),[Zn(EDTB)]Cl2(3),[Zn2(EGTB)Cl2]Cl2(4)and[Zn2(DTPB)Cl3]Cl(5)(TDB= 1,2-bis(1H-benzo-imidazol-2-yl)ethane-1,2-diol,NTB=tris(1H-benzoimidazol-2-ylmethyl)amine,EDTB=N,N,N′,N′-tetrakis(1H-benzoimidazol-2-ylmethyl)ethane-1,2-diamine,EGTB=bis(1H-benzoimidazol-2-ylmethyl)-[2-(2-{2-[bis-(1H-benzoimidazol-2-ylmethyl)-amino]ethoxy}ethoxy)ethyl]amine and DTPB=1,1,4,7,7-pentakis(1H-benz-imidazol-2-ylmethyl)-1,4,7-triazaheptane),were evaluated in vitro in this paper.The five zinc(Ⅱ)complexes potently inhibit PTP1B with IC50at range from 0.15 to 0.28 μmol·L-1,but show weaker inhibition against PTP-MEG2,SHP-1, almost no inhibition against SHP-2.It is interesting that complexes 2 and 4 exhibit weaker inhibition than 1,3 and 5 against TCPTP that is highly homologous with PTP1B.Therefore,2 and 4 display obvious selective against PTP1B with 7~12 times stonger than against TCPTP,10~15 times stonger than against PTP-MEG2,20~40 timesstonger than against SHP-1 and about 1 000 times stonger than against SHP-2,suggesting the structure of zinc(Ⅱ) complexes influence the selectivity against PTP1B.Kinetic analysis indicates that complexes 2 and 4 are reversible competitive inhibitors of PTP1B but noncompettitive inhibitors for TCPTP.Fluorescence study on the interaction between complex 2 or 4 and PTP1B or TCPTP suggests that the complexes bind to PTP1B or TCPTP with the formation of a 1∶1 complex.The binding constant are about 1.12×106,5.47×105,1.19×106,and 4.95×105L·mol-1respectively,showing stronger binding ability of 2 and 4 to PTP1B than to TCPTP,agreeing with their inhibition against the two enzymes.
zinc(Ⅱ)complex;protein tyrosine phosphatase;inhibition;selectivity
O614.24+1;O611.3
A
1001-4861(2016)06-1001-08
10.11862/CJIC.2016.123
2015-12-11。收修改稿日期:2016-02-09。
国家自然科学基金(No.21271121)和山西省回国留学人员科研项目(No.2013-026)资助。
*通信联系人。E-mail:luliping@sxu.edu.cn

