例谈定量实验中的数据处理
安徽 汤 伟(特级教师)
例谈定量实验中的数据处理
安徽 汤 伟(特级教师)
化学学科不仅注重定性实验研究,还特别注重定量实验的研究,针对定量实验,我们不仅需要掌握其实验的基本操作要点,把握如何测定相关实验数据,另外还要注意这些实验的基本计算和误差分析,下面做一具体分析:
一、定量实验过程中数据的测定与计算技巧
1.沉淀法
先将某种成分转化为沉淀,然后称量纯净、干燥的沉淀的质量,再进行相关计算,如测定溶液中碳酸钠中含量,可以通过转化为碳酸钙沉淀,通过测定碳酸钙沉淀的质量推算出碳酸钠的量。
2.测气体体积法
对于产生气体的反应,可以通过测定气体体积的方法测定样品纯度。如测定纯碱碳酸钠的纯度,我们可以通过加入酸,使其转化为CO2气体,通过测定CO2气体,推算出纯碱的纯度。解答该类问题时,我们还要把握测定气体常用的方法及其相关的装置特点,下列装置中,A是常规的量气装置,B、C、D是改进后的装置。

3.测气体质量法
将生成的气体通入足量的吸收剂中,通过称量实验前后吸收剂的质量,求得所吸收气体的质量,然后进行相关计算。如测定纯碱碳酸钠的纯度,我们可以通过加入酸,使其转化为CO2气体,然后让干燥的CO2气体通过碱石灰吸收,通过质量增加量推算纯碱的量。
4.滴定法
即利用滴定操作原理,通过酸碱中和滴定、沉淀滴定和氧化还原反应滴定等获得相应数据后再进行相关计算。该方法涉及的计算在高考中属于高频考点,如2016年天津卷、浙江卷、新课标卷等均涉及滴定的相关计算问题。
通过以上各种方测定出相关数据后,我们要学会正确的建立关系式(一般采用元素守恒,属于氧化还原反应的,还常常采用电子守恒),通过关系式,推算相关结论。
例1 (2016新课标Ⅰ,27题节选)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为________mol·L-1,此时溶液中c()等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
分析:当溶液中Cl-离子完全沉淀时,即Cl-浓度等于1.0×10-5mol·L-1时,c(Ag+)=Ksp(AgCl)/c(Cl-)=2.0×10-10/1.0×10-5=2.0×10-5;此时溶液中c()=Ksp(Ag2CrO4)/c2(Ag+)=2.0×10-12/(2.0×10-5)2=5.0×10-3。
例2 (2016新课标Ⅰ,28节选)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为________。(计算结果保留两位小数)
分析:每克NaClO2的物质的量为=mol,根据电子转移数目相等可知,氯气的物质的量为,则氯气的质量为mol× 71g/mol=1.57g。
例3 (2016新课标Ⅰ,36节选)高锰酸钾纯度的测定:称取1.080 0g样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为0.200 0mol·L-1的H2C2O4标准溶液20.00mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48mL。该样品的纯度为______ __________(列出计算式即可,已知+5H2C2O4+ 6H+2Mn2++10CO2↑+8H2O)。
解析:根据离子反应方程式2MnO-4+5H2C2O4+ 6H+2Mn2++10CO2↑+8H2O,可以得出高锰酸钾与草酸的关系:2KMnO4→5H2C2O4,由此推理得出样品的纯度为。
二、定量实验中相关数据的处理与计算技巧
如何捕获实验过程中的有用信息,其中实验数据统计与整理是一个行之有效的方法,在高考中具体的体现主要有:
1.数据表格化
该类试题的特点是通过多次分组实验或不同物质的实验,得出不同组实验数据,我们针对该数据,解题的关键点在于通过审题,获取有用信息,然后对表格中数据进行比较分析,依据物质的性质、变化规律,然后进行解答。
例1 (2015新课标卷Ⅱ,26)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据如下图所示:
回答下列问题:
(1)该电池的正极反应式为______________,电池反应的离子方程式为________。
(2)维持电流强度为0.5A,电池工作五分钟,理论消耗Zn________g。(已知F=96 500C/mol)
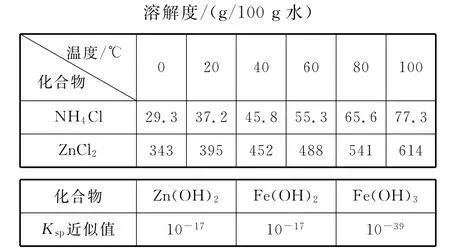
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过________分离回收,滤渣的主要成分是二氧化锰、________和______,欲从中得到较纯的二氧化锰,最简便的方法是_____________,其原理是_____________。
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入新硫酸和双氧水,溶解,铁变为______;加碱调节pH为______,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全)。继续加碱调节pH为_____,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加双氧水的后果是______,原因是________ ________。
答案:(1)MnO2+e-+H+MnOOH Zn+ 2MnO2+2H+Zn2++2MnOOH (2)0.05 (3)加热浓缩、冷却结晶 铁粉 MnOOH 在空气中加热 碳粉转变为CO2,MnOOH氧化为MnO2(4)Fe3+2.7 6 Zn2+和Fe2+分离不开 Fe(OH)2和Zn(OH)2的Ksp相近
2.数据图象化
图象化是用直线图或曲线图对化学实验结果加以处理的一种简明化形式。它适用于一个量的变化引起另一个量的变化的情况。图象化的最大特点是鲜明、直观、简单、明了。针对直角坐标系题的解题关键点在于解题时要求学生首先弄清楚自变量和因变量到底是什么,注意理解起点、终点、转折点的含义。然后根据所学知识分析概念、图象、数值三者之间的关系。
例2 (2016新课标Ⅱ,27节选)丙烯腈(CH2CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2CHCHO)和乙腈(CH3CN)等。回答下列问题:
(1)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或“不是”)对应温度下的平衡产率,判断理由是________________________________________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大
C.副反应增多 D.反应活化能增大

(2)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为________,理由是_________________________________________________进料气:氨、空气、丙烯的理论体积比约为________。
解析:(1)460℃以前,是建立平衡阶段,所以温度低于460℃,丙烯腈的产率不是对应温度下的平衡产率;针对该反应为放热反应,所以达到平衡后,升高温度,平衡会逆向移动,平衡产率会降低;温度较高,催化剂的活性会降低或失去活性,另外副反应也会明显增多,所以会造成丙烯腈的产率降低,即AC选项符合题意,升高温度,因为平衡逆向移动,平衡常数会减小,选项B错误,温度的改变不会影响反应活化能的改变,所以选项D错误。(3)根据提供的图示可以得出,n(氨)/n(丙烯)约为1时,此时产物主要是丙烯腈,副产物几乎没有,是最佳比;根据化学反应C3H6(g)+NH3(g)+3/2O2(g)C3H3N(g)+3H2O(g),氨气、氧气、丙烯按2∶3∶2的体积比加入反应达到最佳状态,而空气中氧气约占20%,所以进料氨、空气、丙烯的理论体积约为2∶15∶2或1∶7.5∶1。
答案:(1)不是 该反应为放热反应,平衡产率应随温度升高而降低 AC
(2)1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 1∶7.5∶1
(作者单位:安徽省灵璧中学)

