“真题”放送 “赢在”总结
——以“物质制备”为背景的实验题考查方式例谈
河北 颜建河
“真题”放送 “赢在”总结
——以“物质制备”为背景的实验题考查方式例谈
河北 颜建河
2016年高考已经结束,认真分析今年各地高考试题,从中不难发现,化学实验是高考命题的重点,特别是以“物质制备”为背景,以非选择题型来考查化学实验知识的综合应用能力和设计、评价实验方案的探究能力,成为高考化学学科的主打题目。其题型特点:(1)结合元素及其化合物知识,根据实验流程分析仪器、药品的作用以及污染物的处理方法;(2)根据实验目的和所给药品、仪器,设计、评价实验方案,考查学生分析问题、解决问题的能力。立足基础,掌握核心(主干)知识,学会总结反思,学会迁移运用,才能做到不变应万变,战无不胜。
考查方式之一——以“物质制备”为背景命题,考查学生物质分离提纯为核心的实验综合能力
考题以“物质制备”为背景命题,题干主要以化学工艺流程和熟知反应、实验方法等作为题目材料予以呈现。着力考查学生运用化学原理(化学反应、溶解度、化学平衡)及相关实验知识等来解决工业生产中实际问题的能力。
例1 (2016全国Ⅲ)以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:

物质 V2O5 V2O4K2SO4SiO2Fe2O3Al2O3质量分数/% 2.2~2.9 2.8~3.1 22~28 60~65 1~2 <1
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为,反应的离子方程式为_________________,同时V2O4转化成VO2+。“废渣1”的主要成分是________。
(2)“氧化”中欲使3mol的VO2+变为,则需要氧化剂KClO3至少为________mol。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式:_____________________________。
分析与解答:本题是一道“从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用”的“物质制备”化学工艺流程题实验题。试题设问立足于教材,而高于教材,着力考查学生运用化学原理、化学反应、化学平衡等相关知识,综合性较强,有一定难度。为此,解答这类问题的关键,就是从制备框图和问题出发,充分利用好题目给予的信息(或知识),并结合所学核心知识(如溶解度、物质的分离、化学平衡原理等)来解决题目中的各个问题。
(1)“酸浸”时V2O5转化为VO+2,V元素化合价不变,说明不是氧化还原反应,根据原子守恒配平即可;从题目所给数据分析,二氧化硅与酸不反应,则“废渣1”的主要成分是二氧化硅。(2)“氧化”中欲使3mol的VO2+变为VO+2,V元素的化合价从+4价升高到+5价,而氧化剂KClO3中氯元素化合价从+5价降低到-1价,则根据电子得失相等可知,所需要氯酸钾的物质的量为3mol/6=0.5mol。(3)“中和”作用之一是使钒以V4O4-12形式存在于溶液中,同时生成氢氧化铁、氢氧化铝,则“废渣2”中含有Fe(OH)3、Al(OH)3。(4)根据题给反应方程式可知,为了提高洗脱效率,反应应该向逆反应方向进行,则淋洗液应该呈碱性。(5)由于前面(流程中)加入了氯酸钾和氢氧化钾,则“流出液”中最多的阳离子是钾离子。(6)根据原子守恒可知,偏钒酸铵(NH4VO3)“煅烧”生成七氧化二钒、氨气和水。
考查方式之二——以“物质制备”为背景命题,考查学生实验设计、实验探究和实验操作能力
考题以“物质制备”为背景命题,题干主要以化学工艺流程和探究物质性质为核心等作为题目材料予以呈现。着力考查学生物质制备(实验目的、原理、方法等)的实验设计、实验探究和实验操作的综合能力。
例2 (2016北京)以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是________________________________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:

①写出ii的离子方程式:__________________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________________________________________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aqNaHPbO2(aq),其溶解度曲线如图所示。

①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是________(填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过程Ⅲ的目的是提纯。结合上述溶解度曲线,简述过程Ⅲ的操作:________________________________________。
分析与解答:本题是一道“以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用”的“物质制备”化学工艺流程题,看似复杂,实际上考查的都是学生熟知的基础知识及运用(催化剂,离子方程式书写,化学实验方案的设计,物质的分离、提纯,平衡移动原理的应用),有一定难度。为此,解答这类问题的关键,就是从制备框图和问题出发,抓住核心反应和利用好题中的各种条件来解决题目中的各个问题。
(1)根据题给化学工艺流程知,过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4和水。(2)①催化剂的作用是通过参加反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后都不变。根据题给信息知,反应i中Fe2+被PbO2氧化为Fe3+,则ii中Fe3+被Pb还原为Fe2+;②a实验证明发生反应i,则b实验证明发生反应ii,实验方案为:取a中红色溶液少量,向其中加入过量铅粉后,充分反应,红色褪去。(3)①过程Ⅱ的目的是脱硫,其脱硫过程发生的反应为 PbSO4+ 2NaOHPbO+Na2SO4+H2O,而滤液Ⅰ中含有硫酸,可降低溶液的pH,使平衡:PbO(s)+NaOH(aq)NaHPbO2(aq)逆向移动,减少PbO的损失,提高产品的产率,重复利用NaOH,提高原料的利用率,正确选项为AB;②根据PbO的溶解度曲线判断,提纯粗Pb应用趁热过滤,冷却结晶的方法。
考查方式之三——以“物质制备”为背景命题,考查实验原理、试剂与仪器的选择和计算的能力
考题以“实验操作”为背景命题,题干以学生所熟知的实验基础知识、基本操作为主要目标作为题目材料予以呈现。着力考查学生的基本实验操作技能、技巧(实验仪器选择、组装和使用方法)和计算能力。
例3 (2016浙江)无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
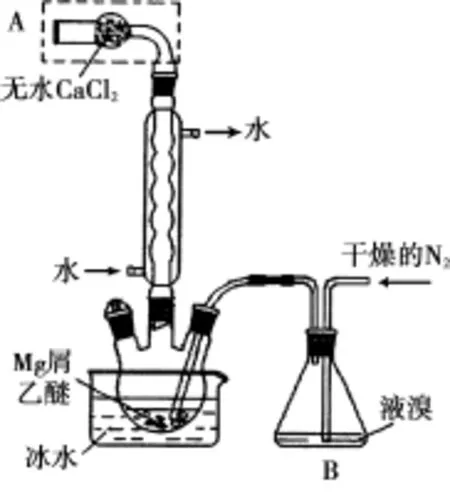
图1
步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。实验中不能用干燥空气代替干燥N2,原因是____________________________。
(2)如将装置B改为装置C(图2),可能会导致的后果是____________________________________________________。

(3)步骤3中,第一次过滤除去的物质是____________。
(4)有关步骤4的说法,正确的是________。
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:

①滴定前润洗滴定管的操作方法是________________。
②测定时,先称取0.250 0g无水MgBr2产品,溶解后,用0.050 0mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是____________(以质量分数表示)。
分析与解答:本题是一道“实验室采用镁屑与液溴为原料制备无水MgBr2”的“物质制备”实验操作类的化学实验综合题,着力考查学生化学基础知识和基本实验技能,涉及较多的化学知识,且综合性强,有一定难度。为此,解答这类问题的关键,就是从实验装置和问题出发,明确实验的目标,再结合题目设问及实验装置图,利用好卤素、氧化还原反应和滴定计算等相关知识来解决题目中的各个问题。
(1)本实验要用镁屑和液溴反应生成无水溴化镁,所以装置中不能有能与镁反应的气体,如氧气能与Mg反应生成的MgO阻碍Mg和Br2的反应,故不能用干燥的空气代替干燥的氮气。(2)将装置B改为装置C,当干燥的氮气通入,会使气压变大,将液溴快速压入三颈瓶,使反应过快并大量放热导致产生安全隐患。而装置B是利用干燥的氮气将溴蒸气带入三颈烧瓶中,使反应速率可以控制。(4)选项A,95%的乙醇中含有水,溴化镁有强烈的吸水性,错误;选项B,加入苯的目的是除去乙醚和溴,洗涤晶体用0℃的苯,可以减少产品的溶解,正确;选项C,加热至160℃的主要目的是分解三乙醚合溴化镁得到溴化镁,不是为了除去苯,错误;选项D,该步骤是为了除去乙醚和溴,故正确。(5)①滴定前润洗滴定管2~3次。②根据反应方程式分析知,n(MgBr2)=0.050 0mol·L-1×0.026 50L=0.001 325mol,则m(MgBr2)=0.001 325mol×184g·mol-1=0.243 8g,所以溴化镁的产品的纯度为0.243 8g/0.250 0g=97.5%。
【答案】(1)干燥管 防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应 (2)会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患 (3)镁屑 (4)BD(5)①从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2~3次②97.5%
启示:以“物质制备”为背景的实验题考查方式,其命题核心就是通过化学工艺流程和实验装置作为“物质制备”的载体,并以此来设计问题,着力考查学生掌握化学主干知识和化学实验的基本操作的综合运用的能力。
1.熟悉物质的制备流程考查要点(主线主产品、分支副产品、弯箭头为循环)。

2.掌握物质制备常涉及的化学原理。(1)氧化还原反应的具体应用:强弱规律、守恒规律、选择规律。(2)反应速率及化学平衡理论在实际生产中的应用、反应速率控制、化学平衡移动、化学平衡常数的应用、反应条件的控制。(3)盐类水解的具体应用:水解规律、水解反应的控制(抑制或促进)。(4)沉淀溶解平衡的相关应用、沉淀的最小浓度控制、沉淀转化的条件。
3.明确物质制备的实验技术。结合化学工艺流程考查化学实验比单纯考查实验难度又上升一个档次,但“万变不离其宗”,考查的实验知识仍是最基本的,如基本仪器使用、基本实验操作等,而基本实验操作中最常见的考点是物质的分离的提纯,加入某种试剂除杂、调节pH除杂、蒸发浓缩、冷却结晶(如除去KNO3中少量NaCl)、蒸发结晶、趁热过滤(如除去NaCl中的少量KNO3)。
(作者单位:河北省衡水市故城县教育局教研室)

