泰拉霉素分离纯化工艺研究
陆建中路福平
(1.天津科技大学生物工程学院,天津 300457;2.宁夏泰瑞制药股份有限公司,宁夏银川 750101)
泰拉霉素分离纯化工艺研究
陆建中1,2路福平1
(1.天津科技大学生物工程学院,天津 300457;2.宁夏泰瑞制药股份有限公司,宁夏银川 750101)
对泰拉霉素粗品的萃取、树脂吸附方法进行分析,通过对萃取剂、萃取pH、相比、萃取次数、树脂类型、树脂吸附温度工艺等进行比较。确定了泰拉霉素的分离纯化工艺为:用乙酸丁酯作为萃取剂,萃取pH值为8.5~9.0,乙酸丁酯与泰拉霉素溶液萃取体积比1∶2,进行2次萃取,选择DM-301大孔吸附树脂在30~35℃、pH7~8、用甲醇与水7:3的比例作为洗脱剂、流速40ml/min进行解析。对确定的泰拉霉素分离纯化工艺经过生产验证,产品含量达到96%以上。
泰拉霉素;萃取;树脂吸附;含量
泰拉霉素(Tulathromycin)是第三代大环内酯类抗生素,是美国辉瑞动物保健品公司在20世纪末研制和开发的一种新型动物专用半合成抗生素[1]。主要用于防治由胸膜肺炎放线杆菌、支原体、巴氏杆菌、副嗜血杆菌、支气管败血性博德特菌等引起的猪、牛呼吸系统疾病[2]。我国农业部在2008年第957号公告中首次批准在国内使用泰拉霉素,并从美国辉瑞公司Groton生产厂和法国辉瑞公司Ambiose生产厂进口泰拉霉素原料药和泰拉霉素注射液[1]。泰拉霉素为半合成兽用抗生素,受产品杂质和收率影响,该产品主要依赖进口,本文主要从影响产品质量和收率的分离纯化工艺进行分析研究,旨在优化最佳分离纯化条件,为该产品工业化生产提供指导。
1 材料与方法
1.1 材料
泰拉霉素购自美国辉瑞公司,作为对照品;甲醇、丙酮、乙酸乙酯为工业级,烟酸、氢氧化钠、磷酸为分析级,均购自国药集团化学试剂有限公司,各种型号树脂购自郑州勤实科技有限公司。
1.2 液相色谱仪测试条件
用十八烷基硅烷键合硅胶为填充剂(YMC Pack ProC18,150*4.6mm,3um);甲醇-乙腈-0.05mol/L磷酸二氢钾(pH7.00)(45∶25∶30)为流动相;流速为2ml/min;柱温35℃土5℃;检测波长205nm。
1.3 泰拉霉素标准品溶液的制备
精密称取0.05g泰拉霉素标准品,用纯化水溶于50ml棕色容量瓶中,制得浓度为1g/L的泰拉霉素标准储备液,于4℃冰箱保存备用。精密移取适量上述标准储备液,用纯水配制成浓度为20、40、60、80、100、120、150、180、200mg/L的泰拉霉素标准品溶液。
1.4 方法
1.4.1 萃取
(1)萃取剂的选择
取20g泰拉霉素粗品,加入30%的磷酸溶液,溶液体积控制在200ml,pH值4.0~4.5,搅拌溶解,得到泰拉霉素溶液。分别加入等体积的异丙醇、氯仿、MIBK、乙酸乙酯和乙酸丁酯依次萃取,磁力搅拌20 min。搅拌过程中加入30%的氢氧化钠溶液,调节溶液pH至8.0,每次萃取完毕,取出倒入分液漏斗中静置lh,待其分层。
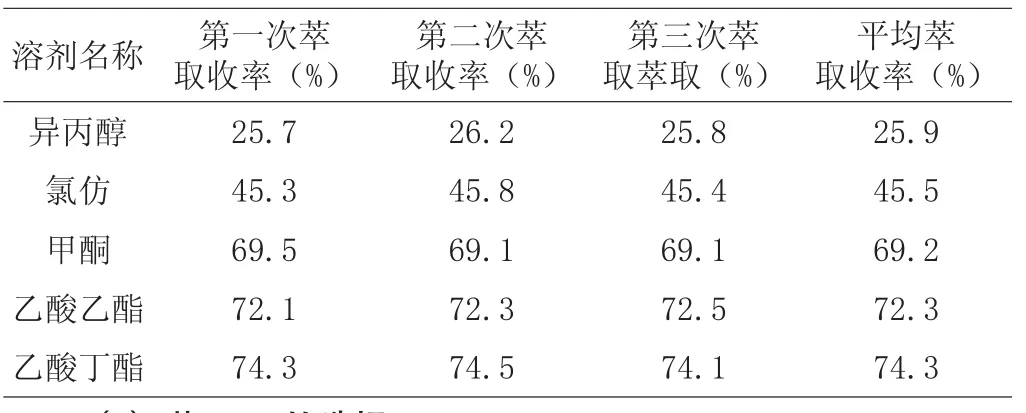
表1 不同有机溶剂对泰拉霉素萃取率的影响
(2)萃取pH的选择
在不同pH条件下(pH分别调至7.5、8.0、8.5、9.0、9.5)进行,加入等体积的乙酸丁酯萃取,磁力搅拌20min,分液漏斗中静置lh,待其分层。
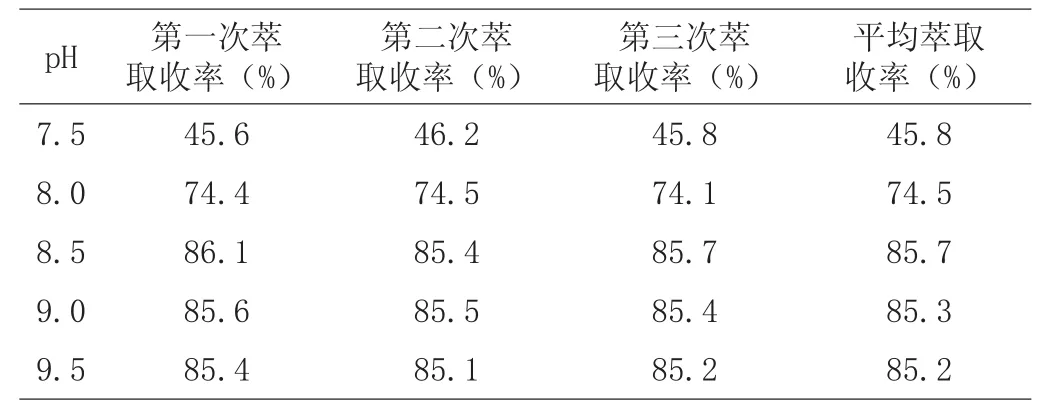
表2 不同pH对泰拉霉素萃取率的影响
(3)萃取相比的选择
将泰拉霉素溶液的pH调至8.5,分别加入体积比为2∶l、l∶l、l∶2、l∶3和1∶4(乙酸丁酯:泰拉霉素溶液,V/V)的乙酸丁酯萃取,磁力搅拌20min,分液漏斗中静置1h,待其分层,取样检测。
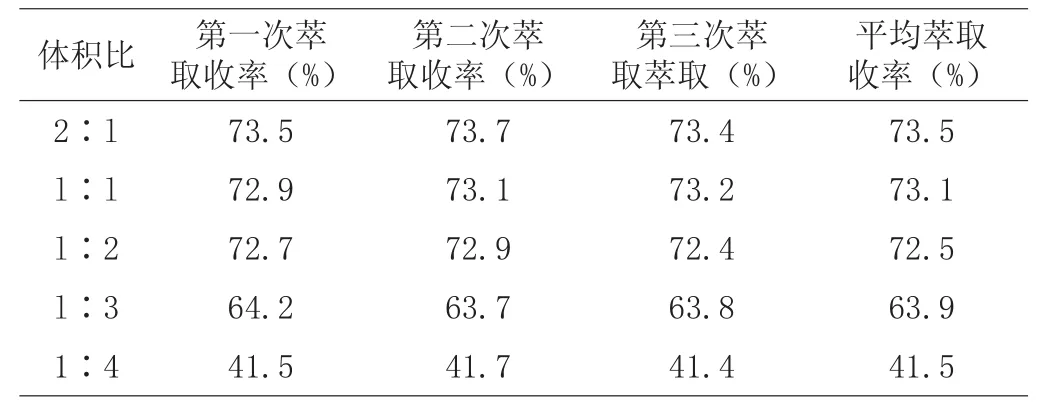
表3 不同体积比对泰拉霉素萃取率的影响
1.4.2 树脂吸附
(1)吸附树脂的选择 不同浓度的条件下,四种大孔吸附树脂的吸附数据见表6
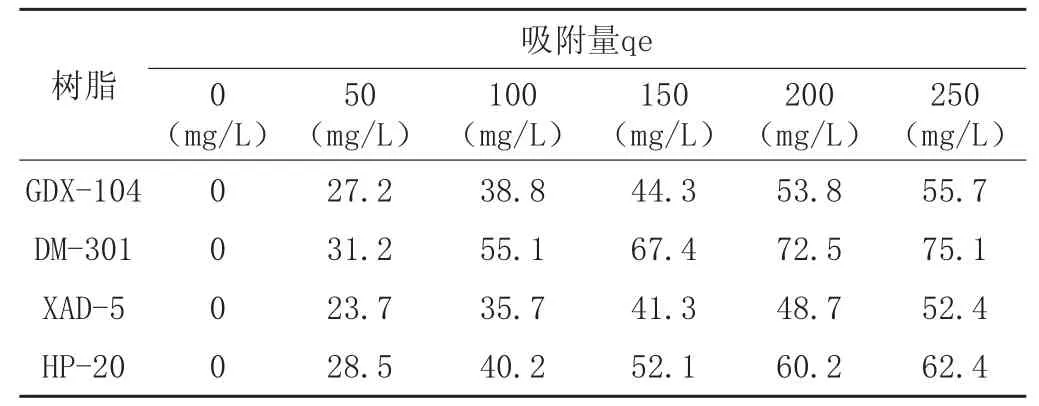
表4 四种大孔吸附树脂的吸附量
(2)吸附温度的选择
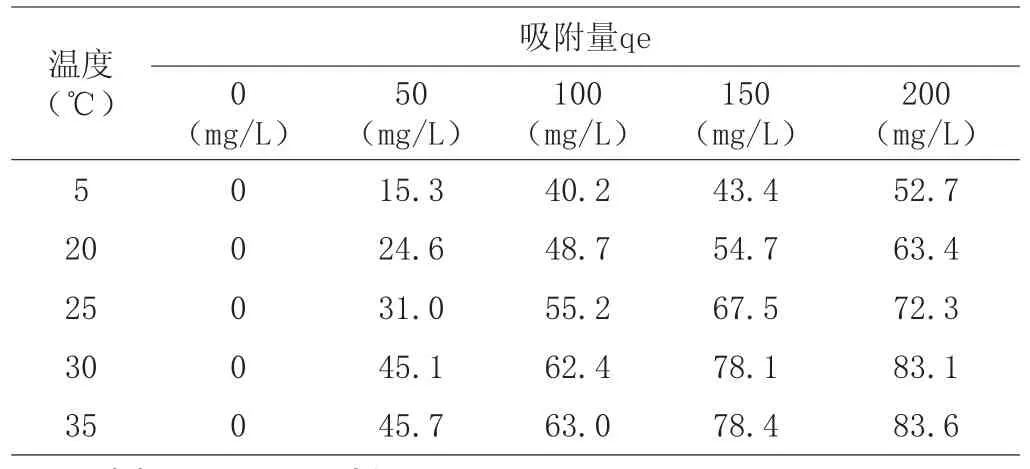
表5 温度对DM-301大孔吸附树脂吸附泰拉霉素的影响
(3) 吸附pH的选择

表6 pH对吸附率的影响
1.4.3 解吸剂
不同解吸剂以及解吸剂浓度、流速的选择

表7 不同解吸剂解析效果的比较

表8 甲醇浓度对静态解析的影响

表9 解吸剂流速对解析的影响
2 分析与讨论
(1)根据产品和溶剂的极性以及有机溶媒的实用性、经济性等因素的综合考虑,从表1得出乙酸丁酯的萃取率最高,能够将泰拉霉素从水相中萃取出来,异丙醇的萃取效果最差。考察不同的pH值下泰拉霉素的萃取效果,从表2得出在碱性条件下的分配系数较大,酸化液pH>8.5时,萃取率最高。因此,在进行萃取操作时将酸化液的pH调至8.5~9.0,达到最高的萃取收率。从生产的操作过程考虑,选择乙酸丁酯与泰拉霉素溶液的体积比为l∶2进行萃取操作。
(2)在不同浓度条件下,选择四种大孔吸附树脂进行吸附,从表4得出DM-301大孔吸附树脂的吸附量大于其它三种树脂的吸附量。由表5数据得出升高温度有利于泰拉霉素在树脂上的吸附,根据吸附的特征常数,确定吸附温度控制在30~35℃。考察了pH的影响,综合各因素,选定pH7~8作为吸附的最佳pH值。
(3)泰拉霉素是一种弱碱性物质,洗脱剂pH的变化会影响洗脱剂的解析能力。由表7得出使用单一的解吸剂,其解析效果较差,甲醇/水在酸性条件下洗脱的效率、效果最佳。从表8看出当甲醇的浓度70%以上,其洗脱率达到了94%以上,进一步增加甲醇浓度,洗脱率缓慢增加。考虑生产成本,建议甲醇作为洗脱剂,其浓度控制在70%。考察了解吸剂的流速,在相同的吸附条件下,洗脱速度越慢,泰拉霉素洗脱峰比较集中,但洗脱速度过慢,则会造成洗脱周期长,结柱严重等现象;而洗脱速度过快,则会使得泰拉霉素洗脱峰分散,洗脱效果较差。当洗脱速度为40ml/min,泰拉霉素洗脱率为93.1%。综合应用生产考虑选择40ml/min的速度进行洗脱较为合适。
3 结果验证
根据上述实验确定的萃取、吸附、解析的参数进行放大验证,结果见表10。根据放大的工艺进行产品生产,3批成品的含量均在96%以上,符合进口兽药质量标准。
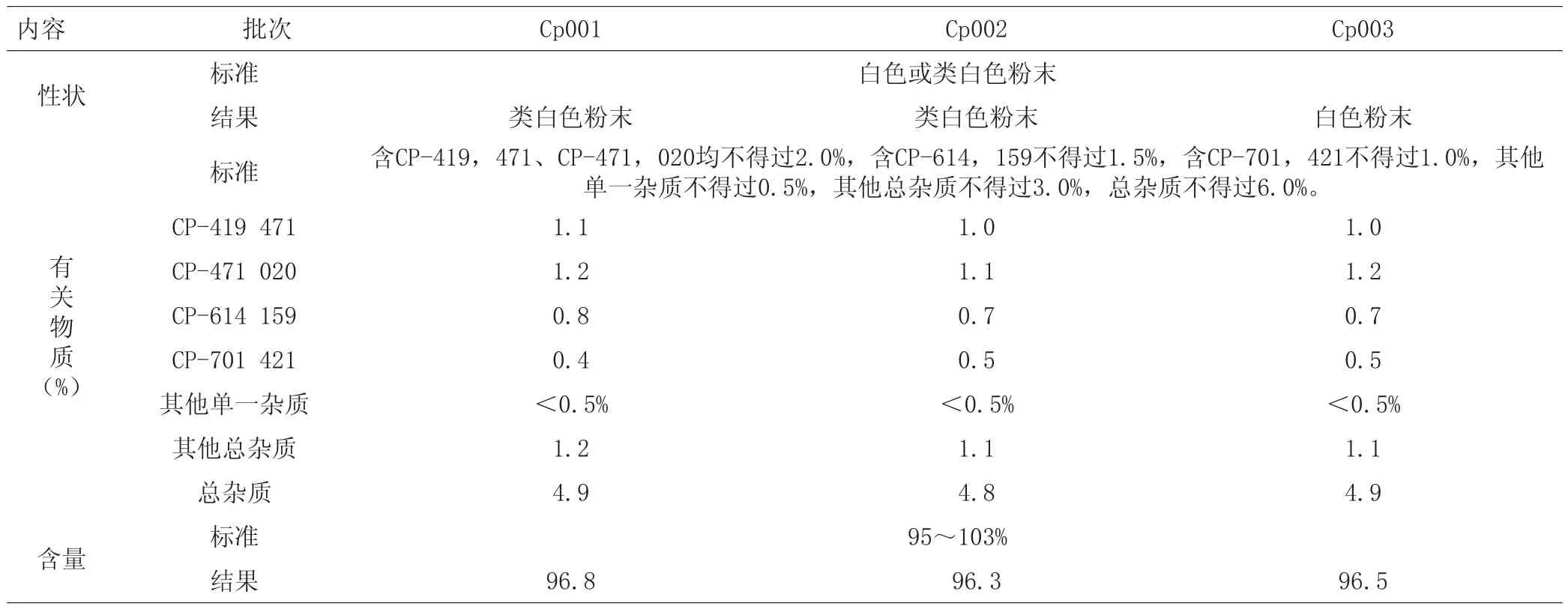
表10 泰拉霉素成品质量数据汇总
4 结论
泰拉霉素粗品用乙酸丁酯作为萃取剂,萃取pH值为8.5~9.0,乙酸丁酯与泰拉霉素溶液萃取体积比1∶2,进行2次萃取,选择DM-301大孔吸附树脂在30~35℃、pH7~8、用甲醇与水7:3的比例作为洗脱剂、流速40ml/min的分离纯化工艺所得产品质量符合进口兽药质量标准,该工艺对产品质量有很好的提高。
[1] 闫彩虹.新型动物专用抗生素泰拉霉素研究进展[J].畜禽业,2009,(10):19-21.
[2] Evans N A.Tulathromycin:an overview of a new triamilide antimicrobial for livestockrespiratory disease [J].Veterinary Therapeutic,2005,6(2):83-95.

