不同强度的运动对去卵巢大鼠骨质疏松症的骨代谢机制的研究*
王士冲常青郑帅杨西雨刘亚钟卫权
不同强度的运动对去卵巢大鼠骨质疏松症的骨代谢机制的研究*
王士冲①常青①郑帅①杨西雨①刘亚①钟卫权①
【摘要】目的:通过不同强度运动对去卵巢大鼠血清中OPG、RANKL和IGF-1表达的影响,探讨运动对去卵巢骨质疏松症的影响机制。方法:将大鼠随机分为正常对照组、假手术组、骨质疏松模型组、30 min运动组和60 min运动组,运动组持续训练8周。处死大鼠,取血清进行测试。结果:与正常对照组比较,8周训练后,骨质疏松模型组和30 min运动组大鼠体重显著增加(P<0.05),而60 min运动组大鼠体重增加不明显。此外,与正常对照组比较,骨质疏松模型组大鼠的OPG、IGF-1的表达明显降低,RANKL表达明显升高(P<0.01)。60 min运动组的OPG和IGF-1的水平与骨质疏松模型组大鼠比较有显著升高(P<0.01),30 min运动组大鼠的OPG也有升高(P<0.05)。结论:运动对去卵巢大鼠破骨细胞分化传导通路OPG、RANKL的表达有一定调节作用,IGF-1可能参与了对OPG的调节,并对去卵巢所致大鼠骨质疏松症有一定的防治作用。
【关键词】骨质疏松; 运动; OPG; RANKL; IGF-1
①徐州医学院医学技术学院 江苏 徐州 221004
First-author’s address:The Technical School of Xuzhou Medical College,Xuzhou 221004,China
骨质疏松症(osteoporosis)是指由于绝经或年老所致的骨质疏松症,其病理特征是骨组织所有骨的显微结构受损,骨矿成分和骨基质等比例地不断减少,骨质变薄,骨小梁数量减少,骨脆性增加和骨折危险度升高。我国目前已有9000多万骨质疏松症患者,总患病率为12.4%,其中骨折发生率为27.5%~32.6%。随着老龄化社会的到来,该病发病率呈逐年上升之势。绝经后妇女由于卵巢分泌雌激素减少,骨代谢紊乱,常可引起骨质疏松症发生。运动作为一种良性的刺激,可以改善和调节骨的代谢。本研究通过建立去卵巢骨质疏松大鼠模型,采用不同强度的跑台训练,研究运动对大鼠骨代谢机制的影响,为防治绝经后骨质疏松的细胞分子机制提供参考。
1 材料与方法
1.1 实验动物与分组 选取3月龄清洁级雌性Sprague-Dawley大鼠60只(由徐州医学院实验动物中心提供),体重(240±15)g,大鼠按体重分层随机分为五组:正常对照组、假手术组、骨质疏松模型组、中等负荷(30 min)运动组、大负荷(60 min)运动组,每组12只。每笼5只,饲养笼选用塑料制品,并配用不锈钢罩,玻璃吸水瓶和不锈钢吸水管,饲养温度21~24 ℃。国家标准固定混合饲料喂养,自由饮食。
1.2 实验方法及指标测定
1.2.1 卵巢切除方法 假手术组行假手术,按体重腹腔注射10%水合氯醛麻醉,行背部肋下入路,将双侧卵巢提出腹腔,不切除,然后放回腹腔缝合切口,安静状态下常规喂养,不进行运动训练。骨质疏松模型组、30 min运动组和60 min运动组行去卵巢术,按假手术组方法找出双侧卵巢并将其切除。1.2.2 运动方法 30 min运动组:切除卵巢1周后进行适应性跑台训练,开始10 min/次,适应后30 min/次,5次/周,共进行8周。60 min运动组:跑台条件与30 min运动组相同,60 min/次,5次/周,共8周。正常对照组、假手术组和骨质疏松模型组正常饲养。大鼠训练用跑台购自上海继德实验教学器械厂(型号:JD-PT型)。
1.3 检测方法 全部动物在运动组大鼠末次训练后麻醉下处死。腹主动脉取血,将收集的全血室温静置2 h后,3000 r/min,离心20 min,分离血清,-80 ℃保存。血清RANK、OPG和IGF-1的Elisa试剂盒购自上海瑞齐生物科技有限公司,所有指标的测定均根据试剂盒操作要求进行。
1.4 统计学处理 采用SPSS 17.0统计学软件进行数据分析,计量资料以(±s)表示,比较采用单因素方差分析(One-way ANOVA),以P<0.05为差异有统计学意义。
2 结果
2.1 实验前后大鼠体重变化的比较 大鼠训练前,各组大鼠体重无明显差异。经过8周训练后,骨质疏松模型组大鼠和30 min运动组大鼠的体重与正常对照组比较差异均有统计学意义(P<0.05),见表1。
2.2 实验前后大鼠血清中OPG、RANKL和IGF-1含量的比较 8周运动训练后,骨质疏松模型组大鼠血清中OPG水平低于正常组和假手术组,RANKL的分泌量高于正常对照组和假手术组,IGF-1的水平明显低于正常对照组(P<0.01)。8周运动训练后,30 min运动组大鼠除了OPG的血清含量高于骨质疏松模型组(P<0.05),RANKL和IGF-1的水平与其他组均无明显差异;60 min运动组大鼠血清中OPG和IGF-1的水平均高于骨质疏松模型组大鼠(P<0.01),RANKL则相反(P<0.01),见表2。
表1 实验前后大鼠体重变化的比较(±s) g

表1 实验前后大鼠体重变化的比较(±s) g
*与正常对照组比较,P<0.01;△P<0.01,#P<0.05,与假手术组比较
组别 实验前 实验后正常对照组(n=12) 247.03±18.65 334.75±23.41假手术组(n=12) 231.64±11.17 344.86±19.08骨质疏松模型组(n=12) 237.97±22.04 386.54±30.35*△30 min运动组(n=12) 240.34±12.48 373.86±29.69*#60 min运动组(n=12) 239.24±13.06 340.14±18.33
表2 实验前后大鼠血清中OPG、RANKL和IGF-1含量的比较(±s) ng/L
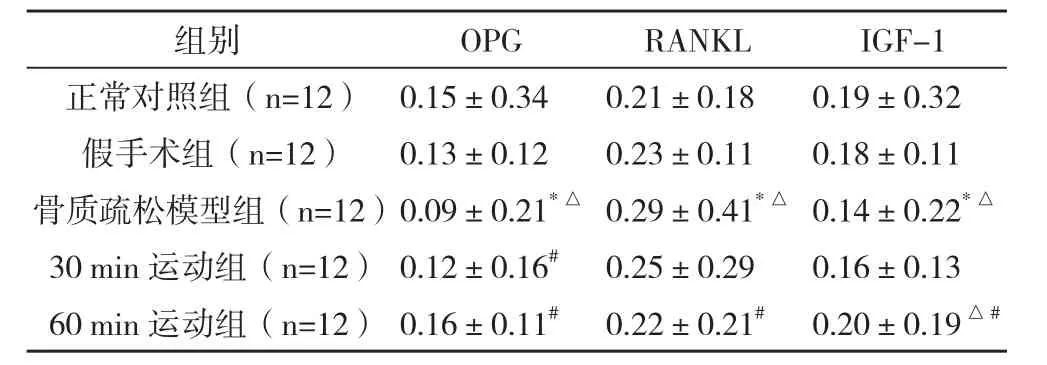
表2 实验前后大鼠血清中OPG、RANKL和IGF-1含量的比较(±s) ng/L
*与正常对照组比较,P<0.01;△与假手术组比较,P<0.05;#与骨质疏松模型组比较,P<0.05
组别 OPG RANKL IGF-1正常对照组(n=12) 0.15±0.34 0.21±0.18 0.19±0.32假手术组(n=12) 0.13±0.12 0.23±0.11 0.18±0.11骨质疏松模型组(n=12)0.09±0.21*△0.29±0.41*△0.14±0.22*△30 min运动组(n=12)0.12±0.16# 0.25±0.29 0.16±0.13 60 min运动组(n=12)0.16±0.11# 0.22±0.21# 0.20±0.19△#
3 讨论
本实验结果显示,在8周以后骨质疏松模型组大鼠与正常对照组比较,体重有明显增加,这与相关研究结果一致[1-2]。其原因可能是卵巢摘除后,血中雌激素水平降低,肾上腺分泌雌酮,在脂肪组织中加速转化为雌激素以弥补血中不足,引起体内脂质代谢失常,脂肪堆积造成肥胖[3]。30 min运动组的大鼠体重与假手术组比较有明显增加,这可能与运动负荷不够有关。
骨质疏松是一种由骨重建过程失衡导致,主要病理表现为松质骨骨小梁变细、断裂和数量减少,皮质骨多孔,骨质结构紊乱。骨组织结构的这些病理改变不仅使骨量减少,且使骨质量下降,明显影响骨的机械功能,致生物力学性能降低。有证据显示女性的骨量丢失开始于绝经前2~3年,随着雌激素分泌的不断减少在绝经后加剧,这个过程将持续5~10年[4-5]。OPG/RANKL/RANK系统在破骨细胞激活、生成、分化和成熟的过程中起着决定性作用,是非常重要的破骨细胞分化调节通路[6]。大鼠去卵巢后,雌激素分泌量减少,骨的吸收增加,骨形成减少。骨保护素(OPG)是RANKL/RANK信号通路的内源性调节因子,OPG广泛分布于人和动物的多种组织细胞中,许多细胞如骨髓间质细胞、成骨细胞、成纤维细胞、主动脉平滑肌细胞、成骨肉瘤细胞等均可分泌OPG,其可与过量的RANKL结合,防止RANK活化,抑制破骨细胞活性[7]。OPG的表达受多种代谢调控因子的调节,如IL-1、TNF-α、TGF-β等能增加破骨细胞的表达,而各种刺激骨吸收的因子如由PTH通过促进成骨细胞表达RANKL,降低表达OPG介导的[8]。RANKL是破骨细胞前体细胞分化为成熟破骨细胞的必需因子,可促进破骨细胞分化,增强成熟破骨细胞活力,阻止破骨细胞凋亡。RANKL主要由骨髓间质细胞和成骨细胞分泌,破骨细胞不分泌RANKL。RANKL的受体RANK 是一种跨膜蛋白,主要存在于骨髓巨噬细胞的表面[9-10]。运动可以改善血液OPG/RANKL的比例,影响成骨细胞和破骨细胞数目或活性,导致骨结构改变。有实验研究表明,250 km超长距离跑后第3天,血清破骨细胞分化因子(RANKL)和OPG水平较运动前有所上升[11]。此外,正向研究还发现雌激素可通过调节EphB4/EphrinB2信号通路抑制破骨细胞分化,说明雌激素对骨破坏有抑制作用[12],李丽辉等[13]的研究也表明3个月的持续运动,去卵巢大鼠骨组织的OPGmRNA的表达显著高于模型组大鼠。何淑敏等[14]通过对生长期大鼠进行12周的耐力性运动训练,结果显示OPG水平高于对照组。本实验中8周实验后,骨质疏松模型组大鼠的OPG含量明显低于正常对照组,而60 min运动组大鼠血清OPG的含量明显高于骨质疏松模型组,RANKL的水平低于骨质疏松模型组(P<0.01),其机制可能是规律性的运动训练提高OPG的分泌,提高了OPG/RANKL的比例,能够改善大鼠由于去卵巢而导致的骨质疏松症状。30 min运动组的大鼠8周运动训练后,OPG的水平高于骨质疏松模型组(P<0.05),而RANKL的分泌量与模型组差异不显著,这可能与运动的负荷有关。
IGF-1是骨骼中含量最丰富的生长因子之一,是包括成骨细胞在内多种细胞的促有丝分裂剂,它以自分泌和旁分泌的形式调节骨骼细胞的功能,促进成骨细胞增殖、分化和募集,抑制细胞凋亡,刺激骨胶原的转录和DNA合成,抑制胶原的降解,增加骨基质沉积。Thomas等[15]使用IGF-1刺激体外培养的基质细胞(hBMSC,是骨髓中具有分化潜能的非造血细胞,能进一步分化为成骨细胞),发现IGF-I以及它们的受体活性类似物能显著促进hBMSC的增殖和分化。本实验中8周训练后,60 min运动组大鼠血清中IGF-1的水平高于骨质疏松模型组,并且与OPG的水平成正相关,而与RANKl的水平成负相关,说明IGF-1促进骨细胞的增长,抑制骨的吸收,其可能的机制还待进一步的研究。
参考文献
[1]李世昌,季浏,刘体伟,等,不同方式运动对去卵巢大鼠骨密度、骨生物力学及代谢指标的影响[J].体育学刊,2012,19(2):132-137.
[2]李长天,王雅莉,陈雁飞,等.葛根素对去卵巢大鼠体重及大脑海马CA1区CA3区神经元形态的影响[J].中国老年学杂志,2012,10(32):4426-4428.
[3]李洪洋.去势雌鼠固执骨质疏松模型研究[J].现代预防医,1992,17(19):1-3.
[4] Dalle Carbonare L,Valenti M T,Zanatta M,et al. Circulating esenchymal stem cells with abnormal osteogenic differentiation in patients with osteoporosis[J].Arthritis Rheum,2009,60(11):3356-3365.
[5]王俊玲,黄思敏,梁启瑶,等.雌激素的来源及其在骨代谢中的作用[J].中国骨质疏松杂志,2015,6(21):729-732.
[6]查小云,胡予.骨质疏松相关信号通路研究进展[J].中国骨质疏松杂志,2014,20(2):205-209.
[7]丁从珠,姚瑶,方芸,等.青藤碱对胶原诱导的关节炎大鼠血清OPG/RANKL、IL-17含量的影响[J].南京中医药大学学报,2012,28(4):330-333.
[8] Huang J C,Sakata T,Hleger L L,et al.PTH differentially regulates expression of RANKL and OPG[J].J Bone Miner Res,2004,19(4):235-244.
[9] Asanuma Y,Chung C P,Oeser A,et al. Serum osteoprotegerin is increased and independently associated with coronaryartery atherosclerosis in patients with rheumatoid arthritis[J]. Atherosclerosis,2007,195(2):e135-e141.
[10] Silva I,Branco J C. RNAK/RANKL/OPG:literature review[J]. Acta Reumatol Port,2011,36(3):209-218.
[11] Kerschan-Schindl K,Thalmann M,Sodeck G H,et al. A 246-km continuous running race causes significant changes in bone metabolism[J]. Bone,2009,45(6):1079-1083.
[12]史淇月,杨柳,魏铂沅,等.雌激素通过调节 EphB4/EphrinB2信号参与破骨细胞分[J].中国骨质疏松杂志,2014,20(4):347-352.
[13]李丽辉,杨杰,董洁琼,等.运动对去卵巢骨质疏松大鼠OPG、RANKL表达的影响[J].中国运动医学杂志,2013,32(11):991-996.
[14]何淑敏,陈明.耐力训练对生长期大鼠血清OPG,sRANKL及骨代谢生化因子、骨量的影响[J].中国运动医学杂志,2010,29(5):560-562.
[15] Thomas T,Gori F,Spolsberg T G,et al.Response of bipotential human marrow stromal cells to insulin-like factors:effect on binding protein production,proliferation and commitment to osteoblasts and adipocytes[J].Endocrinology,1999,50(36):5044.
The Research on Different Load Exercise to the Bone Mechanism of Osteoporosis in Ovariectomized Rats
/WANG Shi-chong,CHANG Qing,ZHENG Shuai,et al.//Medical Innovation of China,2016,13 (03):022-024
【Abstract】Objective: To explore the mechanism of exercise in treating osteoporosis by detecting the osteoprotegrin(OPG),receptor activator of nuclear factor kappa B ligand (RANKL)and insuline growth factor-1(IGF-1). Method: Female Sprague-Dawley rats were randomly divided into normal control group,sham-operated group,model group,30 min exercise group and 60 min exercise group,and the exercise group continuous training 8 weeks. The rats were executed,the serum were tested. Result:After 8 weeks,compared with the control group,the weight of the model group and 30 min exercise group increased raised significantly (P<0.05). Compared with the control group,the expression of OPG and IGF-1 decreased much significantly in the model group,and the RANKL increased apparently(P<0.01). The OPG and IGF-1 in 60 min exercise group increased much significantly compared with that of the model group (P<0.01),the OPG also increased in the 30 min exercise group (P<0.05).Conclusion: Exercise can regulate OPG and RANKL expression in osteoclast differentiation pathway to ovarian rats,IGF-1 may be involved in the regulation of OPG. Exercise can prevent and treat osteoporosis in ovariectomized rats.
【Key words】Ovariectomized rats; Exercise; OPG; RANKL; IGF-1
收稿日期:(2015-05-12) (本文编辑:蔡元元)
doi:10.3969/j.issn.1674-4985.2016.03.007
通信作者:钟卫权
*基金项目:国家级大学生创新训练项目(201310313001)

