不同浓度、作用时间白花蛇舌草注射液对MG-63细胞凋亡效果*
谢克恭唐毓金黄煜朗黄可陆路林佳杰卢贤哲
不同浓度、作用时间白花蛇舌草注射液对MG-63细胞凋亡效果*
谢克恭①唐毓金①黄煜朗①黄可①陆路①林佳杰①卢贤哲①
【摘要】目的:探讨白花蛇舌草注射液对人骨肉瘤MG-63细胞凋亡的诱导作用。方法:采用一定浓度的乙醇提取白花蛇舌草有效成分,将其配制成50、100、200、400 μL/mL 4种不同浓度的白花蛇舌草注射液,并注入到体外培养的人骨肉瘤MG-63细胞的培养液中。采用MTT法检测不同浓度白花蛇舌草注射液对人骨肉瘤MG-63细胞作用12、24、48 h后的细胞增殖抑制率,并采用RT-PCR半定量检测凋亡相关基因Bax的mRNA表达情况。同时拟用流式细胞仪(FCM)检测白花蛇舌草注射液对人骨肉瘤MG-63细胞凋亡率。结果:MTT法检测结果显示,随着白花蛇舌草注射液浓度和作用时间的不断增加,人骨肉瘤MG-63细胞增殖抑制率均明显增大;当白花蛇舌草注射液浓度达100 μL/mL时,随着作用时间延长,Bax基因表达显著升高(P<0.05)。流式细胞仪检测显示,经白花蛇舌草注射液处理后,人骨肉瘤MG-63细胞凋亡率随白花蛇舌草注射液浓度的增加而不断升高。结论:白花蛇舌草注射液通过上调Bax基因表达能诱导人骨肉瘤MG-63细胞凋亡,且随着白花蛇舌草注射液浓度增加,人骨肉瘤MG-63细胞凋亡率亦不断增加。
【关键词】白花蛇舌草注射液; MG-63细胞; 细胞凋亡
①右江民族医学院附属医院 广西 右江 533000
First-author’s address:Youjiang Medical College for Nationalities Affiliated Hospital,Youjiang 533000,China
在青少年中,骨肉瘤属于较为常见的恶性骨肿瘤,在恶性肿瘤中约占20%,传统治疗方法主要包括新辅助化疗、肿瘤切除或辅以化疗[1]。患有骨肉瘤患者,其5年生存率可达70%~80%,但骨肉瘤仍属于致残率、病死率较高的一种恶性肿瘤,对人们的生命健康造成严重的威胁[2]。采用中药辅助治疗法,具有前景好、价格低廉、不良反应少,药理作用广泛等优点。而中药白花蛇舌草是一种茜草科耳草属植物,中医学认为,白花蛇舌草具有清热解毒、活血散结、利水消肿的功效[3-5]。同时现代药理学研究表明,白花蛇舌草主要含有机酸类、黄酮类、多糖类等成分,具有抗氧化、抗菌、抗肿瘤以及增强免疫力等作用。目前,国外对白花蛇舌草方面的研究很少,而国内相对较多。据文献[6]表明,白花蛇舌草能对肿瘤细胞具有诱导凋亡、体外抑制等作用。本研究通过体外培养MG-63细胞,将不同浓度(50、100、200、400μL/mL)白花蛇舌草注射液在不同时间(12、24、48 h)作用于该细胞,采用MTT法和流式细胞仪检测其对MG-63细胞增殖抑制率和凋亡率,现将报道如下。
1 材料与方法
1.1 材料 白花蛇舌草注射液购自安徽凤阳科苑药业有限公司(国药准字号Z34020595,批号120601);MTT、二甲基亚砜(美国Sigma公司);人骨肉瘤MG-63细胞由广西医科大学科学实验中心惠赠,来自于中国科学院上海细胞库。
1.2主要试剂 胎牛血清、高糖DMEM培养基(美国Sigma公司);PBS(1×)、胰蛋白酶(1∶250)购自索莱宝科技有限公司;细胞培养瓶、15 mL离心管、96孔板(Corning公司);TRIzol试剂(Invitrogen公司);引物合成由大连宝生物工程有限公司完成;逆转录试剂(TaKaRa公司)2×Taq PCR MasterMix(KT201-01)MarkerI、SYBR试剂(TianGen公司);8联管(Axygen公司)。
1.3 实验仪器 CO2细胞培养箱、超低温冰箱MDF-U72V、MCO-18AIC(日本SANYO公司);生物安全柜BHC-1300ⅡA/83(苏净集团安泰公司);电热恒温水槽DK-8D型(上海精宏实验设备有限公司);台式离心机(上海安亭科学仪器厂);倒置显微镜(Leica型号DMIL),酶标仪(Nultiskan MK3 Thermo),PCR仪(BIO-RAD);水浴箱;摇床。
1.4 实验方法
1.4.1 细胞培养 将人骨肉瘤MG-63细胞接种于培养瓶,加入10%(体积分数)胎牛血清的DMEM培养基5 mL,置于5% CO2、37 ℃细胞培养箱中培养,每2天传代1次,取对数生长期的细胞用于实验。
1.4.2 MTT法检测 取对数生长期的细胞,并用0.25%胰酶消化,消化后加入培养基(DMEM)5 mL并吹打成混悬液,计数后调整细胞浓度,取150 μL(5×103个)接种于96孔板。采用一定浓度的乙醇提取白花蛇舌草有效成分,将其配制成浓度为50、100、200、400 μL/mL 4种不同的白花蛇舌草注射液,现配现用。待细胞贴壁后,弃去培养基,加入不同浓度含药液,并设立空白对照组(仅加入相同的培养基),每组5个复孔[7-9]。培养24 h后,加入20 μL的5 mg/mL MTT,再培养4 h后弃去含药液,加入150 μL DMSO,37 ℃恒温摇床震荡10 min后,在酶标仪上492 nm波长测定吸光度(A)值,取平均值,并计算细胞抑制率。计算公式:细胞增殖抑制率=(对照组A值-药物组A值)/对照组A值×100%。
1.4.3 Bax基因表达
1.4.3.1 提取总RNA 取对数生长期细胞,并调整为1×105个/mL,接种于培养瓶,待细胞贴壁后,加入100 μL/mL含药培养基5 mL,培养时间分别为12、24、48 h,根据Trizol提取试剂说明书提取总RNA。采用紫外分光光度计测量总RNA浓度,取A260/A280在1.80~2.20用于RT-PCR。
1.4.3.2 cDNA合成 参照逆转录试剂盒说明,将RNA逆转成cDNA。
1.4.3.3 PCR检测 25.0 μL反映体系包括SYBR Permix Ex TaqⅡ 12.5 μL,cDNA 1.0 μL,ddH2O 10.5 μL。将25.0 μL设5复孔,并加入8联管中,采用PCR仪行扩增,95 ℃变性30 s,95 ℃ PCR反应50 s、63 ℃退火30 s,共计40个循环的PCR反应,重复实验3次,反应结束后,计算2-△△Ct值[10-12]。具体见表1。
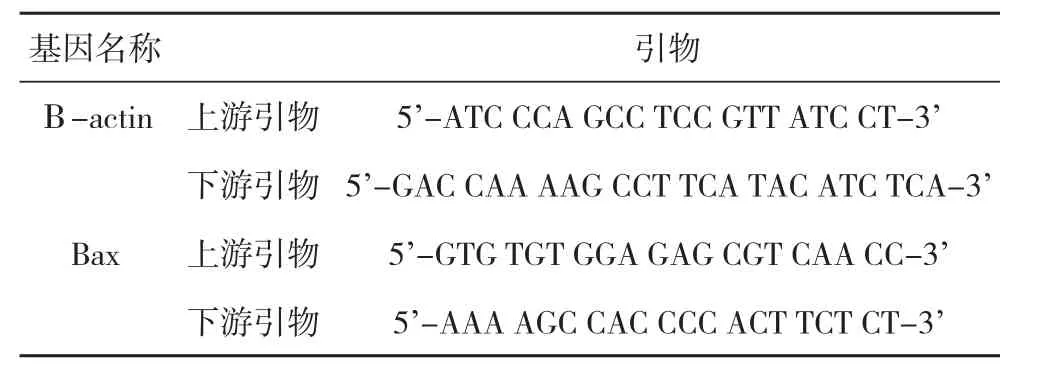
表1 Bax基因PCR反应2-△△Ct值
1.4.4 流式细胞仪检测 取对数生长期细胞数为5×106/mL的MG-63细胞,分别接种于4个50 mL细胞培养瓶内,待细胞贴壁后换液。空白对照组加入4 mL新鲜培养液,实验组加入不同浓度的白花蛇舌草注射液(50、100、200、400 μL/mL)。48 h后,均加入0.25%胰蛋白酶消化细胞,并采用磷酸盐缓冲液洗涤细胞2次(离心5 min,2000 r/min),收集细胞2×105个细胞后,加入500 μL的Binding Buffer悬浮细胞,再加入5 μL的Annexin-V-FITC,均匀混合后,加入5 μL碘化丙啶(PI),均匀混合后,室温避光反应10 min后,采用流式细胞仪检测细胞凋亡率。
1.5 统计学处理 本次统计数据采用SPSS 13.0统计学软件进行分析,计量资料采用(±s)表示,比较采用t检验,计数资料以率(%)表示,比较采用 χ2检验或确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度的白花蛇舌草注射液对人骨肉瘤MG-63细胞增殖的抑制作用 MTT法检测结果显示:白花蛇舌草注射液对MG-63细胞的抑制作用呈依赖关系,当其浓度200 μL/mL时,作用24 h后,大部分细胞脱落、变圆、死亡。当浓度为50 μL/mL时,抑制作用不明显(P>0.05),而浓度为100 μL/mL时,具有显著的抑制作用(P<0.05)。在倒置显微镜下观察浓度为100 μL/mL白花蛇舌草注射液对MG-63细胞不同作用时间的细胞形态,空白对照组细胞狭长、形态多样,紧密地贴壁生长,实验组(12、24、48 h)细胞随着作用时间延长,细胞逐渐皱缩且细胞间间隔变大,增殖被抑制,见表2。
表2 不同浓度的白花蛇蛇注射液对人骨肉瘤MG-63细胞增殖抑制率(±s) %
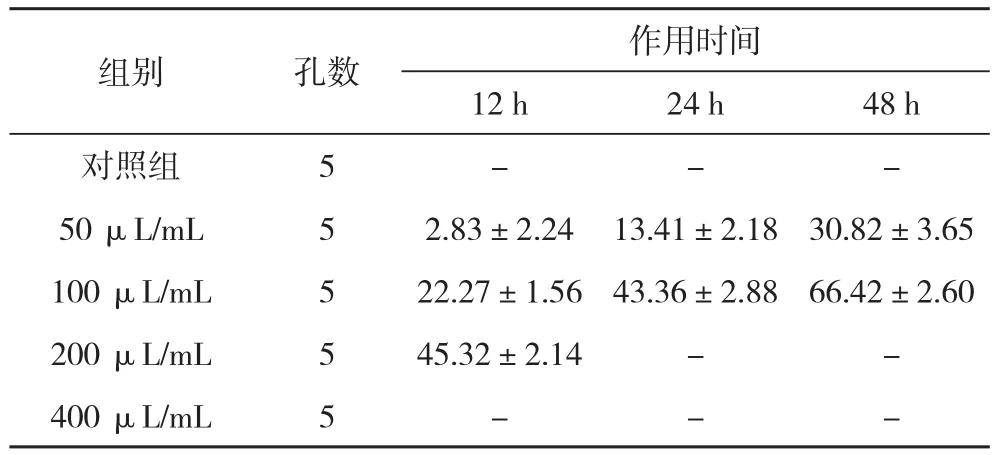
表2 不同浓度的白花蛇蛇注射液对人骨肉瘤MG-63细胞增殖抑制率(±s) %
组别 孔数 作用时间12 h 24 h 48 h对照组 5 - - -50 μL/mL 5 2.83±2.24 13.41±2.18 30.82±3.65 100 μL/mL 5 22.27±1.56 43.36±2.88 66.42±2.60 200 μL/mL 5 45.32±2.14 - -400 μL/mL 5 - - -
2.2 Bax基因表达 PCR检测结果显示,取100 μL/mL白花蛇舌草注射液分别作用于MG-63细胞12、24、48 h后,Bax基因表达水平分别为(5.370±0.386)、(7.750±0.293)、(16.950±0.331),均明显高于空白对照组的(1.00±0.00),组间数据比较差异有统计学意义(P<0.05),且呈时间依赖性,提示白花蛇舌草注射液抑制细胞增殖可能通过上调Bax基因表达而实现的。
2.3 流式细胞仪检测细胞凋亡情况 将分别与50、100、200、400 μL/mL白花蛇舌草注射液作用48 h 的MG-63细胞用Annexin-V-FITC和碘化丙啶双染后,采用流式细胞仪对细胞的凋亡情况进行分析。结果实验组细胞凋亡率分别为17.71%、19.16%、23.42%、31.25%,与空白对照组的0.61%、0.45%、0.33%、0.17%比较差异均有统计学意义(P<0.05)。
3 讨论
细胞凋亡是在凋亡信号作用下,由基因调控细胞主动死亡的过程,其形态主要表现为染色质凝聚边集、形成凋亡小体及细胞固缩[13-15]。现代研究认为,采用药物治疗肿瘤,主要是通过诱导细胞凋亡而实现治疗的目的。Bax基因属于Bcl-2基因家族中的一种促进基因,具有调节细胞凋亡的作用,且能表达于多种肿瘤细胞中,其抗肿瘤机制是通过改变线粒体膜通透性,使细胞中的小分子物质及色素C进入细胞质中,从而激活Caspase-3,导致与DNA修复及细胞周期等相关蛋白失活而实现细胞凋亡[16-18]。若Bax基因过度表达,则会形成Bax-Bax二聚体,诱导细胞凋亡;而Bcl-2基因表达增高,则会形成Bax-Bcl-2二聚体,将会使细胞凋亡被抑制。因此,从一定程度上来看,Bax基因与Bcl-2基因的比例将决定细胞是否凋亡[19-21]。
白花蛇舌草是一种茜草科耳草属植物,具有清热解毒、利水消肿的功效。近几年研究发现,白花蛇舌草的主要成分包括有机酸类、黄酮类、多糖类等成分,具有抗氧化、抗菌、抗肿瘤以及增强免疫力的作用[22-23]。白花蛇舌草注射液为中药白花蛇舌草提取支撑的单味药灭菌水溶液。本研究发现浓度为100 μL/mL的白花蛇舌草注射液作用12 h后,MG-63细胞逐渐缩小、核深染,随着作用时间延长,细胞边缘、悬浮死亡,与蒋章等[24]学者研究结果一致。PCE检测结果显示,促凋亡的Bax基因高表达,表明白花蛇舌草注射液抑制细胞增殖抑制可能通过上调Bax基因表达而实现的。
抗癌药物本身的细胞毒副作用是一个较为棘手的问题。因此,能寻找到抑制癌细胞增殖并诱导其凋亡,且毒副作用小的天然药物具有非常重要的意义[25]。本研究结果肯定了白花蛇舌草对人骨肉瘤MG-63细胞的体外抑制和诱导作用,但其发挥作用的组成成分及抑制肿瘤细胞的增殖和促进细胞凋亡的机制尚不明确,有待进一步研究证实。
参考文献
[1]黄煜朗,唐毓金,王俊利,等.白花蛇舌草对人骨肉瘤MG-63细胞Bax基因表达的影响[J].重庆医学,2014,17 (35):4708-4710.
[2] Ren L,Yang K. Bio-functional design for metal implants,a new concept for development of metallic biomaterials[J]. Journal of Materials Science & Technology,2013,51(11):1005-1010.
[3]谢克恭,唐毓金,黄煜朗,等.白花蛇舌草注射液对人骨肉瘤MG-63细胞增殖抑制作用的实验研究[J].中国基层医药,2015,22(5):663-665.
[4]张翔,叶宝东,林圣云,等.白花蛇舌草注射液对多发性骨髓瘤细胞株RPMI8226增殖的影响[J].中国中西医结合杂志,2012,32(12):1658-1662.
[5] Zhu W,Zhang Z X,Gu B B,et al. Biological activity and antibacterial property of nano-structured TiO2coating incorporated with Cu prepared by micro-arcoxidation[J]. Journal of Materials Science & Technology,2013,51(3):237-244.
[6] Hiroshi Ogawa,Teerasak Damrongrungruang,Sayaka Hori,et al. Effect of periodontal treatment on adipokines in type 2 diabetes[J]. World Journal of Diabetes,2014,21(6):924-931.
[7]陈小红,高瑞兰,陈益民,等.白花蛇舌草注射液对HL-60细胞凋亡相关基因和蛋白表达的影响[J].中国中医药科技,2012,19(3):226-228.
[8]车杭盈.白花蛇舌草注射液诱导非小细胞肺癌A549细胞凋亡的机制研究[J].中西医结合研究,2014,25(1):20-22.
[9] Li N,Zheng Y F. Novel magnesium alloys developed for biomedical application:a review[J]. Journal of Materials Science &Technology,2013,51(6):489-502.
[10]倪卓,王应,王双,等.PEEK-HA生物复合材料对MG-63细胞的作用[J].深圳大学学报(理工版),2014,35(3):258-265.
[11]施剑明,殷嫦嫦,殷明,等.野菊花总黄酮联合顺铂对人骨肉瘤MG-63细胞抑制作用[J].中成药,2014,36(10):2013-2017.
[12] Motamedian S R,Hosseinpour S,Ahsaie M G,et al. Smart scaffolds in bone tissue engineering: A systematic review of literature[J]. World Journal of Stem Cells,2015,21(3):657-668.
[13]唐新桥,朱宝玉,王万春,等.冬凌草甲素对骨肉瘤细胞增殖抑制和凋亡诱导效应的机制研究[J].中药新药与临床药理,2013,24(1):43-47.
[14] Chen A Z,Dang T T,Wang S B,et al. The in vitro and in vivo anti-tumor effects of MTX-Fe3O4-PLLA-PEG-PLLA microspheres prepared by suspension-enhanced dispersion by supercritical CO2[J]. Science China(Life Sciences),2014,15 (7):698-711.
[15] Gao X Y,Geng X J,Zhai W L,et al. Effect of combined treatment with cyclophosphamidum and allicin on neuroblastomabearing mice[J]. Asian Pacific Journal of Tropical Medicine,2015,15(2):137-141.
[16]施剑明,殷嫦嫦,孙维君,等.槲皮素联合顺铂对人骨肉瘤MG-63细胞增殖及凋亡的影响[J].中国药理学通报,2014,39(10):1361-1366.
[17]容智敏,郭奇峰,刘四红,等.新型钌(Ⅱ)配合物抑制骨肉瘤MG-63细胞增殖并诱导其凋亡[J].中华显微外科杂志,2013,36(4):356-359.
[18] Huang Y Y,Wang M J,Yang Z,et al. High efficient probes with Schiff base functional receptors for hypochlorite sensing under physiological conditions[J]. Chinese Chemical Letters,2014,21(7):1077-1081.
[19]张桦栋,吕智,冯毅,等.TK/GCV系统对骨肉瘤MG-63细胞杀伤的体外实验研究[J].中国骨伤,2014,24(3):240-243.
[20]祁琳,张鹏,屈野,等.LC调节人成骨样MG-63细胞表达OPG、RANKL分子机制的研究[J].中国骨质疏松杂志,2013,19(2):125-130.
[21] Li M,Ren L,Li L H,et al. Cytotoxic effect on osteosarcoma MG-63 cells by degradation of magnesium[J]. Journal of Materials Science & Technology,2014,50(9):888-893.
[22]张连昌,李东韬,赵学武,等.流体剪切应力对人骨肉瘤MG-63细胞周期相关基因表达的影响[J].解放军医学院学报,2014,35(11):1137-1140.
[23] Uysal I,Severcan E,Tezcaner A,et al. Co-doping of hydroxyapatite with zinc and fluoride improves mechanical and biological properties of hydroxyapatite[J].Progress in Natural Science:Materials International,2014,25(4):340-349.
[24]蒋章,张慧宇,张纲,等.RAMP1-siRNA对CGRP促MG-63细胞增殖作用影响的实验研究[J].实用口腔医学杂志,2015,28(3):339-342.
[25]李科伟,黄薇,许志鹏,等.脂联素对骨肉瘤MG-63细胞增殖和AMPK磷酸化的影响[J].中国医师杂志,2013,15 (5):581-585.
Effect of Different Concentration and Action Time Spreading Hedyotis Herb Injection Induced Mg-63 Cells Apoptosis
/XIE Ke-gong,TANG Yu-jin,HUANG Yu-lang,et al.//Medical Innovation of China,2016,13(03):001-004
【Abstract】Objective:To explore the effect of spreading hedyotis herb injection of bone sarcoma MG-63 cells apoptosis induction.Method:With a certain concentration of ethanol extraction of spreading hedyotis herb active ingredients,the mixture concentration of 50,100,200,400 μL/mL four different spreading hedyotis herb injection. And its injection into different concentrations of bone sarcoma MG-63 cells in vitro culture. Determined by MTT method was used to detect the different concentration of spreading hedyotis herb injection effect on bone sarcoma MG-63 cells,12,24 and 48 h after cell proliferation inhibition rate,and USES the quantitative RT-PCR detection of apoptosis related gene Bax mRNA expression. Cells and decodes the (FCM) spreading hedyotis herb injection of bone sarcoma with MG-63 cell apoptosis rate.Result:Determined by MTT method to detect the result shows that,with the spreading hedyotis herb injection concentration and action time,increasing bone sarcoma with MG-63 cell proliferation inhibition rate were significantly increased,when the concentration of spreading hedyotis herb injection up to 100 μL/mL,with the duration extension,Bax gene expression was significantly higher (P<0.05). Flow cytometry instrument detection showed that after spreading hedyotis herb injection treatment,bone sarcoma with MG-63 cells apoptosis rate with the increase of the concentration of spreading hedyotis herb injection and rising.Conclusion:Spreading hedyotis herb injection via increased Bax gene expression can induce bone sarcoma with MG-63 cell apoptosis,and with the increase of concentration of spreading hedyotis herb injection,bone sarcoma with MG-63 cells apoptosis rate also increased.
【Key words】Spreading hedyotis herb injection; MG-63 cells; Cell apoptosis
收稿日期:(2015-06-23) (本文编辑:蔡元元)
doi:10.3969/j.issn.1674-4985.2016.03.001
通信作者:唐毓金
*基金项目:广西医学科学实验中心开放基金课题(KFJJ2011-01)

