丹参注射液对小牛血去蛋白提取物稳定性的影响
陈艳春,单爱云,李春红,颜 晗
(1.广东省深圳市福田区中医院,广东 深圳 518034; 2.广东省深圳市药品检验所,广东 深圳 518057)
丹参注射液对小牛血去蛋白提取物稳定性的影响
陈艳春1,单爱云1,李春红1,颜 晗2
(1.广东省深圳市福田区中医院,广东 深圳 518034; 2.广东省深圳市药品检验所,广东 深圳 518057)
目的 考察丹参注射液对小牛血去蛋白提取物(DCBE)在0.9%氯化钠注射液中稳定性的影响。方法 采用高效液相色谱法测定丹参注射液与小牛血去蛋白提取物注射液配伍液中氨基酸的含量变化,Folin-酚法测定多肽的含量,同时观察配伍液的外观、pH、微粒数变化。结果 配伍液在6 h内的外观、pH、含量均无明显变化;不溶性微粒在2 h内符合药典规定,2 h后不符合药典规定。结论 在临床使用中,为了安全起见,丹参注射液和小牛血去蛋白提取物应分开在不同输液瓶中使用,且需使用间隔液。
丹参注射液;小牛血去蛋白提取物;稳定性;高效液相色谱法
小牛血去蛋白提取物(DCBE)与丹参注射液联合先后输注时,在输液管中是否存在配伍禁忌和是否需要使用间隔液的问题,药品说明书中未作明确说明,且相关文献报道也较少。本研究模拟临床用药浓度考察丹参注射液对小牛血去蛋白提取物稳定性的影响,旨在为临床合理用药提供依据。
1 仪器与试药
1.1 仪器
HP-1100型高效液相色谱仪;VWD型紫外检测器;HP-1100型化学工作站;Delta320型pH计(Mettler公司)。
1.2 试药
牛血清白蛋白对照品(中国药品生物制品检定所,批号为 140619-201120,规格为每瓶24.9 mg);氨基酸对照品(安捷伦科技公司,批号为BCBP5487V,规格为1 nmol/mL);丹参注射液(正大青春宝药业有限公司,批号为1403061,规格为每支10 mL);小牛血去蛋白提取物注射液(武汉人福制药有限公司,批号为201614074-1,规格为每支400 mg);0.9%氯化钠注射液(广西裕源药业有限公司,批号为L14050305,规格为每瓶500 mL)。
2 方法与结果
2.1 氨基酸含量测定
2.1.1 色谱条件
色谱柱:HP ODS Hypersil C18柱(200 mm×4.6 mm,5 μm);流速:0.4 mL/min;柱温:40℃;检测波长:254 nm;进样量:10 μL;内标法;流动相:A为0.1 mol/L醋酸钠溶液(pH=6.7)-乙腈(93∶7),B为乙腈-水(4∶1),线性梯度洗脱,0 min时0 B,12 min时15%B,30 min时34%B,31 min时100%B,40 min时100%B,41 min时0 B,50 min时0 B。
短链直链淀粉通过三个步骤形成球晶:(1)淀粉链结合成双螺旋并形成簇;(2)结晶单元重排成纳米颗粒;(3)颗粒生长成为聚集体[16,23]。
2.1.2 溶液制备
分别精密量取一定量的18种氨基酸对照品,溶于200 mL 0.1 mol/L的盐酸中,使每种氨基酸的浓度约为 2.5 μmol/mL,并按一定配比制成 100,250,500,1 000 nmol/mL 4种浓度的氨基酸对照品溶液;精密称取注射用小牛血去蛋白提取物400 mg,加入灭菌注射用水溶解至10 mL,即得供试品溶液;取供试品溶液1 mL,加入丹参注射液1 mL,混合均匀后真空干燥,再加水至 1 mL,即得混合供试品溶液;称取正亮氨酸(Nle)适量,用0.1 mol/L的盐酸溶解稀释成0.5 g/L的溶液作为内标液。
精密量取氨基酸对照品溶液及供试品溶液各200 μL置1 mL离心管中,加入正亮氨酸内标液20 μL,加入1 mol/L的三乙胺-乙腈(139∶861)和0.1 mol/L的异硫氰酸苯酯(PITC)-乙腈(12∶988)各100 μL,摇匀,室温放置1 h,加入正己烷400 μL,摇匀,静置10 min,吸取下层溶液,用0.45 μm的滤膜滤过,即得衍生化的氨基酸对照品溶液和供试品溶液。
2.1.3 方法学考察
线性关系考察:分别取衍生化后的氨基酸对照品溶液和供试品溶液的滤液进样测定,以Nle为内标物,按内标法分别计算供试品中18种氨基酸的含量。以浓度(X)为横坐标、峰面积(Y)为纵坐标进行线性回归。结果见表1。
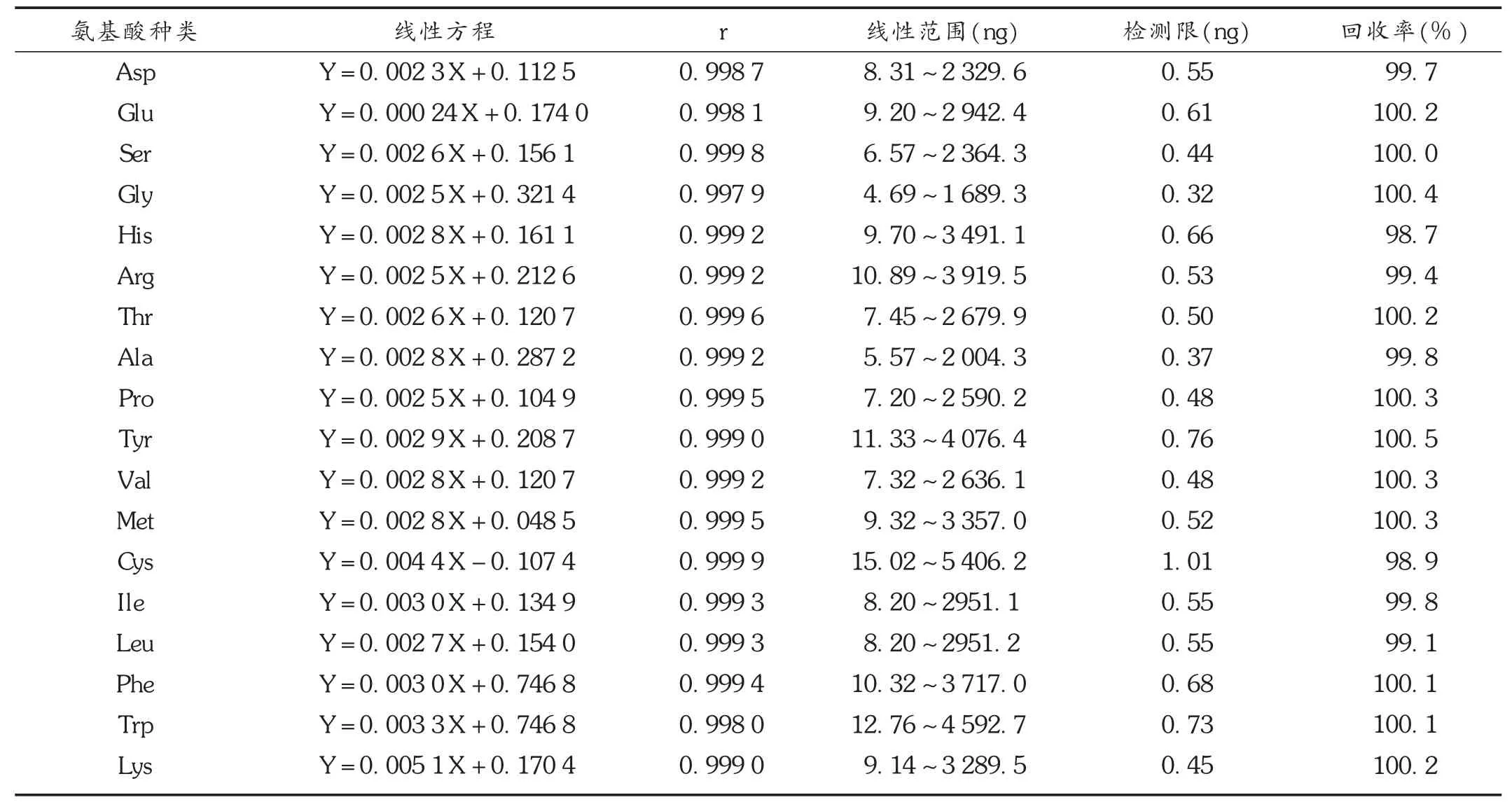
表1 18种氨基酸的线性方程、线性范围及检测限
精密度试验:精密量取氨基酸对照品混合溶液,重复进样5次,每次20 μL,计算峰面积。结果的 RSD为0.58%(n=5),表明仪器精密度良好。
加样回收试验:取已知含量的氨基酸对照品溶液加入原样中,分别测量原样和加入样的氨基酸含量,计算回收率。结果见表2。
取供试品溶液,按2.1.1项下色谱条件,分别于0,1,2,4,6 h时自动进样20 μL,测定峰面积,计算各时间点的相对百分含量,见表3。结果在6 h内各氨基酸的峰形、含量和保留时间均无明显变化,随着混合时间的延长,混合液中各种氨基酸的含量变化不大,见图1。
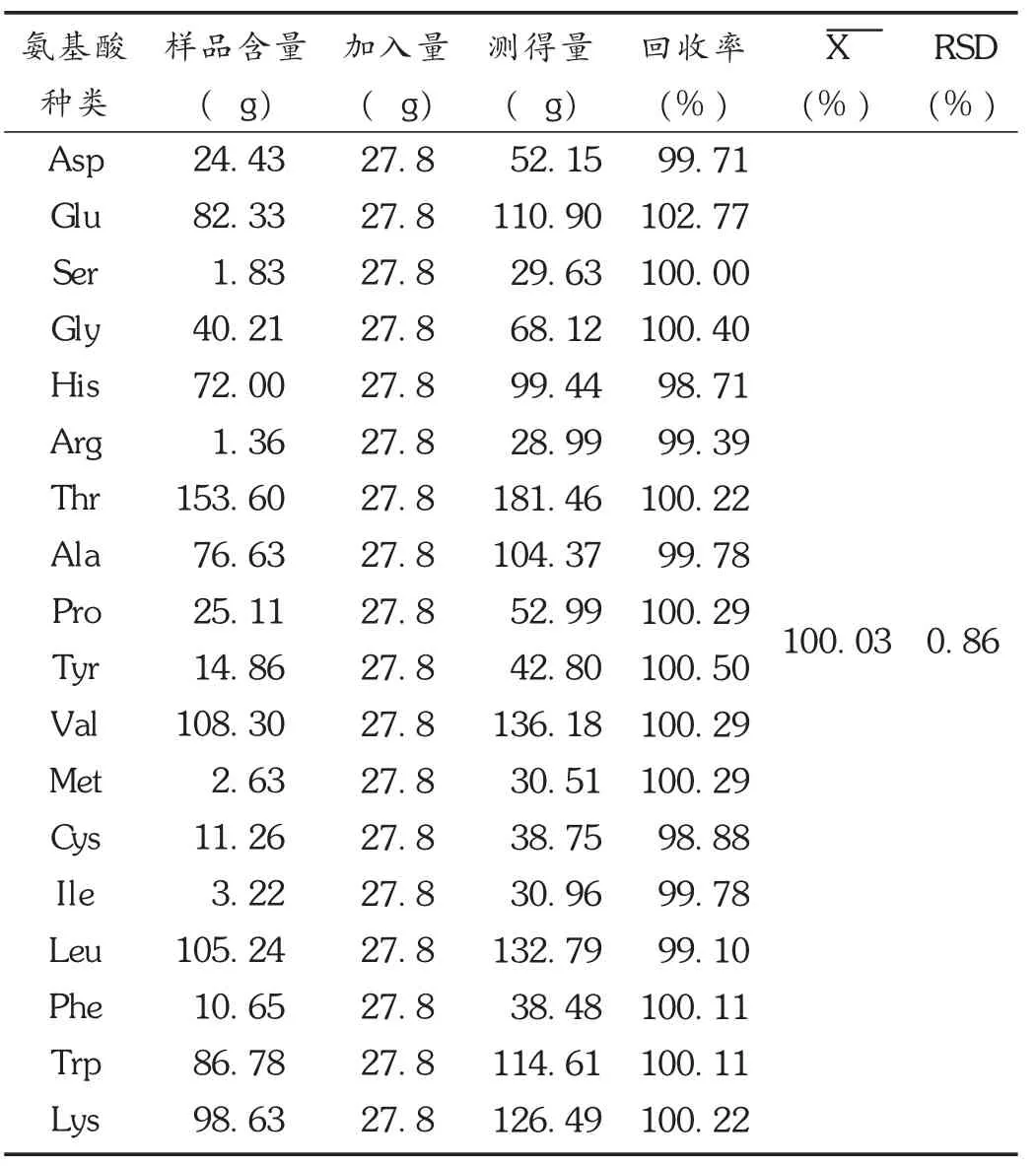
表2 18种氨基酸的加样回收试验结果(n=18)

图1 氨基酸含量测定高效液相色谱图
2.2 多肽含量测定(Folin-酚法)
2.2.1 溶液制备
取氢氧化钠10 g,碳酸钠50 g,加水400 mL溶解,作为甲液。取酒石酸钾0.5 g加水50 mL,使之溶解;另取硫酸铜0.25 g,加水30 mL使溶解,将2种溶液混合即得乙液。临用前混合甲、乙2种溶液,加水至500 mL,制成碱性铜供试品溶液。取牛血清白蛋白对照品15 mg,加水50mL,制成每100mL含0.3mg牛血清白蛋白对照品溶液。
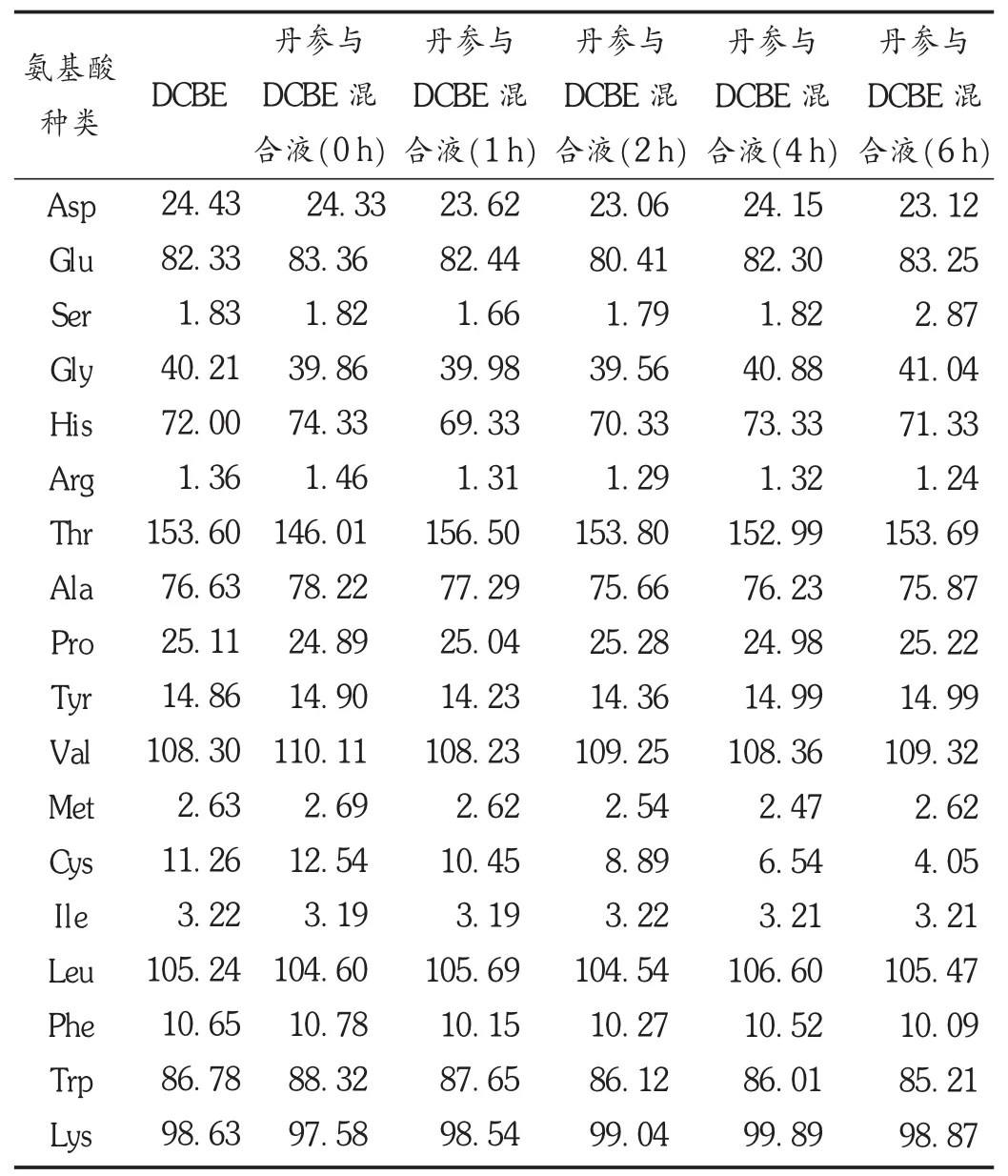
表3 DCBE中氨基酸含量与丹参、DCBE混合液中氨基酸的含量变化( g/mL)
2.2.2 标准曲线绘制
精密量取对照品溶液0,0.1,0.3,0.5,0.7,0.9 mL,分别置试管中,各加水至1.0 mL,摇匀,分别加入碱性铜试剂1.0 mL,摇匀;各加入福林酚试剂4.0 mL,立即混匀;置55℃水浴中反应5 min,再置冷水浴中10 min,按照药典中分光光度法要求,在650 nm波长处测量吸光度。以0号试管作为空白,以对照品溶液的浓度为横坐标(X)、相应吸光度值为纵坐标(Y)进行回归,得回归方程 Y=19.24 X+0.038 3。
2.2.3 含量测定
精密量取供试品溶液适量,分别于0,1,2,4,6 h时进样测定,通过回归方程求得供试品溶液的浓度,再乘以稀释倍数,即得多肽含量。结果见表4。可见,小牛血去蛋白提取物的多肽含量与加入了丹参注射液的小牛血去蛋白提取物中的多肽含量无明显差异。多肽是小牛血去蛋白提取物中的有效成分之一,能调节机体免疫力。
2.3 配伍稳定性试验
模拟临床用量,将0.4 g小牛血去蛋白提取物加入0.9%氯化钠注射液250 mL中,作为空白溶液;将0.4 g小牛血去蛋白提取物、20 mL丹参注射液加入250 mL 0.9%氯化钠注射液中作为配伍溶液,在室温(20±1)℃下,分别于0,1,2,4,6 h时进行下述项目的考察。
外观考察:在室温(20±1)℃下6 h内,配伍溶液外观均为棕红色液体,未见明显颜色变化,无沉淀和气体产生。

表4 多肽含量测定结果(n=5)
pH考察:各样品溶液在室温下放置6 h的pH变化见表5。

表5 各样品溶液pH变化测定结果
微粒数考察:对于标示装量为100 mL以上的静脉用注射液,药典规定每1 mL中含粒径不小于10 μm的微粒不得超过25粒,不小于25 μm的微粒不得超过3粒[1]。各样品溶液在6 h内不溶性微粒的考察结果见表6。
试验结果表明,在室温(20±1)℃下,丹参注射液与小牛血去蛋白提取物在0.9%氯化钠注射液中配伍后,其外观、pH均无明显变化,但随着时间的延长,不溶性微粒数逐渐增加。
3 讨论
小牛血去蛋白提取物是从发育旺盛的健康小牛血中提取的一种生物活性物质,含天然氨基酸、小分子肽、糖脂、核苷、碳水化合物及其他生物活性物质,主要用于缺血性脑血管病的神经保护治疗[2],在临床主要用于神经科,常与活血化瘀类中药注射剂联合使用,疗效优于单用。
中药注射剂成分复杂,若与其他药物配伍不当,则会产生一系列变化,包括溶液的pH、颜色、澄明度改变及药效的协同和拮抗作用,进而影响药效,甚至产生不良反应。本研究中尝试选出代表药物丹参注射液,将其与小牛血去蛋白提取物模拟临床用药浓度混合,判定其在输液管中接触时是否发生配伍反应和是否需要使用间隔液,以期为小牛血去蛋白提取物的临床安全、合理、有效使用,减少药源性疾病,完善说明书提供参考依据。
多肽含量测定中,Folin-酚试剂由甲、乙两部分试剂组成,甲试剂使肽键在碱性条件下与碱性铜试剂中的Cu2+作用生成紫红色络合物;在碱性条件下,乙试剂中的磷钼酸-磷钨酸被络合物还原生成蓝色物质,通过蓝色的比色测定多肽的含量。
本研究中用Lowry法对小牛血去蛋白提取物与丹参注射液配伍液进行多肽含量测定[3],试验结果显示,多肽含量无明显变化。采用高效液相色谱(HPLC)法测定配伍液中游离氨基酸的含量变化[4-6],结果显示氨基酸含量无明显变化。配伍液在0.9%氯化钠注射液中6 h内,外观、pH也无明显变化,但不溶性微粒数却随着时间的延长明显增加,混合液在2 h后,不溶性微粒数已超过药典规定。不溶性微粒是考察配伍液临床使用的重要指标,其进入人体有可能造成严重危害,如血栓、静脉炎、肉芽肿、热原样反应等。因此,小牛血去蛋白提取物与丹参注射液混合液虽在2 h内不溶性微粒数符合药典规定,但在临床使用中为了安全起见,这2种药物还是应分开在不同的输液瓶中使用,且需使用间隔液。
[1]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:附录71-附录73.
[2]杨瑞芬,彭家钢,张 荻,等.高效液相色谱法测定丹参注射液丹参素与原儿茶醛含量[J].医药导报,2008,27(2):230-231.
[3]任淑萍.小牛血清去蛋白注射液与小牛血去蛋白注射液有效成分含量和生物活性的比较[J].中华神经医学杂志,2006,5(8):767-769.
[4]赵宗阁,王尊文,徐康森.国内小牛血、小牛血清去蛋白提取物注射液质量分析及其抗缺氧作用研究[J].药物分析杂志,2008,28(10):1 637-1 640.
[5]李爱菊,郑宏强,熊爱琴.小牛血去蛋白提取物注射液中游离氨基酸的含量测定[J].中国药业,2006,15(7):40.
[6]杜秀芳,刘伟娜,吴海燕,等.高效液相色谱法考察丹红注射液与10%氯化钾注射液配伍的稳定性[J].时珍国医国药,2008,19(6):1 342-1 343.
Influence of Danshen Injection on the Compatibility of Deproteinized Calf Blood Extract
Chen Yanchun1,Shan Aiyun1,Li Chunhong1,Yan Han2
(1.The Traditional Chinese Medicine Hospital of Futian District,Shenzhen,Guangdong,China 518034; 2.Shenzhen Institute for Drug Control,Shenzhen,Guangdong,China 518057)
Objective To study the influence of Danshen Injection on the compatibility of deproteinized calf blood extract in 0.9% sodium chloride.M ethods HPLC method was used to determine the content change of amino acids in the mixture of deproteinized calf blood extract injection and Danshen Injection.Folin-phenol method was used to determine the content of polypeptide,and the changes of the physical appearance,pH and particle count in the mixture were also examined.Results No significant changes in content,pH,or physical appearance were found within 6 h in the mixture;the amount of insoluble paticles accorded with the Chinese Pharmacopoeia within 2 h,and exceeded beyond which was permitted after 2 h.Conclusion For clinical safety concerns,deproteinized calf blood extract injection cannot be mixed with Danshen Injection,and the two should be separated by an infusion solution.
Danshen Injection;deproteinized calf blood;compatibility;HPLC
R969.2;R977.6
A
1006-4931(2016)08-0029-05
2015-11-14)

