NOD2在狼疮性肾炎患者肾脏组织中的表达
侯成成 潘宇航 黄祥奇 李秋霞 张曦 黄红月 金欧
510630 广州,中山大学附属第三医院风湿免疫科(侯成成,潘宇航,李秋霞,张曦,黄红月,金欧),病理科(黄祥奇)
NOD2在狼疮性肾炎患者肾脏组织中的表达
侯成成潘宇航黄祥奇李秋霞张曦黄红月金欧
510630 广州,中山大学附属第三医院风湿免疫科(侯成成,潘宇航,李秋霞,张曦,黄红月,金欧),病理科(黄祥奇)
【摘要】目的研究核苷酸结合寡聚化结构域2(NOD2)即CARD15在狼疮性肾炎(LN)患者肾脏组织中的表达和分布情况,探讨NOD2在LN中的作用。方法收集25例行病理活组织检查(活检)LN患者的肾脏组织,另取因肾实质性肿瘤行手术切除远离肿瘤2 cm以外的4例正常肾脏组织作为对照,采用免疫组织化学染色法检测2组肾脏组织中NOD2的表达分布情况,实时荧光定量PCR(qPCR)检测上述肾脏组织中NOD2 mRNA表达水平,分析LN患者NOD2 mRNA与临床指标的相关性。结果LN患者肾脏组织中NOD2表达较正常肾脏组织增高(P<0.01)。Ⅱ型LN仅肾小管上皮细胞内有少量NOD2表达,Ⅲ型和Ⅳ型LN肾小球上皮细胞(壁层上皮细胞、足细胞)、肾小管上皮细胞中均有NOD2表达,Ⅴ型LN肾小管上皮细胞内NOD2表达明显增强。Ⅱ~Ⅴ型肾脏组织中NOD2表达水平均比正常对照组升高(P均<0.01),并且各型肾脏组织中NOD2表达水平由低至高排列为Ⅱ型、Ⅴ型、Ⅲ型、Ⅳ型(P均<0.05)。qPCR检测发现LN患者肾脏组织中NOD2 mRNA水平较正常组升高(P<0.01)。LN患者肾脏组织NOD2 mRNA表达水平与临床指标无关(P均>0.05)。结论NOD2可能参与了LN的发病过程,可能是LN疾病进程中的一个重要炎症介质。
【关键词】系统性红斑狼疮;狼疮性肾炎;核苷酸结合寡聚化结构域2;
免疫组织化学染色;聚合酶链反应
Nucleotide-binding oligomerization domain containing 2; Immunohistochemistry;
Polymerase chain reaction
SLE是一种可以导致全身多器官及系统受累的慢性自身免疫紊乱性疾病,在我国发病率约为70/100 000、患病率约1/1 000,我国SLE患者数量为全球最多[1]。狼疮性肾炎(LN)是SLE患者最常见和最严重的并发症[2]。研究LN的发病机制对SLE的治疗及预后具有重要意义。有研究发现,模式识别受体(PRR)紊乱和各种免疫性疾病如SLE、类风湿关节炎等有关[3]。PRR可以通过识别保守的分子模式去鉴别病原相关分子模式(PAMP)和损害相关分子模式(DAMP)。但是,额外的信号可能会诱发对机体有害的免疫反应[4-6]。胞浆核苷酸结合寡聚化结构域(NOD)样受体(NLR)是PRR的一个新家族,可以识别胞外的PAMP,近年来越来越多的关注点开始集中于有关NLR的研究。NOD2(即CARD15)是NLR家族的一个典型成员,包含CARD结构域,识别肽聚糖中的胞壁酰二肽(MDP)。近年来,多项研究发现NOD2可能参与各种自体炎症及自身免疫性疾病[7-12]。有关NOD2与SLE、LN之间关系的研究较少。为此,本研究收集了LN患者肾脏活组织病理检查(活检)组织、正常肾脏组织及其临床生化及病理资料,观察肾脏组织中NOD2的表达分布情况,探讨NOD2在LN肾脏组织中表达的意义。
材料与方法
一、标本来源
收集2015年在我院风湿免疫科住院并行活检的25例LN患者肾脏组织(LN组)。25例LN患者中,男5例、女20例,年龄(26.5±4.1)岁,从发病至行肾穿刺明确诊断的病程(10.1±7.8)个月,SLE病情活动性评分(SLEDAI)为(11.5±1.1)分;补体C3、C4水平分别为(0.48±0.05)、(0.08±0.02)g/L。ESR(45.6±13.2)mm/h, CRP(4.13±0.22)mg/L;血尿素氮(6.78±2.01)μmol/L,血清肌酐(79.5±0.7)μmol/L,尿蛋白(0.89±0.14)g/d;LN病理分型为Ⅱ型5例、Ⅲ型6例、Ⅳ型8例、Ⅴ型6例。25例LN患者均经B超引导下行肾脏穿刺活检术证实为LN性肾炎病理改变,住院期间7例Ⅳ型LN患者接受500 mg的甲泼尼龙冲击治疗,其余患者根据病情的严重程度分别给予8~120 mg的甲泼尼龙治疗。另取同期在我院因肾实质性肿瘤行手术切除远离肿瘤2 cm以外的4例正常肾脏组织作为对照(正常对照组),经病理证实基本为正常肾脏组织,且患者无原发性肾小球肾炎、肾小管及肾间质疾病、高血压病、糖尿病等继发性肾脏疾病。上述患者均签署了本院标本收集的知情同意书,肾穿刺活检均是在确保患者安全的前提下进行的,且在行肾穿刺诊断明确之前均未给予肾上腺皮质激素(激素)和免疫抑制剂治疗。
二、主要试剂
包括:小鼠抗CARD15单克隆抗体(ab31488,Abcam公司,美国);小鼠抗CD68单克隆抗体(ab955,Abcam公司,美国);兔抗肾母细胞瘤WT-1单克隆抗体(ab89901,Abcam公司,美国);辣根过氧化物酶(HRP)标记羊抗鼠/兔IgG(谷歌生物公司);二氨联苯胺(DAB)显色液(谷歌生物公司);浓缩型山羊血清(谷歌生物公司);一抗稀释液(谷歌生物公司);Trizol总RNA抽提试剂(Invitrogen,美国);PCR引物(Life公司,美国);可去除DNA污染的逆转录试剂盒(TAKARA,日本);实时荧光定量试剂盒(TAKARA,日本)。
三、方 法
1. 标本采集
将上述29例肾脏组织经4%多聚甲醛固定,常规石蜡包埋、切片。另外收集上述25例LN患者中的6例患者的额外少许肾脏组织(Ⅲ型2例、Ⅳ型2例、Ⅴ型2例)及上述4例正常肾脏组织少许,先加入液氮研磨,然后加Trizol提取mRNA,再行实时荧光定量PCR(qPCR)检测。
2. 肾脏切片的病理评价
所有LN患者的肾脏组织都是在B超定位下采用自动活检针完成的。病理诊断由本院病理科医师完成。病理分型根据2003年国际肾脏病学会和肾脏病理学会有关LN的最新分型方案,分为:Ⅰ型系膜轻微病变性LN、Ⅱ型系膜增殖性LN、Ⅲ型局灶性LN、Ⅳ型弥漫性LN、Ⅴ型膜性LN、Ⅵ型终末硬化性LN[13]。
3. 肾脏组织中NOD2、CD68、WT-1表达水平的检测
CD68是单核细胞、巨噬细胞的特异性标记分子,由于NOD2已被发现可以表达在该类炎症细胞中,而LN患者肾脏组织中多有单核细胞及巨噬细胞的浸润,为观察NOD2在LN肾脏组织中的表达分布情况,本研究对肾脏组织进行连续切片,并依次对NOD2、CD68采用链霉菌抗生物素蛋白-过氧化物酶连结(SP)染色(CD68阳性地方提示为单核细胞和巨噬细胞)。以3.0 μm厚作连续切片,常规脱蜡、水化,3%过氧化氢封闭内源性抗原后,采用高压修复方式暴露抗原,5%的山羊血清室温封闭30 min后,弃除组织表面的山羊血清,每例组织连续作3张切片,标本依次滴加50 μl抗人CARD15的小鼠单克隆抗体(1∶100稀释)、50 μl抗CD68的小鼠单克隆抗体(1∶200稀释)、50 μl磷酸盐缓冲液(阴性对照),37℃组化湿盒孵育1 h。将切片用磷酸盐缓冲液冲洗后,每张切片组织滴加50 μl HRP二抗(Dako Envision复合物),37℃组化湿盒孵育30 min,DAB显色,光镜观察中止反应,苏木素染核,自来水返蓝终止显色,乙醇脱水后放入60℃恒温箱烘烤1 h后,放入二甲苯浸泡,取出切片,中性树胶封片,室温晾干。为证实NOD2在Ⅳ型LN肾小球内的具体表达细胞,本研究对8例Ⅳ型LN患者的连续切片行NOD2、WT-1染色(WT-1是足细胞的特异性标记分子),分别加一抗NOD2(1∶100稀释)、WT-1(1∶200稀释),其余步骤同前述。
4. 免疫组织化学染色结果判定
NOD2(即CARD15)阳性信号为棕黄色颗粒,定位于细胞质。CD68阳性信号为棕黄色颗粒,定位于细胞质。WT-1阳性信号为褐色,定位于细胞核。于显微镜下定位拍片,采用Bresalier半定量评分评价染色结果:双盲法在每张切片中随机选取10个视野,根据细胞染色强度分为4级,阴性染色计0分、浅黄色显色计1分、棕黄色显色计2分、棕褐色显色计3分,计算每一强度染色在该视野中所占的百分比,分别计算每个视野中各染色强度分值与其视野所占百分比的乘积之和,10个视野的平均值就是整张切片免疫组化染色定量结果。具体公式如下:染色强度得分(IS)=Σ(0×F0+1×F1+2×F2+3×F3)。
5. 肾脏组织中NOD2 mRNA表达水平检测
使用qPCR检测。采用Trizol提取肾脏细胞中的总RNA,紫外线分光光度计测浓度。当测量标本的光密度260/280比值位于1.8左右时,方可进行后续实验。根据测量结果将RNA浓度稀释至约200 μg/μl,再次测量得到准确浓度后进行RNA的逆转录反应。取等量RNA(500 ng),按照试剂盒说明书进行逆转录,将逆转录得到的模板DNA进行PCR扩增,总体系20 μl。引物序列:NOD2上游5’-ACCTTTGATGGCTTTGACG-3’,下游5’-CACCTT GCGGGCATTCTT-3’;GAPDH上游5’-GAAGGTGAAGGTCGGAGTC-3’,下游5’-GAAGAT GGTGATGGGATTTC-3’。反应条件: 95℃ 30 s预变性,95℃ 5 s、60℃ 34 s共40个循环,95℃ 15 s、60℃ 60 s、95℃ 15 s延伸。实验重复3次,GAPDH作为对照基因,计算目的基因NOD2的2-△△Ct值,比较LN组与正常对照组的NOD2 mRNA的表达水平。
四、统计学处理

结果
一、肾脏组织的免疫组织化学染色结果
NOD2(即CARD15)、CD68的连续肾脏组织切片染色发现,NOD2可表达在炎症细胞以外的肾脏固有细胞中。NOD2在正常肾脏组织的肾小球和肾小管内有少量表达,而在LN肾脏组织表达明显增多(t=9.104,P<0.001)。不同病理类型LN肾脏组织NOD2表达水平比较差异有统计学意义(F=69.333,P<0.001)。Ⅱ型LN仅肾小管上皮细胞内有少量NOD2表达,Ⅲ型和Ⅳ型LN肾小球上皮细胞(壁层上皮细胞、足细胞)、肾小管上皮细胞中均有NOD2表达,Ⅴ型LN肾小管上皮细胞内NOD2表达明显增强,正常对照组均未见着色,见图1。Ⅱ型、Ⅲ型、Ⅳ型、Ⅴ型肾脏组织中NOD2表达水平均比正常对照组升高(t分别为9.733、15.075、15.303、16.330,P均<0.001),Ⅲ型、Ⅳ型、Ⅴ型的肾脏组织中NOD2表达水平均高于Ⅱ型(t分别为9.179、14.912、13.212,P均<0.001),Ⅳ型的肾脏组织中NOD2表达水平高于Ⅲ型(t为2.777,P<0.05),Ⅲ型、Ⅳ型的LN肾小管上皮细胞内NOD2表达水平均高于Ⅴ型(t分别为2.917、7.258,P均<0.05),见表1。8例Ⅳ型LN患者的连续切片行NOD2、WT-1染色,可见Ⅳ型LN患者的足细胞内有NOD2的表达,见图2。
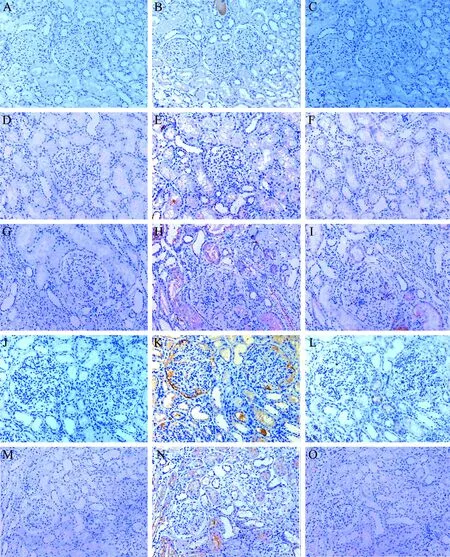
图1 不同病理类型LN组织与正常肾脏组织的NOD2表达(通用型二步法染色,×200倍)
A~C:正常对照肾脏组织的阴性对照染色、NOD2染色、CD68染色结果;D~F:Ⅱ型LN肾脏组织的阴性对照染色、NOD2染色、CD68染色结果;G~I:Ⅲ型LN肾脏组织的阴性对照染色、NOD2染色、CD68染色结果;J~L:Ⅳ型LN肾脏组织的阴性对照染色、NOD2染色、CD68染色结果;M~O:Ⅴ型LN肾脏组织的阴性对照染色、NOD2染色、CD68染色结果
表1 LN与正常肾脏组织的NOD2
注:与正常对照组比较,aP<0.01,bP<0.05;与Ⅱ型LN组比较,cP<0.01;与Ⅲ型LN组比较,dP<0.05;与Ⅳ型LN组比较,eP<0.01
二、肾脏组织的NOD2 mRNA表达水平检测结果
LN组肾脏组织NOD2mRNA表达水平是正常对照组的4.4倍,2组比较差异有统计学意义(7.77±1.69vs. 1.77±0.88,t=-5.579、P=0.001),见图3。
三、LN患者NOD2 mRNA与临床指标的相关性
对6例同时行免疫组织化学染色及荧光定量PCR的LN患者肾脏组织NOD2 mRNA水平和LN的临床指标行相关性分析,结果发现LN患者的肾脏组织NOD2 mRNA水平与SLEDAI、补体(C3、C4)、ESR、CRP、血清白蛋白、血清肌酐、血尿素氮、尿蛋白定量等临床指标均无关(P均>0.05),见表2。
讨论
SLE是一种复杂的系统性自身免疫性疾病,以多系统受累出现多种临床表现为特征,肾脏是最为为常见的受累器官,故LN的治疗对SLE的病情控制及预后极为重要[15]。随着社会的发展和医学的进步,SLE的治疗措施日趋完善,其生存率较以前大大提高。但是,目前LN的治疗主要应用激素和免疫抑制剂,起到缓解病情的作用,且不良反应较大。因此,探讨和阐明LN的发病机制,寻求有效的治疗措施,尤其是靶向治疗,对于改善患者病情和提高患者生存质量具有重要作用。

图2 Ⅳ型LN的连续切片中NOD2与WT-1的表达(通用型二步法染色,×200倍)
A:阴性染色;B:NOD2染色;C:WT-1染色

表2 LN患者NOD2 mRNA与临床指标的相关性

图3 LN组与正常对照组的肾脏组织NOD2 mRNA表达比较
与正常对照组比较,*P<0.01
LN是由大量免疫复合物沉积而介导的一种自身免疫性肾小球肾炎。既往多项研究发现,大量细胞炎症因子参与了LN的免疫炎症反应,促炎因子和抗炎因子之间的失衡程度决定了炎症的严重性和肾脏的损伤程度。NLR是机体激活固有免疫和诱导适应性免疫对抗病原微生物的重要分子[16]。其中最有代表性的是NOD1和NOD2,作用于共同的下游分子受体关联蛋白2(RIP2)即RICK,其含有丝氨酸、苏氨酸激酶,并具有CARD结构。NOD1和NOD2识别细胞内PAMP或内源性危险信号后诱导自身寡聚化,募集下游RIP2,并与RIP2发生嗜同种CARD-CARD相互作用,随后RIP2与IKK复合物(IKKC)相互作用,使NOD1或NOD2与IKKC连接,活化IKK,从而激活NF-κB,促进TNF-α、IL-1β、IL-6、IL-18等促炎细胞因子的转录。近年来,NOD2已经成为NLR家族广为研究的成员之一,被发现可能参与各种炎症及自身免疫性疾病[7-9]。既往研究发现,NOD2广泛表达于树突状细胞、巨噬细胞、潘氏细胞、肠上皮细胞、肺上皮细胞及口腔上皮细胞中,其基因的变异已被证实与克罗恩病、Blau 综合征及哮喘相关。NOD2可以被胞壁酰二肽类(MDP)激活,通过关联识别,NOD2经历了一个构象改变、NOD区域的寡聚体化从而引发RIP2的募集。随后NOD2的CARD与RIP2的CARD区域通过相互关联而结合,导致包括NF-κB、MAPK等多条信号通路的激活和促炎因子的产生。2010年首次发现NOD2在人和小鼠的肾小管上皮细胞表达[17]。NOD2敲除后可以明显改善肾缺血再灌注引起的损伤[18]。后来,Du等[19]发现NOD2也表达于糖尿病患者的肾小球系膜细胞、内皮细胞和足细胞中,且发现NOD2是胰岛素抵抗导致糖尿病肾病肾损伤信号传导通路的重要成员之一,敲除NOD2的糖尿病小鼠尿蛋白及肾损伤的情况明显改善。对于NOD2是否参与了LN的疾病进程,目前相关研究较少。有研究探讨了NOD2基因多态性在欧洲人群和亚洲人群中SLE易感性中的相关性,仅一项数据指出NOD2的rs2066845等位基因似乎与SLE的发生风险有关(OR=2.01,95%CI:1.01~4.03)[20]。
本研究通过免疫组织化学染色和PCR等方法初步检测了LN患者肾脏组织NOD2的表达水平及分布情况。免疫组织化学染色结果提示,正常对照组和Ⅱ型LN肾脏组织中NOD2表达较少,而Ⅲ、Ⅳ型LN肾脏组织中NOD2表达明显增强,且多表达在肾小球上皮细胞(壁层上皮细胞和足细胞)及肾小管上皮细胞中,而在Ⅴ型LN肾脏组织中,NOD2主要在肾小管上皮细胞表达增强。这可能与Ⅲ型和Ⅳ型LN的病情活动性较强,肾小球病变及炎症程度较重有关。荧光定量PCR结果也提示LN患者肾脏组织中NOD2 mRNA的表达水平较正常对照组明显升高,说明NOD2可能参与了LN病程中的炎症发生、发展过程。针对LN患者NOD2 mRNA水平和临床指标的相关性分析发现,肾脏组织中NOD2 mRNA水平与其临床指标均无关,这与之前在糖尿病肾病中的研究结果一致[19]。但由于行荧光定量的新鲜SLE肾脏组织收集困难,导致样本量不大,可能无法真正反映其与临床指标的相关性,日后还需扩大样本量进一步验证。
综上所述,LN患者肾脏组织中NOD2表达增加,提示NOD2可能参与了LN的疾病进展,但是尚需要扩大样本量及进一步行体外细胞模拟实验、动物实验深入研究,为阻止LN的进展提供理论基础。
参考文献
[1]Monteleone G, Pallone F, Macdonald TT. Interleukin-21 (IL-21)-mediated pathways in T cell-mediated disease. Cytokine Growth Factor Rev,2009,20(2):185-191.
[2]Rahman A, Isenberg DA. Systemic lupus erythematosus.N Engl J Med,2008,358(9):929-939.
[3]de Koning HD, Simon A, Zeeuwen PL, Schalkwijk J. Pattern recognition receptors in immune disorders affecting the skin.J Innate Immun,2012,4(3):225-240.
[4]Horton CG, Farris AD. Toll-like receptors in systemic lupus erythematosus: potential targets for therapeutic intervention.Curr Allergy Asthma Rep,2012,12(1):1-7.
[5]Horton CG, Pan ZJ, Farris AD. Targeting Toll-like receptors for treatment of SLE. Mediators Inflamm, 2010, 2010(pii): 498980.
[6]Richez C, Blanco P, Rifkin I, Moreau JF, Schaeverbeke T. Role for toll-like receptors in autoimmune disease: the example of systemic lupus erythematosus.Joint Bone Spine,2011,78(2):124-130.
[7]Yao Q. Nucleotide-binding oligomerization domain containing 2: structure, function, and diseases.Semin Arthritis Rheum,2013,43(1):125-130.
[8]Yao Q, Su LC, Tomecki KJ, Zhou L, Jayakar B, Shen B. Dermatitis as a characteristic phenotype of a new autoinflammatory disease associated with NOD2 mutations.J Am Acad Dermatol,2013,68(4):624-631.
[9]Correa RG, Milutinovic S, Reed JC. Roles of NOD1 (NLRC1) and NOD2 (NLRC2) in innate immunity and inflammatory diseases.Biosci Rep,2012,32(6):597-608.
[10]Carneiro LA, Magalhaes JG, Tattoli I, Philpott DJ, Travassos LH. Nod-like proteins in inflammation and disease.J Pathol,2008,214(2):136-148.
[11]Yao Q, Zhou L, Cusumano P, Bose N, Piliang M, Jayakar B, Su LC, Shen B. A new category of autoinflammatory disease associated with NOD2 gene mutations.Arthritis Res Ther,2011,13(5):R148.
[12]Yu SL, Wong CK, Wong PT, Chen DP, Szeto CC, Li EK, Tam LS. Down-regulated NOD2 by immunosuppressants in peripheral blood cells in patients with SLE reduces themuramyl dipeptide-induced IL-10 production.PLoS One,2011,6(8):e23855.
[13]Weening JJ, D’Agati VD, Schwartz MM, Seshan SV, Alpers CE, Appel GB, Balow JE, Bruijn JA, Cook T, Ferrario F, Fogo AB, Ginzler EM, Hebert L, Hill G, Hill P,Jennette JC, Kong NC, Lesavre P, Lockshin M, Looi LM, Makino H, Moura LA, Nagata M; International Society of Nephrology Working Group on theClassification of Lupus Nephritis; Renal Pathology Society Working Group on the Classification of Lupus Nephritis.The classification of glomerulonephritis in systemic lupus erythematosus revisited.Kidney Int,2004,65(2):521-530.
[14]Bresalier RS, Ho SB, Schoeppner HL, Kim YS, Sleisenger MH, Brodt P, Byrd JC. Enhanced sialylation of mucin-associated carbohydrate structures in human colon cancer metastasis. Gastroenterology,1996,110(5):1354-1367.
[15]许韩师,叶任高.狼疮肾炎的发病机制和治疗进展.新医学,2004,35(8):502-504.
[16]Brodsky IE, Monack D.NLR-mediated control of inflammasome assembly in the host response against bacterial pathogens.Semin Immunol,2009,21(4):199-207.
[17]Lech M, Avila-Ferrufino A, Skuginna V, Susanti HE, Anders HJ. Quantitative expression of RIG-like helicase, NOD-like receptor and inflammasome-related mRNAs in humans andmice.Int Immunol,2010,22(9):717-728.
[18]Shigeoka AA, Kambo A, Mathison JC, King AJ, Hall WF, da Silva Correia J, Ulevitch RJ, McKay DB.Nod1 and nod2 are expressed in human and murine renal tubular epithelial cells and participate in renal ischemia reperfusion injury.J Immunol,2010,184(5):2297-2304.
[19]Du P, Fan B, Han H, Zhen J, Shang J, Wang X, Li X, Shi W, Tang W, Bao C, Wang Z, Zhang Y, Zhang B, Wei X, Yi F.NOD2 promotes renal injury by exacerbating inflammation and podocyte insulin resistance in diabeticnephropathy.Kidney Int,2013,84(2):265-276.
[20]De Jager PL, Graham R, Farwell L, Sawcer S, Richardson A, Behrens TW, Compston A, Hafler DA, Kere J, Vyse TJ, Rioux JD.The role of inflammatory bowel disease susceptibility loci in multiple sclerosis and systemic lupus erythematosus.Genes Immun,2006,7(4):327-334.
(本文编辑:林燕薇)

Expression of NOD2 in renal tissue of patients with lupus nephritis
HouChengcheng,PanYuhang,HuangXiangqi,LiQiuxia,ZhangXi,HuangHongyue,JinOu.
DepartmentofRheumatologyandImmunology,theThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China
【Abstract】ObjectiveTo investigate the expression and distribution of nucleotide-binding oligomerization domain containing 2 (NOD2) in the renal tissues of patients diagnosed with lupus nephritis (LN), and explore the potential role of NOD2 in LN. MethodsThe renal tissues were obtained from 25 LN patients undergoing pathological biopsy. The kidney sample > 2 cm from the tumors was collected from 4 healthy controls who received surgical resection of renal tumors. The expression and distribution of NOD2 in the renal tissues of LN patients and normal controls were detected by immunohistochemistry. The messenger RNA (mRNA) level of NOD2 in the renal tissues was detected by fluorescence quantitative-polymerase chain reaction (qPCR) between two groups. The correlation between NOD2 mRNA level and clinical parameters was analyzed. ResultsImmunohistochemistry results demonstrated that the expression of NOD2 in LN patients was significantly higher than that of normal controls (P<0.01). NOD2 was slightly expressed in the glomerular epithelial cells of patients with type Ⅱ LN, detected in the glomerular epithelial cells (parietal epithelial cells and podocytes) and renal tubular epithelial cells of type Ⅲ LN cases, and significantly up-regulated in the renal tubular epithelial cells of type Ⅴ LN patients. The expression levels of NOD2 in renal tissues listed from low to high was type Ⅱ, Ⅴ, Ⅲ and Ⅳ (all P<0.05). qPCR analysis revealed that the mRNA level of NOD2 in the renal tissues of LN patients was significantly up-regulated than that in normal controls (P<0.01). In LN patients, the mRNA level of NOD2 was not correlated with clinical parameters (P>0.05). ConclusionNOD2 may participate in the pathogenesis of LN, and probably serves as a pivotal inflammatory mediator during the progression of LN.
【Key words】Systemic lupus erythematosus; Lupus nephritis;
(收稿日期:2015-12-07)
Corresponding author, Jin Ou
通讯作者,金欧
基金项目:中华医学会临床医学专项-风湿病学发展与研究资金项目(12040700370)
DOI:10.3969/j.issn.0253-9802.2016.02.009
·基础研究论著·

