活性维生素D3灌胃治疗大鼠糖尿病肾病的效果及其作用机制
徐园园,魏迎凤,卢学超,解其华,翟林云 (南通市第三人民医院,江苏南通226000)
活性维生素D3灌胃治疗大鼠糖尿病肾病的效果及其作用机制
徐园园,魏迎凤,卢学超,解其华,翟林云 (南通市第三人民医院,江苏南通226000)
摘要:目的观察活性维生素D3灌胃治疗大鼠糖尿病肾病的效果,并探讨其机制。方法 雄性SD大鼠40只,随机分为对照组、模型组、实验1组、实验2组及实验3组各8只。模型组、实验1组、实验2组及实验3组采用链脲佐菌素腹腔注射建立糖尿病肾病大鼠模型,对照组注射同体积的枸橼酸钾缓冲液。实验1、2、3组分别以0.03、0.06、0.12 μg/(kg·d)骨化三醇(活性维生素D3)灌胃,1次/d,模型组与对照组以等量花生油灌胃。各组均连续用药8周。灌胃结束后测定24 h尿蛋白(24 h UTP)、空腹血糖(FBG)、血清尿素氮(BUN)、血肌酐(Scr)、血钙、血磷、25-(OH)D3及甲状旁腺激素(PTH)。留取标本后处死各组大鼠,取肾脏组织,HE染色,光镜下观察肾脏病理学改变;采用免疫组化法检测各组大鼠肾脏组织中的转化生长因子β1(TGF-β1)、结缔组织生长因子(CTGF)蛋白。结果实验1、2、3组及模型组的FBG、24 h UTP、BUN、Scr均高于对照组(P均<0.05);实验1、2、3组的24 h UTP、BUN、Scr低于模型组,其中实验3组24 h UTP低于实验1组(P均<0.05)。实验1、2、3组肾脏病理改变较模型组减轻,以实验3组最为明显。模型组肾脏组织中TGF-β1、CTGF表达高于对照组(P均<0.05);实验1、2、3组TGF-β1、CTGF表达低于模型组,其中实验3组TGF-β1、CTGF表达低于实验1组(P均<0.05)。与实验1组相比,实验3组PTH水平下降,血钙、血磷水平升高(P均<0.05)。结论 活性维生素D3灌胃可减轻糖尿病肾病大鼠肾组织病理改变,改善肾功能,其机制可能与下调TGF-β1、CTGF表达有关;但活性维生素D3以0.12 μg/(kg·d)剂量使用将影响骨质代谢。
关键词:糖尿病并发症;糖尿病肾病;活性维生素D3;转化生长因子β1;结缔组织生长因子;动物实验
糖尿病肾病是导致糖尿病患者终末期肾衰竭的重要原因。目前认为转化生长因子β1(TGF-β1)和结缔组织生长因子(CTGF)是糖尿病患者肾小球硬化形成过程中的重要生长因子[1]。近年来,活性维生素D3的肾脏保护作用备受关注。2014年8~12月,本研究观察了活性维生素D3对大鼠糖尿病肾病的治疗作用,并探讨其机制。现报告如下。
1材料与方法
1.1实验动物及试剂健康雄性SD大鼠40只,清洁级,体质量(260±20)g,由南通大学实验动物中心提供。骨化三醇胶丸(活性维生素D3)购自上海罗氏制药有限公司;链脲佐菌素(STZ)购自美国Sigma公司,用前溶解于0.1 mol/L的柠檬酸缓冲液中,pH 4.5;兔抗大鼠TGF-β1多克隆抗体购自美国Abcam公司;兔抗大鼠CTGF多克隆抗体购自美国Abcam 公司;即用型SABC-POD(兔IgG)试剂盒购自武汉博士德生物工程有限公司。
1.2动物模型制作及活性维生素D3用法大鼠适应性喂养1周后,随机分为对照组、模型组、实验1组、实验2组及实验3组各8只。模型组、实验1组、实验2组及实验3组大鼠禁食12 h后以60 mg/kg的STZ于左下腹腔一次性注射制造糖尿病肾病模型,以建模72 h后血糖浓度≥16.7 mmol/L、尿量多于原尿量150%、24 h尿蛋白排泄率>30 mg判定为造模成功。对照组注射同体积的枸橼酸钾缓冲液[2]。实验1、2、3组将骨化三醇溶于0.05 mL花生油,分别以0.03、0.06、0.12 μg/(kg·d)灌胃,模型组与对照组以等量花生油灌胃。各组均连续用药8周。于实验第8周末收集大鼠尿液,采血,解剖肾脏去除包膜,留取肾脏组织。
1.3大鼠肾功能相关指标检测于实验第8周末留取标本后处死大鼠。处死前1 d,将大鼠放入洗净的代谢笼内,禁食不禁水,收集24 h尿液,用双缩脲法测定24 h UTP。采用全自动多功能生化分析仪进行测定FBG、血清BUN、Scr、血钙、血磷。采用罗氏电化学发光法检测血清25羟维生素D3[25-(OH)D3]。采用化学发光微粒子免疫分析法检测血清PTH。
1.4大鼠肾脏组织病理观察留取各组大鼠肾组织,置于4%中性甲醛固定,石蜡包埋,切片,行HE染色,光镜下观察肾组织病理改变。
1.5大鼠肾脏组织中TGF-β1、CTGF检测采用免疫组化法检测大鼠肾脏组织中TGF-β1、CTGF。以细胞质中出现棕黄色颗粒为TGF-β1、CTGF表达阳性,光镜下(400×)每张切片随机选取10个区域,采用Mias-2000图像分析系统测定阳性细胞的积分光密度,以此代表TGF-β1、CTGF相对表达量。
2结果
2.1各组大鼠肾功能相关指标比较实验1、2、3组及模型组的FBG、24 h UTP、BUN、Scr均高于对照组(P均<0.05);实验1、2、3组的24 h UTP、BUN、Scr低于模型组(P均<0.05),其中实验3组24 h UTP低于实验1组(P<0.05)。详见表1。
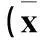
表1 各组大鼠肾功能相关指标比较±s)
注:与对照组相比,#P<0.05;与模型组相比,*P<0.05;与实验1组相比,△P<0.05。
2.2各组大鼠肾脏病理改变对照组肾小球体积正常,系膜细胞及基质正常,无炎症细胞浸润;模型组肾小球体积增大,肾小球系膜基质增宽,部分肾小球硬化,并有炎症细胞浸润;实验1、2、3组肾小球体积减小,系膜增生改善,炎症细胞减少,以实验3组最为明显。
2.3各组大鼠肾脏组织中TGF-β1、CTGF表达比较模型组肾脏组织中TGF-β1、CTGF表达高于对照组(P均<0.05);实验1、2、3组的TGF-β1、CTGF表达低于模型组(P均<0.05),其中实验3组TGF-β1、CTGF表达低于实验1组(P均<0.05)。详见表2。
2.4各组大鼠骨质代谢指标比较与对照组比较,模型组25-(OH)D3下降、PTH升高(P均<0.05);与模型组比较,实验1、2、3组25-(OH)D3升高、PTH下降,实验2组血磷水平升高,实验3组血钙、血磷水平升高(P均<0.05);实验2、3组25-(OH)D3、血磷水平高于实验1组(P均<0.05);实验3组PTH低于实验1组、血钙水平高于实验1组(P<0.05)。详见表3。
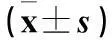
表2 各组大鼠肾脏组织中TGF-β1、CTGF表达比较
注:与对照组相比,#P<0.05;与模型组相比,*P<0.05;与实验1组相比,△P<0.05。

表3 各组大鼠25-(OH)D3、PTH、血钙、血磷水平比较±s)
注:与对照组相比,#P<0.05;与模型组相比,*P<0.05;与实验1组相比,△P<0.05。
3讨论
糖尿病肾病发病机制复杂,目前尚未阐明。糖尿病肾病的共同病理变化为细胞外基质(ECM)进行性积聚,细胞因子在此过程中起关键作用。在糖尿病肾病患者中,高血糖、蛋白糖基化、肾小球内压升高等因素均能刺激TGF-β1、CTGF等多种细胞因子过度表达,引起ECM合成及降解失衡,促使ECM在肾脏过度积聚,并最终导致肾小球硬化和肾间质纤维化。
TGF-β1是目前研究最多、最重要的促纤维化因子之一,其在糖尿病肾病的发生及发展过程中发挥重要作用。有报道,糖尿病肾病大鼠肾脏组织中TGF-β1mRNA、蛋白表达均显著增高,且与肾脏损害的严重程度相关[3,4]。TGF-β1参与了肾小球硬化发生发展的多个环节[5~8]。TGF-β1可通过smad3信号转导通路使肾小球系膜细胞合成过多纤维连接蛋白,加重肾小球硬化[5];TGF-β1可下调基质金属蛋白酶(MMP)表达,增强MMP特异性抑制物合成,从而促进系膜细胞合成及ECM分泌,导致基底膜增厚、系膜细胞增殖,引起肾小球硬化[6,7]。CTGF在维持细胞外基质的动态平衡中发挥重要作用[9]。CTGF可被TGF-β1诱导并激活,并可作为TGF-β1的下游介质,与TGF-β1共同参与肾小球肥大、系膜细胞增殖、ECM积聚等过程。Yamanaka等[10]在体外实验中抑制人结膜成纤维细胞内源性CTGF表达,发现即使在培养液中加入TGF-β1,Ⅰ型胶原蛋白、纤维连接蛋白等ECM成分表达也显著减少,说明CTGF表达受TGF-β1调节,同时也可调节TGF-β1活性。CTGF生物学效应较为单一,阻断CTGF表达或抑制其生物活性有望成为治疗肾脏纤维化的新手段。
活性维生素D3是一种脂溶性维生素,有调节钙磷代谢及骨质形成的作用。近期研究[11]证实,活性维生素D3还具有抗炎、抑制肾素血管紧张素系统、减少尿蛋白、调节免疫等作用。糖尿病肾病患者普遍存在活性维生素D3缺乏。研究[12,13]表明,应用活性维生素D3治疗糖尿病肾病大鼠可改善肾小球滤过屏障功能,减轻炎症反应,减轻足细胞损伤,减少蛋白尿,并可下调TGF-β1水平,从而起到延缓肾小球硬化的作用。杨烨等[14]发现TGF-β1表达水平越高,糖尿病肾病大鼠肾脏病理改变越严重,且活性维生素D3可通过下调TGF-β1表达而保护肾脏。目前尚无活性维生素D3治疗糖尿病肾病的相关标准,对于适宜药物剂量及该药对骨质代谢的影响仍未明确。
本研究制备了大鼠糖尿病肾病模型,并给予活性维生素D3干预,结果显示,实验1、2、3组的24 h UTP、BUN、Scr低于模型组,其中实验3组24 h UTP低于实验1组;实验1、2、3组肾脏病理改变较模型组减轻,以实验3组最为明显;实验1、2、3组的TGF-β1、CTGF表达低于模型组。上述结果再次证实TGF-β1、CTGF参与了糖尿病肾病发生发展[15],而给予活性维生素D3治疗可减轻肾脏组织病理改变,改善肾功能,这些治疗作用可能与下调TGF-β1、CTGF表达有关。值得注意的是,实验3组PTH水平下降,血钙、血磷水平升高,提示活性维生素D3剂量过大[0.12 μg/(kg·d)]可影响骨质代谢,故治疗剂量还应谨慎选择。对于临床如何使用活性维生素D3治疗糖尿病肾病仍需大量的循证医学证据,有待进一步研究。
参考文献:
[1] Qi W, Chen X, Poronnik P, et al. Transforming growth factor-beta/connective tissue growth factor axis in the kidney[J]. Int J Biochem Cell Biol, 2008,40(1):9-13.
[2] 李伟,张红,殷松楼,等.不同剂量链脲佐菌素诱导SD大鼠糖尿病肾病模型的研究[J].徐州医学院学报,2006,26(1):52-55.
[3] Guo B, Koya D, Isono M, et al. Peroxisome proliferator-activated receptor-gamma ligands inhibit TGF-beta 1-induced fibronectin expression in glomerular mesangial cells[J]. Diabetes, 2004,53(1):200-208.
[4] Hill C, Flyvbjerg A, Gronbaek H, et al. The renal expression of transforming growth factor-beta isoforms and their receptors in acute and chronic experimental diabetes in rats[J]. Endocrinology, 2000,141(3):1196-1208.
[5] Isono M, Chen S, Hong SW, et al. Smad pathway is activated in the diabetic mouse kidney and Smad 3 mediates TGF-beta-induced fibronectin in mesangial celIs[J]. Biochem Biophys Res Commun, 2002,296(5):1356-1365.
[6] McLennan SV, Fisher E, Martell SY, et al. Effects of glucose on matrix metalloproteinase and plasmin activities in mesangial cells: possible role in diabetic nephropathy[J]. Kidney Int Suppl, 2000,77:S81-87.
[7] Zhang D, Sun L, Xian W, et al. Low-dose paclitaxel ameliorates renal fibrosis in rat UUO model by inhibition of TGF-beta/Smad activity[J]. Lab Invest, 2010,90(3):436-447.
[8] Isaka Y, Fujiwara Y, Ueda N, et al. Glomerulosclerosis induced by in vivo transfection of transforming growth factor-beta or platelet-derived growth factor gene into the rat kidney[J]. J Clin Invest, 1993,92(6):2597-2601.
[9] Briqstock DR. The CCN family: a new stimulus package[J]. J Endocrinol, 2003,178(2):169-175.
[10] Yamanaka O, Saika S, Ikeda K, et al. Connective tissue growth factor modulates extracellular matrix production in human subconjunctival fibroblasts and their proliferation and migration in vitro[J]. Jpn J Ophthalmol, 2008,52(1):8-15.
[11] Williams S, Malatesta K, Keith Norris K. Vitamin D and chronic kidney disease[J]. Ethn Dis, 2009,19(4 Suppl 5):S5-8-11.
[12] Zhang Z, Zhang Y, Ning G, et al. Combination therapy with AT1 blocker and vitamin D analog markedly ameliorates diabetic nephropathy: blockade of compensatory renin increase[J]. Proc Natl Acad Sci U S A, 2008,105(41):15896-15901.
[13] 兰凯,罗群,周芳芳,等.帕立骨化醇对糖尿病肾病大鼠蛋白尿的影响[J].中华肾脏病杂志,2012,28(7):524-527.
[14] 杨烨,张园园,田燕燕,等.活性维生素D3对糖尿病肾病大鼠转化生长因子β1及相关因子的调节作用[J].中华内分泌代谢杂志,2015,31(1):66-70.
[15] 于倩,张沫,刘德敏.TGF-β1、CTGF基因的过表达与早期糖尿病肾病关系的研究[J].天津医药,2012,40(3):262-265.
(收稿日期:2015-10-27)
中图分类号:R587.1
文献标志码:A
文章编号:1002-266X(2016)03-0031-03
doi:10.3969/j.issn.1002-266X.2016.03.011
基金项目:南通市卫生局青年科研基金资助项目(WQ2014029)。

